心力衰竭大鼠肺脏α1A及β1、β2肾上腺素受体表达的改变
蒋志丽 李艳芳* 曹芳芳 刘 飞 白雪源 吕 杨
(1.首都医科大学附属北京安贞医院心内科,北京100029;2.中国医学科学院北京协和医学院阜外心血管病医院心外科,北京100037;3.解放军总医院肾科,北京100853)
α1-AR和β-AR在调节肺脏血流、支气管平滑肌的舒缩及肺泡液体清除等方面有着重要作用[1-2],但有关肾上腺素能受体各亚型在心力衰竭肺脏表达水平变化的报道较少,为此,我们采用心肌梗死后心力衰竭大鼠肺脏进行了研究。
1 材料与方法
1.1 实验动物
清洁级近交系Wistar大鼠,雄性,10周龄,体质量250~280 g,中国人民解放军军事医学科学院实验动物中心提供,首都医科大学附属北京安贞医院清洁级动物房饲养,实验动物许可证号:SCXK-(军)2007-004。动物房温度维持在(22±3)℃,相对湿度为(50±20)%。
1.2 实验试剂
抗 α1A-AR 和抗 β1-AR,β2-AR 抗体购自美国Santa Cruz Biotechnology公司。
1.3 心肌梗死后心力衰竭模型制作
大鼠称体质量后以1%戊巴比妥钠40 mg/kg腹腔麻醉,备皮,仰卧固定,行气管插管,连接动物呼吸机(潮气量10 mL/kg,呼吸频率80次/min,吸呼比1∶1),监测心电图。常规强力碘消毒,于胸骨左侧第4肋间开一横切口,暴露心脏,由左心耳下方2~3 mm结扎左冠状动脉前降支。结扎即刻心电监护显示肢导 R 波振幅明显升高,随后 I、II、III、avL、avF 和 V3导联ST段弓背向上抬高>0.2 mv,并呈动态演变过程,1周时复查心电图可见病理性Q波为心肌梗死模型制作成功,心肌梗死4周后做超声心动图检测示左室射血分数(left ventricular ejection fraction,LVEF)≤45%为心力衰竭模型成功标志[3]。
1.4 超声心动图检测心功能
检测前以1%戊巴比妥钠30 mg/kg腹腔麻醉大鼠,胸部备皮,仰卧固定。探头置于胸前,探头频率10 mHz,图像深度2.5cm。取胸骨旁左室长轴及短轴切面进行测量,测量参数包括左室舒张末期内径(left ventricular diastolic diameter,LVDD),左室收缩末期内径(left ventricular end systolic diameter,LVSD),左室射血分数(left ventricular ejection fraction,LVEF),每项指标均测量3个心动周期,结果取平均值。
1.5 实验分组及组织提取
35只雄性Wistar大鼠,分为正常对照组(10只)和假手术组(10只),其余15只大鼠制作心肌梗死模型,心肌梗死4周后心力衰竭模型制作成功10只,继续喂养8周后存活9只。将以上3组大鼠以1%戊巴比妥钠30 mg/kg腹腔注射麻醉,开胸取肺组织,立即置于-80℃冰箱保存待测。
1.6 Western blotting
采用 Western blotting 法检测肺组织 α1A-AR、β1-AR、β2-AR的蛋白表达水平。1)组织裂解:提取肺组织质组织总蛋白,采用考马斯亮蓝法测定蛋白浓度。2)SDS聚丙烯酰胺凝胶的灌制:5%积层胶+10%分离胶。3)SDS聚丙烯酰胺凝胶电泳:用微量加样器吸取蛋白质样品,按预定的顺序加入加样孔,上样量约每孔100 μg(β-actin为内参照);以100v进行恒压电泳2 h,直到溴芬蓝到达分离胶底部。4)转膜:采用硝酸纤维素膜,石墨电极半干转,以恒流1 mA/cm2凝胶电泳转移1 h;用丽春红染液对硝酸纤维素膜上的蛋白质条带进行染色。5)免疫印迹显色:将结合蛋白的硝酸纤维素膜放入塑料袋加入封闭液置于4℃冰箱过夜;根据抗体说明书加入一抗,各受体亚型一抗的稀释浓度分别为 α1A-AR:1 ∶200;β1-AR:1 ∶200;β2-AR:1∶100;室温2 h,TBST 洗膜;按1 ∶2 000 加入辣根过氧化物酶偶联二抗,置于37℃摇床温育45 min,TBST洗膜;于硝酸纤维素膜上滴加DAB液,胶片显影。用扫描仪对胶片进行扫描成像。应用吸光度分析测定蛋白的表达水平。
1.7 统计学方法
用Quantity one软件对图像进行吸光度分析,以目的条带与内参照条带信号强度的比值代表组织中目的受体的表达水平。用SPSS13.0进行统计分析。计量数据以均数±标准差(±s)表示。多样本均数比较采用单因素方差分析,如样本间差异有统计学意义,采用Newman-Keuls检验法进行两两比较,以P<0.05为差异有统计学意义。
2 实验结果
2.1 α1A-AR蛋白表达水平的改变
α1A-AR蛋白在A组、B组和C组的表达水平分别为0.52±0.11,0.49±0.08,0.36±0.06,C 组与 B 组相比出现显著下调(P<0.05),A组与B组相比差异无统计学意义(P>0.05)(图1,表1)。
2.2 β1-AR和β2-AR蛋白表达水平的改变
β1-AR蛋白在A组、B组和C组的表达水平分别为0.34±0.06,0.35±0.07,0.27±0.04,C 组与 B 组相比出现显著下调(P<0.05),A组与B组相比差异无统计学意义(P>0.05)(图1,表1)。
β2-AR蛋白在A组、B组和C组的表达水平分别为0.30±0.06,0.31±0.05,0.46±0.08,C 组与 B 组相比出现显著上调(P<0.01),A组与B组相比差异无统计学意义(P>0.05)。(图1,表1)。
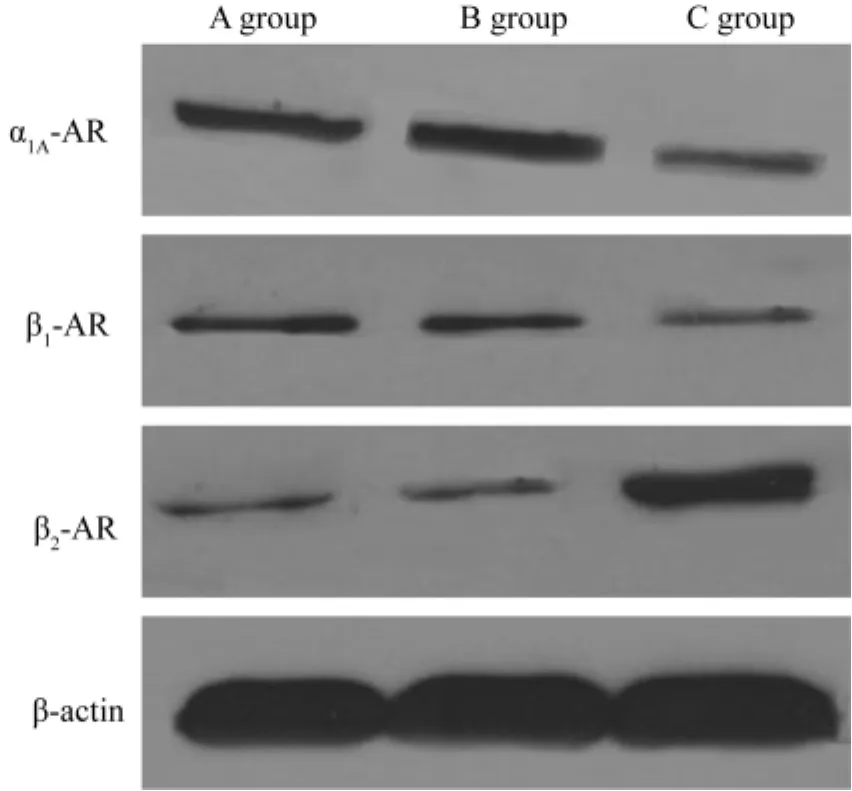
图1 各组α1A-AR,β1-AR,β2-AR在肺脏中的蛋白表达水平Fig.1 Expression of α1A-AR,β1-AR and β2-AR subtypes protein levels in the lung of each group
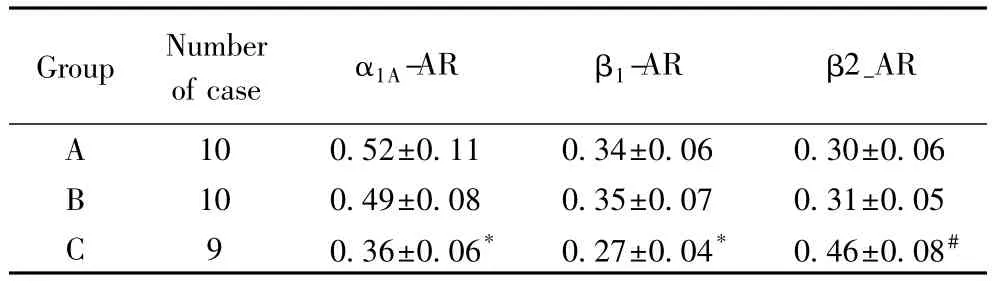
表1 各组大鼠肺脏α1A-AR和β-AR,β2-AR各亚型的蛋白表达水平Tab.1 Expression of α1A-AR,β1-AR and β2-AR subtypes protein levels in the lung of each group
3 讨论
肾上腺素受体分为 α-AR和 β-AR 2种类型,α-AR 分为 α1-AR 和 α2-AR 2 大类,α1-AR 又分为 α1AAR、α1B-AR、α1D-AR 3 种亚型,β-AR 分为 β1-AR、β2-AR、β3-AR 3 种亚型。肺脏组织中 α1A-AR、α1B-AR、α1D-AR 3 种亚型均有表达,但以 α1A-AR 的表达为主[2,4]。α1A-AR 参与肺脏血管收缩,并与 β2-AR 共同调节肺脏通气/血流比值。但也有研究[5]认为,α1BAR和 α1D-AR在肺脏动脉收缩中起着一定作用。α1B-AR、α1D-AR 和 α2-AR 还参与肺脏静脉收缩的调节[6]。大鼠肺脏组织中 β1-AR、β2-AR、β3-AR 3 种亚型均有表达[7],但 β2-AR 在其中占主导地位,是调节肺脏生理功能的主要受体亚型。β1-AR、β2-AR 不仅分布于肺脏呼吸道上皮细胞、平滑肌细胞上,而且在肺血管平滑肌上也有表达,β1-AR、β2-AR 的表达随着支气管管径逐渐变细而表达数量逐渐增多,β2-AR所占的比例也逐渐增大。肺泡上皮中表达的β-AR几乎全部是 β2-AR[8-9]。激动肺脏 β2-AR 会导致支气管平滑肌舒张、肺泡液体清除率增加、肺组织钠离子通道的开放等[8]。在肺泡性低氧血症、氧化应激损伤等情况下,α-AR和β-AR表达水平发生变化,以适应病理状态下的肺脏功能。
本实验结果表明,与假手术组相比,慢性心力衰竭大鼠肺脏 α1A-AR、β1-AR 表达水平显著下调,而 β2-AR显著上调。这与慢性心力衰竭大鼠心脏α1-AR和β-AR 表达水平改变不同。多数研究[10-13]显示慢性心力衰竭心脏 β1-AR 下调,α1A-AR 上调[9-12]。而目前有关β2-AR在心力衰竭时的变化则众说纷纭,Mwtlu等[14]认为,慢性心力衰竭时心脏 β2-AR 表达不变,但Du等[12]认为,心力衰竭心脏 β2-AR 下调。有关心力衰竭肺脏肾上腺素受体表达的变化迄今为止尚未见报道,本研究发现,慢性心力衰竭肺脏 β1-AR、α1A-AR均下调,β2-AR上调,在国内外尚属首例。肺脏与心脏表达水平不一致的原因可能与分布于不同器官的肾上腺素受体介导不同的生理功能有关。分布在心脏的 β1-AR、β2-AR 激动后产生心肌的正性变时、变力作用。心力衰竭时,交感-肾上腺素系统被激活,导致心脏的 β1-AR和 β2-AR被蛋白激酶 A和 β-AR激酶磷酸化而脱敏或由于受体mRNA表达水平减少而下调[10,15-17],进而受体对激动剂的反应性减弱,兴奋-收缩脱耦联,出现心肌收缩力下降。激动心脏的α1AAR可介导心脏的正性变力效应[11],慢性心力衰竭时心脏的α1A-AR代偿性上调,力图发挥增强心肌收缩力、抑制细胞凋亡,防止心肌重塑的作用[12]。与心脏α-AR和β-AR表达水平的改变有所不同,在肺脏发挥生理功能的受体主要是 α1-AR和 β2-AR。生理情况下,肺循环系统的β2-AR作用占优势,有利于肺血管舒张和抑制平滑肌增生[9];CHF肺循环淤血,肺静脉压升高,肺毛细血管扩张,左心衰初期的肺静脉压升高会被肺毛细血管网缓冲,不会即刻引起肺动脉高压。只有左心功能不全加重,导致长时间的肺静脉高压,超过肺毛细血管网的缓冲能力,才会影响肺动脉压力,出现肺动脉高压和右心功能不全。本研究中,和假手术组相比,心衰模型组α1A-AR表达明显下调,究其原因,一方面因为本实验模型为心肌梗死后心力衰竭大鼠模型,主要累及左心功能,尚未发展到右心功能不全,另一方面α1A-AR下调可能是机体的一种代偿反应,α1A-AR的下调能舒张肺小动脉、抑制血管平滑肌的增生,从而延缓肺小动脉收缩导致肺动脉高压的进程,对右心功能起到保护作用。心力衰竭时,肺脏β2-AR表达上调一方面可以进一步发挥舒张血管和支气管平滑肌作用,而且激动β2-AR能够通过开放钠离子通道等机制促进肺水肿液的清除、并能改善心力衰竭条件下肺脏微血管的通透性[13]。心力衰竭时肺脏β1-AR的下调一方面与慢性心力衰竭时交感肾上腺素系统激活产生的负反馈调节有关,另一面也与代偿性拮抗β2-AR的上调,维持相对稳定的肺泡液体清除率有关。
综上所述,心力衰竭时肺脏肾上腺素受体的变化是为了适应肺脏病理变化的需求,因此,对于心力衰竭时保护肺脏的治疗应以局部激动β2-AR及阻滞α1A-AR为主,这与调节心力衰竭时心脏肾上腺素受体表达水平变化的治疗方案不同。
[1]Nováková M,Myslivecek J.Identification of all α1-adrenoceptor subtypes in rat lung[J].Gen Physiol Biophys,2005,24(3):349-353.
[2]Michelotti G A,Price D T,Schwinn D A. α1-Adrenergic receptor regulation:basic science and clinical implications[J].Pharmacol Ther,2000,88(3):281-309.
[3]吴振军.心力衰竭大鼠心肌细胞凋亡与肺血管结构改变及药物干预的研究[M].北京:中国协和医科大学出版社,2004:48-50.
[4]吴虹,孙银香.α1-肾上腺素受体亚型的分布及特点[J].中国医院药学杂志,2007,27(12):1728-1730.
[5]OriowoM A,ChandrasekharB,KadavilE A. α1-adrenoceptor subtypes mediating noradrenaline-induced contraction of pulmonary artery from pulmonary hypertensive rats[J].Eur J Pharmacol,2003,482(1-3):255-263.
[6]Görnemann T,Villalón CM,Centurión D,et al.Phenylephrine contracts porcine pulmonary veins viaα1B-,α1D-,and α2-adrenoceptors[J].Eur J Pharmacol,2009,613(1-3):86-92.
[7]Mak J C,Nishikawa M,Haddad E B,et al.Localisation and expression of β-adrenoceptor subtype mRNAs in human lung[J].Eur J Pharmacol,1996,302(1-3):215-221.
[8]Abraham G,Kottke C,Dhein S,et al.Pharmacological and biochemical characterization of the beta-adrenergic signal transduction pathway in different segments of the respiratory tract[J].Biochem Pharmacol,2003,66(6):1067-1081.
[9]Abraham G,Shibeshi W,Ungemach FR.Identification and characterization of β-adrenergic receptors in isolated primary equine tracheal epithelial cells[J].Pulm Pharmacol Ther,2011,24(1):174-181.
[10]王庆祥,陈国忠.β3受体与心力衰竭相关机制的研究进展[J].医学综述,2008,14(18):2730-2732.
[11]Jensen B C,O'Connell T D,Simpson P C.Alpha-1-adrenergic receptors:targets for agonist drugs to treat heart failure[J].J Mol Cell Cardiol,2011,51(4):518-528.
[12]Du X J,Gao X M,Kiriazis H,et al.Transgenic alpha1A-adrenergic activation limits post-infarct ventricular remodeling and dysfunction and improves survival[J].Cardiovasc Res,2006,71(4):735-743.
[13]Bernstein D,Jardo G,Zhao M.The role of β-adrenergic receptors in heart failure:differential regulation of cardiotoxicity and cardioprotection[J]. Prog Pediat Cardiol,2011,31(1):35-38.
[14]Mutlu G M,Factor P.Alveolar epithelial β2-adrenergic receptors[J].Am J Respir Cell Mol Biol,2008,38:127-134.
[15]Matkovich S J,Diwan A,Klanke J L,et al.Cardiacspecific ablation of G-protein receptor kinase 2 redefines its roles in heart development andβ-adrenergic signaling[J].Circ Res,2006,99(9):996-1003.
[16]李雷,高竞生.中国慢性心力衰竭的治疗现况[J].中国煤炭工业医学杂志,2011,14(7):1081-1084.
[17]慢性肺源性心脏病心力衰竭40例诊治分析[J].中国煤炭工业医学杂志,2010,13(2):238-239.

