N-羧甲基新烟碱的合成
王涛涛,李丹丹,薛 兵,康静静,刘崇波,温辉梁
(1. 南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2. 南昌航空大学 环境与化学工程学院,江西 南昌 330063)
含氮杂环化合物由于其独特的作用机制及其高活性、高选择性、高环境相容性等特点,一直是新农药、医药发展的主流[1-3]。新烟碱是一种典型的含氮杂环化合物,主要存在于烟草植物和深海生物体内,因其具有广泛的生物活性和药用价值而备受重视[4-6],已有许多品种作为除草剂、杀虫剂、植物生长调节剂、药物及医药中间体等得到成功的开发和应用[7-10]。结构不同的新烟碱化合物具有不同的生物活性,开发新结构类型的新烟碱化合物己成为研究热点[11-13]。N-羧甲基新烟碱是一种新型化合物,国内外尚未有该化合物的相关报道。Rouchaud等[14]以吡啶为原料在LiAlH4作用下反应得到了新烟碱,该方法不但反应时间长、反应机理复杂、副产物多,而且收率较低。目前较为简便地合成新烟碱的方法是以3-氨甲基吡啶和二苯甲酮亚胺为原料的路线[15],但该方法没有报道目标产物的收率。Deo等[16]曾以3-氨甲基吡啶为原料,以苯为溶剂,合成了新烟碱,但该方法毒性大且收率较低。
本工作以3-氨甲基吡啶和二苯甲酮为主要原料、甲苯为反应介质和分水剂、对甲苯磺酸为催化剂,先合成了中间体3-(二苯甲酮缩亚胺基甲基)-吡啶(化合物Ⅰ),再合成新烟碱(化合物Ⅱ),最后以化合物Ⅱ为原料合成了N-羧甲基新烟碱,并对所合成的化合物进行了结构表征。
1 实验部分
1.1 主要试剂与仪器
3-氨甲基吡啶、二苯甲酮、溴乙酸乙酯:AR,阿拉丁试剂上海有限公司;顺式-1,4-二氯-2-丁烯、甲苯、碳酸钾、对甲苯磺酸、盐酸、甲醇、氢氧化钾、碘化钾、二氯甲烷、三氯甲烷、乙酸乙酯、石油醚、四氢呋喃、无水乙醇、环己烷:AR,国药集团化学试剂有限公司;二异丙基氨基锂(LDA):2.0 mol/L的LDA四氢呋喃溶液,阿拉丁试剂上海有限公司。
FTS-40型傅里叶变换红外光谱仪:BIO-RAD公司;Bruker 400 Ultrashield型核磁共振仪:Bruker公司;Agilent 6410型三重串联四级杆-飞行时间串联质谱仪:Agilent公司;旋转蒸发仪:巩义市英峪子华仪器厂。
1.2 合成路线
以3-氨甲基吡啶和二苯甲酮为原料、甲苯为溶剂、对甲苯磺酸为催化剂,合成N-羧甲基新烟碱的路线见图1。
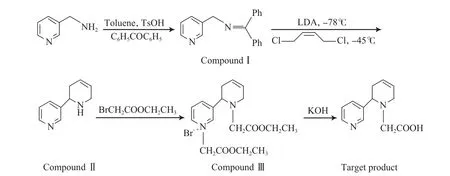
图1 N-羧甲基新烟碱的合成路线Fig.1 Synthetic route of N-carboxymethyl-anatabine.
1.2.1 化合物Ⅰ的合成
取0.54 g 3-氨甲基吡啶溶解在5 mL甲苯中,搅拌下加入1.36 g二苯甲酮使其完全溶解,再滴入0.1 g对甲苯磺酸,回流分水。4 h时原料反应完全(薄层色谱(TLC)法跟踪检测),用旋转蒸发仪旋干溶剂,得到1.45 g粗品,用中性氧化铝柱层析(流动相为V(乙酸乙酯)∶V(石油醚)=1∶5)纯化粗品,得到1.08 g白色针状晶体,即化合物Ⅰ,收率为78.5%,熔点为 267~270 ℃。MS分析结果为:m/z=273.16[M+H]+。
1.2.2 化合物Ⅱ的合成
在氩气保护下,将0.54 g化合物Ⅰ溶解在5 mL干燥的四氢呋喃中,将体系冷却到-78 ℃;在此温度下滴加1.2 mL的LDA,反应0.5 h后,反应体系自然升温至-45 ℃;再滴加0.38 g顺式-1,4-二氯-2-丁烯,然后反应体系自然升至室温;在室温下搅拌反应,3 h后原料反应完全(TLC法跟踪检测),用20 mL 10%(w)的盐酸淬灭反应,乙醚萃取除去杂质,用40%(w)的氢氧化钾溶液调节水相pH=12,再用三氯甲烷萃取3次(每次用量5 mL),合并有机相,旋干溶剂,得到0.40 g棕红色黏稠状粗品,用硅胶柱层析(流动相为V(甲醇)∶V(二氯甲烷)=1∶8)纯化粗品,得到0.26 g棕黄色油状液体化合物Ⅱ,收率为81.5%。
MS分析结果为:m/z=161.41[M+H]+。1H NMR表征结果(400 MHz,CDCl3,化学位移(δ))为:8.57(d,1H,J=2.1 Hz,ArH),8.47(dd,1H,J=3.6,3.9 Hz,ArH),7.67(dt,1H,J=1.6,7.8 Hz,ArH),7.24(ddd,1H,J=4.6,5.1,8.7 Hz,ArH),5.88(m,2H,—CHCH—),3.96(t,1H,J=5.2 Hz,NCHAr),3.47(bd, 1H,J=5.0 Hz, NCH2),3.42(bd,1H,J=1.0 Hz,NCH2),2.12(m,2H,—CHCH2CH),1.99(s,1H,NH)。IR表征结果(NaCl,波数)为:3 281,3 033,2 921,2 831,1 658,1 578,1 425,1 311,1 102,809 cm-1。
1.2.3 N-羧甲基新烟碱的合成
取0.160 g化合物Ⅱ,用5 mL乙腈溶解,然后加入0.10 g碳酸钾和0.10 g碘化钾,再逐滴加入0.25 g溴乙酸乙酯,回流搅拌反应,5 h时原料反应完全(TLC法跟踪检测),旋干溶剂,水洗,二氯甲烷萃取,合并有机相并旋干。采用梯度洗脱法硅胶柱层析纯化粗品,得0.250 g中间产物,收率为75.1%。MS表征结果为:m/z=334.19[M+H]+。
取0.167 g中间产物用无水乙醇和四氢呋喃各2 mL溶解,然后在室温下加入2 mol/L乙醇氢氧化钾溶液2 mL,回流搅拌反应,1 h时原料反应完全(TLC法跟踪检测),旋干溶剂,水洗残渣,乙醚萃取杂质,弃去有机相。用10%(w)的盐酸调水相pH=5.0,然后用二氯甲烷萃取,有机相合并,旋干溶剂,得到黑红色固体,用梯度洗脱法硅胶柱层析纯化固体,得到0.075 g棕红色晶体即N-羧甲基新烟碱,收率为68.5%。
MS表征结果为:m/z=219.11[M+H]+。1H NMR表征结果(400 MHz,氘代二甲基亚砜,δ)为:13.25(s,1 H,COOH),8.66(d,1 H,J=4.6 Hz,ArH),8.41(dd,1 H,J=4.7,6.9 Hz,ArH),7.75(ddd,1 H,J=3.0,4.1,8.3 Hz,ArH),7.20(dt,1H,J=1.9,6.8 Hz,ArH),5.68(m,2H,—CHCH—),3.94(t,1H,J=3.7 Hz,NCHAr),3.59(m,2H,NCH2COOH),3.47(bd,1H,J=7.2 Hz,NCH2,3.42(bd,1H,J=5.3 Hz,NCH2),2.23~2.35(m,2H,—CHCH2CH)。
2 结果与讨论
2.1 化合物Ⅰ的合成
化合物Ⅰ的制备是合成N-羧甲基新烟碱中很重要的一步,目前仅有Deo等[16]曾以苯为溶剂合成了化合物Ⅰ,但没有收率报道,因此本实验考察了反应条件对化合物Ⅰ收率的影响。实验过程中考虑到3-氨甲基吡啶与二苯甲酮反应会生成水,而水对实验影响很大,所以在反应体系中接入了分水器。
2.1.1 溶剂对化合物Ⅰ收率的影响
分别以环己烷、无水乙醇、苯和甲苯为溶剂,考察溶剂种类对化合物Ⅰ收率的影响,实验结果见表1。由表1可见,以甲苯为溶剂时,化合物Ⅰ的收率最高。因此,选择以甲苯为溶剂较适宜。

表1 溶剂种类对化合物Ⅰ收率的影响Table 1 Effect of solvent types on the yield of compoundⅠ
2.1.2 反应温度对化合物Ⅰ收率的影响
反应温度对化合物Ⅰ收率的影响见表2。由表2可见,当反应温度为110.6 ℃时,化合物Ⅰ的收率最高。因此,选择反应温度为110.6 ℃(甲苯的沸点)较适宜。

表2 反应温度对化合物Ⅰ收率的影响Table 2 Effect of reaction temperature on the yield of compoundⅠ
2.1.3 反应时间对化合物Ⅰ收率的影响
反应时间对化合物Ⅰ收率的影响见表3。由表3可见,当反应时间为4.0 h时,化合物Ⅰ的收率最高(78.5%)。因此,选择反应时间为4.0 h较适宜。
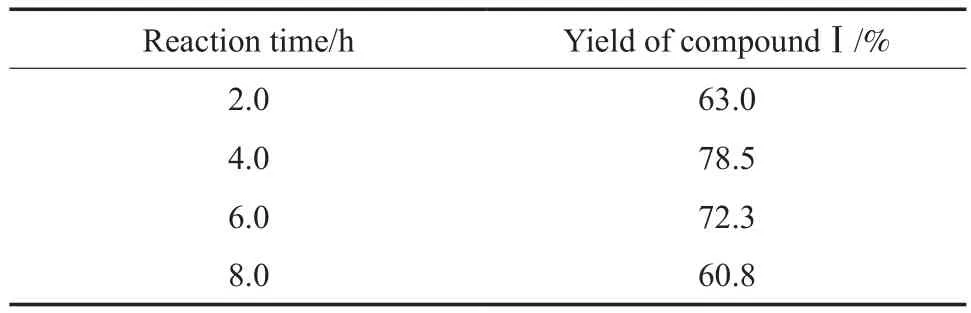
表3 反应时间对化合物Ⅰ收率的影响Table 3 Effect of reaction time on the yield of compoundⅠ
2.2 化合物Ⅱ的合成
化合物Ⅱ的合成条件相对较苛刻,需在-78 ℃下进行反应,实验过程中采用液氮和石油醚的混合体系以达到低温要求。经实验发现,在n(化合物Ⅰ)∶n(LDA)∶n(顺式-1,4-二氯-2-丁烯)=1∶1.2∶1.5、反应时间3.0 h的条件下,原料反应完全,化合物Ⅱ的收率为81.5%。
2.3 目标产物的合成
考察了溴乙酸乙酯用量对中间产物结构的影响,当溴乙酸乙酯用量是化合物Ⅱ的1.2倍当量时,中间产物中并存有如下两种化合物:溴化(N,N′-二乙氧羧基新烟碱)盐(化合物Ⅲ)和N-乙氧基羧甲基新烟碱(化合物Ⅳ)。
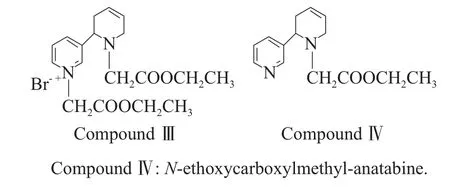
随溴乙酸乙酯用量的增加,化合物Ⅲ的含量逐渐增加,当溴乙酸乙酯用量是化合物Ⅱ的2.1倍当量时,中间产物以化合物Ⅲ的形式存在。经实验发现,当溴乙酸乙酯用量少于化合物Ⅱ的2.0倍当量时,化合物Ⅱ并不能完全参加反应,且体系中化合物Ⅲ与化合物Ⅳ并存,为使化合物Ⅱ全部参与反应,因此选择中间产物以化合物Ⅲ的形式存在。
N-羧甲基新烟碱的合成是较简便的一步,实验过程中以氢氧化钾、体积比为1∶1的乙醇四氢呋喃溶液为溶剂,得到了很好的解酯效果。经实验得知,N-羧甲基新烟碱的收率为68.5%。
3 结论
1)以3-氨甲基吡啶和二苯甲酮为主要原料,以甲苯为反应介质和分水剂,以对甲苯磺酸为催化剂,经过3步反应合成了N-羧甲基新烟碱。
2)化合物Ⅰ合成的适宜条件为:以甲苯为溶剂,在110.6 ℃下回流反应4.0 h。在此条件下,化合物Ⅰ的收率最高可达78.5%。以化合物Ⅰ为原料合成了化合物Ⅱ,当n(化合物Ⅰ)∶n(LDA)∶n(顺式-1,4-二氯-2-丁烯)=1∶1.2∶1.5、反应时间3.0 h时,化合物Ⅱ的收率最高可达81.5%。以化合物Ⅱ为母体,合成了N-羧甲基新烟碱(收率为68.5%),其中溴乙酸乙酯用量对中间产物的结构有影响。
[1] 杨吉春,李淼,柴宝山,等. 新烟碱类杀虫剂最新研究进展[J]. 农药,2007,46(7):433 - 438.
[2] Kem W,Soti F,Wildeboer K,et al. The Nemertine Toxin Anabaseine and Its Derivative DMXBA(GTS-21):Chemical and Pharmacological Properties[J]. MarDrugs,2006,4(3):255 - 273.
[3] 陈倩文,靳海波,杨索和,等. 碱性条件下一异丙基萘氧化合成过氧化物[J]. 石油化工,2012,41(3):283 - 287.
[4] 唐振华. 新烟碱类杀虫剂的结构与活性及其药效基团[J]. 现代农药,2002,1(1):1 - 6.
[5] Wen Huiliang,Wang Taotao,Liu Chongbo,et al. Hydrothermal Syntheses and Structures of Transition Metal 2-(4,5-Diphenyl-1H-Imidazol-2-yl)Benzoic Acid Complexes[J]. J Coord Chem,2012,65(5):856 - 864.
[6] 马新宾,黄守莹,王胜平,等. 氧化羰基化法合成有机碳酸酯的研究进展[J]. 石油化工,2010,39(7):697 - 705.
[7] 贾俊超,苑建勋,范志金. 新烟碱类杀虫剂选择作用的分子机理[J]. 农药,2007,46(4):227 - 230.
[8] 赵海龙,赵新强,安华良,等. 氧化铅催化氨基甲酸乙酯与乙醇合成碳酸二乙酯[J]. 石油化工,2009,38(2):139 -144.
[9] Uchida S,Maeda S,Kisak T. Conversion of Nicotine into Nornicotine and N-Methylmyosmine by Fungi[J]. Agric Biol Chem,1983,47(9):1949 -1953.
[10] 张富民,梁金花,王军,等. 硅胶负载磷钨酸催化正丁醇和乙酸液相酯化反应[J]. 石油化工,2004,33(6):522 -526.
[11] Sindelar R D,Rosazza J P,Barfknecht C F. N-Demethylation of Nicotine and Reduction of Nicotine-1′-N-Oxide by Microsporum Gypseum[J]. Appl Environ Microbiol,1979,38(5):836 - 839.
[12] Felpin F X,Girard S,Vothanh G,et al. Efficient Enantiomeric Synthesis of Pyrrolidine and Piperidine Alkaloids from Tobacco[J]. J Org Chem,2001,66(19):6305 - 6312.
[13] Ayers J T,Xu R,Dwoskin L,et al. A General Procedure for the Enantioselective Synthesis of the Minor Tobacco Alkaloids Nornicotine,Anabasine,and Anatabine[J]. AAPS J,2005,7(3):E752 - E758.
[14] Rouchaud A,Kem W R. A Convenient Racemic Synthesis of Two Isomeric Tetrahydropyridyl Alkaloids:Isoanatabine and Anatabine[J]. J Heterocycl Chem,2010,47(3):569 -581.
[15] Willams J R,Wright C P. Nutraceutical Product Containing Anatabine and Yerba Mate:WO,2012005885[P]. 2012-02-12.
[16] Deo N M,Crooks P A. Regioselective Alkylation of N-(Diphenylmethylidine)-3-(Aminomethyl)Pyridine:A Simple Route to Minor Tobacco Alkaloids and Related Compounds[J].Tetrahedron Lett,1996,37(8):1137 - 1140.

