全反式维甲酸预处理对肝血流阻断大鼠肠道的保护作用*
王钟兴, 黄婵燕, 方佳峰, 陈图锋△
(1中山大学附属第一医院麻醉科,广东 广州 510080; 2中山大学附属第三医院胃肠外科,广东 广州 510630)
全反式维甲酸预处理对肝血流阻断大鼠肠道的保护作用*
王钟兴1, 黄婵燕1, 方佳峰2, 陈图锋2△
(1中山大学附属第一医院麻醉科,广东 广州 510080;2中山大学附属第三医院胃肠外科,广东 广州 510630)
目的探讨全反式维甲酸(ATRA)对肝血流阻断所致肠道损伤的影响和机制。方法32只雄性SD大鼠,随机分为4组:假手术(sham)组、肝血流阻断(HIO)组、溶媒对照(DMSO+HIO)组和ATRA预处理(ATRA+HIO)组。ATRA预处理组以ATRA 15 mg·kg-1·d-1灌胃, 溶媒对照组以等体积二甲基亚砜(DMSO)灌胃,共10 d。Pringle’s法建立肝血流阻断模型,持续30 min,解除阻断再灌注2 h后,采集各组大鼠末端回肠和血清。光镜下观察回肠病理改变、行肠黏膜组织Chiu氏评分;比色法检测血清二胺氧化酶(DAO)水平、回肠组织丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性;ELISA法测定血清白细胞介素(IL)-1β及肿瘤坏死因子(TNF)-α水平;Western blotting检测组织中胞浆锰超氧化物歧化酶(MnSOD)和胞核NF-κB p65蛋白的表达量。结果相对于HIO组和DMSO+HIO组,ATRA能缓解肝血流阻断后肠黏膜组织病理损伤,降低Chiu氏评分和血清DAO水平(P<0.05),减少回肠组织中MDA含量(P<0.05),提高SOD活性(P<0.05),增加组织MnSOD的表达(P<0.05),减少胞核NF-κB p65蛋白含量(P<0.05),降低血清IL-1β和TNF-α水平(P<0.05)。结论ATRA通过增加组织抗氧化能力,抑制NF-κB通路的激活,减少促炎因子的产生,从而减轻大鼠肝血流阻断造成的肠道损伤。
全反式维甲酸; 肝血流阻断; 再灌注损伤; 肠
阻断入肝血流是肝胆外科手术控制术中出血的常用方法。由于门脉循环的特殊性,肝血流阻断可造成门脉系统回流障碍,小肠血管血流严重瘀滞,组织缺血缺氧,导致肠黏膜屏障受损。因此肠道是肝血流阻断产生血流动力学障碍和缺血再灌注损伤的重要靶器官[1]。全反式维甲酸(all-transretinoic acid, ATRA)在临床中被广泛应用于血液系统肿瘤和皮肤疾病的治疗,近年的研究表明,ATRA还具有抗氧化及抑制炎症反应的作用[2-5]。然而,目前对ATRA在器官缺血再灌注损伤中的作用却研究甚少。本实验通过建立大鼠肝门阻断模型,观察ATRA在肝血流阻断后对肠道损伤的影响并探讨其可能的机制。
材 料 和 方 法
1材料
健康雄性SD大鼠,体重220~270 g(广州中医药大学动物实验中心);ATRA, 二甲基亚砜(dimethyl sulfoxide, DMSO)购自Sigma-Aldrich;兔抗锰超氧化物歧化酶(manganese superoxide dismutase, MnSOD)多克隆抗体购自Abcam;兔抗核转录因子κB(nuclear factor kappa B, NF-κB)p65单克隆抗体、兔抗histone H3单克隆抗体、兔抗β-Actin单克隆抗体和山羊抗兔IgG-HRP 购自Cell signaling technology;丙二醛(malonaldehyde, MDA)测试盒、超氧化物歧化酶(superoxide dismutase, SOD)测试盒和二胺氧化酶(diamine oxidase, DAO)测试盒均购自南京建成生物研究所;肿瘤坏死因子(tumor necrosis factor, TNF)-α ELISA检测试剂盒和白细胞介素(interleukin, IL)-1β ELISA检测试剂盒购自武汉博士德生物工程有限公司。
2方法
2.1实验分组 健康雄性SD大鼠32只,随机分为4组,每组8只:(1)假手术(sham)组:麻醉后开腹,分离肝门,余不作进一步处理;(2)肝血流阻断(hepatic inflow occlusion, HIO)组:钳夹肝十二指肠韧带,肝门阻断30 min;(3)溶媒对照(DMSO+HIO)组:每天以等体积溶媒DMSO灌胃,共10 d,术前6 h再给DMSO处理1次,余操作同HIO组;(4)ATRA预处理(ATRA+HIO)组:以ATRA 15 mg·kg-1·d-1灌胃,持续10 d,术前6 h再给ATRA处理1次,余操作同HIO组。
2.2动物模型建立及标本收集 动物实验前12 h禁食,自由饮水,采用戊巴比妥钠(45 mg/kg)腹腔内注射麻醉,取上腹部正中切口进入腹腔,暴露肝门部,用无创血管钳按Pringle’s法阻断肝十二指肠韧带并持续30 min[6],松钳恢复血流。再灌注2 h后处死大鼠,采集动脉血6 mL,室温静置40 min,4 ℃、1 000×g离心10 min,收集血清,-20 ℃保存待测。距离回盲部5cm切取约8cm末端回肠,分成2段,一段置入10%中性甲醛固定,用作病理检测;另一段以4 ℃生理盐水冲洗干净,随即在液氮中急冻并将其研磨成粉末,-70 ℃保存待测。
2.3组织病理学检测 固定的回肠组织块经乙醇梯度脱水后,石蜡包埋,常规切片及HE染色,光镜下观察;遵照单盲法,由2位病理科医生对各标本的肠黏膜进行Chiu氏评分[7],分值越高,表明损伤越严重。
2.4回肠组织MDA含量和SOD活性检测 将储存的回肠组织粉末以0.02 mol/L Tris-HCL (pH=7.3)匀浆后,16 000×g离心20 min,取上清液。MDA含量采用硫代巴比妥酸比色法测定;SOD活性采用黄嘌呤氧化酶法测定。具体操作参照各试剂盒说明书进行。
2.5血清DAO、IL-1β和TNF-α水平的测定 将冻存的血清在冰上融解,4 ℃、1 000×g离心15 min, 取上清液。DAO含量采用紫外比色法测定;IL-1β、TNF-α水平采用ELISA方法测定。具体操作参照各试剂盒说明书进行。
2.6回肠组织胞浆MnSOD及胞核NF-κB p65蛋白表达的检测 取少量储存的回肠组织粉末先后加入胞浆提取剂和胞核提取剂,离心取上清,获得胞浆蛋白和胞核蛋白,采用BCA法测定蛋白含量。取等蛋白量的各样品行聚丙烯酰胺胶电泳,将分离胶蛋白转印至醋酸纤维素膜上。冲洗膜、封闭、与Ⅰ抗孵育2 h。冲洗膜、与Ⅱ抗孵育1 h。冲洗膜,加入化学发光试剂显影,最后将膜曝光成像。
3统计学处理
计量资料以均数±标准差(mean±SD)表示,等级资料以中位数(下四分位数,上四分位数)[median (Q1,Q3)]表示,使用SigmaPlot 12.3 软件进行统计分析;连续性资料的比较采用单因素方差分析(One-way ANOVA),方差不齐采用Kruskal-Wallis非参数检验;等级资料的比较采用秩和检验;各组间的多重比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1回肠组织病理学改变及Chiu氏评分
光镜下,sham组黏膜形态正常,HIO组和DMSO+HIO组黏膜结构破坏明显,ATRA+HIO组黏膜轻、中度损伤,见图1。HIO和DMSO+HIO两组的Chiu氏评分均显著高于sham组(P<0.05),ATRA+HIO组评分较HIO组和DMSO+HIO组明显降低(P<0.05),但仍高于sham组,差异有统计学意义(P<0.05),见表1。
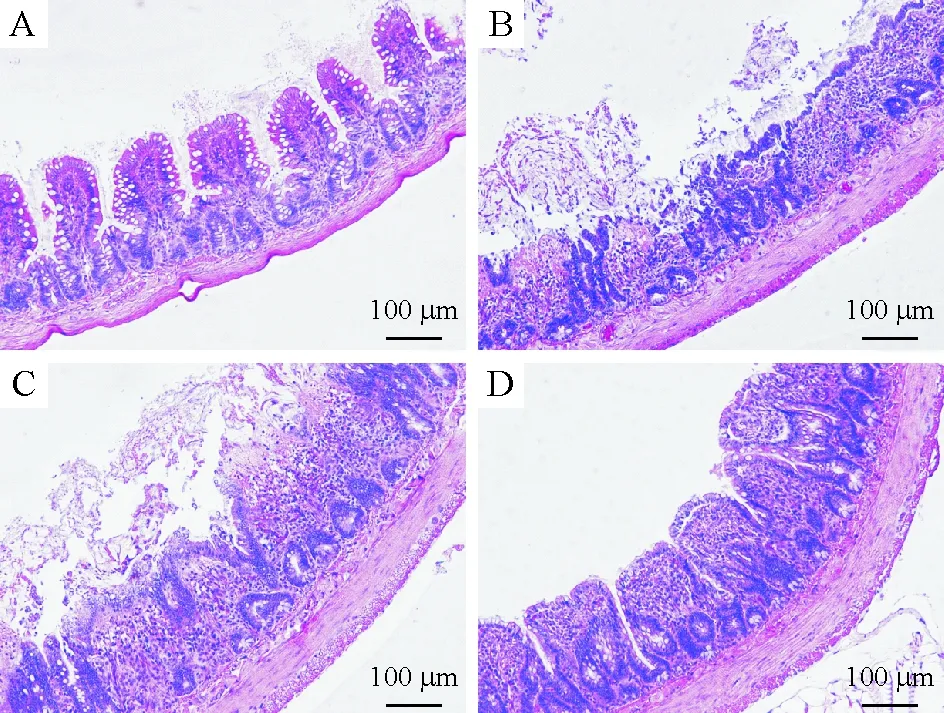
Figure 1. Histopathological changes of ileum mucosa under light microscope (×100). In sham group (A), the villi and glands were normal. In HIO group (B) and DMSO+HIO group (C), severe edema of mucosal villi accompanied with intestinal gland injury were observed, numbers of intestinal villi disintegrated, and the gap between epithelium and lamina propria obviously increased, which indicated significant damage to mucosa. In ATRA+HIO group (D), although the villi were edematous, only slight mucosal sloughing could be seen at villi tips, and the gap between epithelium and lamina propria increased mildly.
图1各组回肠黏膜病理学改变
表1各组回肠黏膜Chiu氏评分及血清DAO的变化
Table 1. The changes of Chiu’s score of mucosa and DAO content in serum [median (Q1,Q3).Mean±SD.n=8]
△P<0.05vssham group;*P<0.05vsHIO group or DMSO+HIO group.
2血清DAO水平
再灌注后,HIO组和DMSO+HIO组血清DAO水平较sham组显著升高(P<0.05);而ATRA+HIO组则较HIO组及DMSO+HIO组明显降低(P<0.05),与sham组比较,ATRA+HIO组DAO水平升高,差异有统计学意义(P<0.05),见表1。
3回肠组织MDA含量及SOD活性
再灌注后,MDA含量在HIO组和DMSO+HIO组明显高于sham组(P<0.05),ATRA+HIO组则较HIO组及DMSO+HIO组显著降低(P<0.05),但高于sham组(P<0.05);与MDA相应,SOD活性在HIO组及DMSO+HIO组均明显低于sham组和ATRA+HIO组(P<0.05),ATRA+HIO组与sham组比较,SOD活性降低,差异有统计学意义(P<0.05),见表2。
表2各组回肠组织MDA和SOD的变化
Table 2. The changes of MDA level and SOD activity in ileum tissues (Mean±SD.n=8)

GroupMDA[μmol/(gprotein)]SOD[103U/(gprotein)]Sham1.33±0.28268.90±28.56HIO4.83±1.08△150.28±34.65△DMSO+HIO4.90±1.15△146.34±33.53△ATRA+HIO2.83±0.73△*223.76±31.33△*
△P<0.05vssham group;*P<0.05vsHIO group or DMSO+HIO group.
4血清IL-1β和TNF-α水平
再灌注后,HIO组和DMSO+HIO组的血清IL-1β和TNF-α水平均较sham组明显升高(P<0.05);而ATRA+HIO组则较HIO组及DMSO+HIO组显著下降(P<0.05);ATRA+HIO组与sham组比较,其血清IL-1β和TNF-α水平高于后者,差异有统计学意义(P<0.05),见表3。
表3各组血清IL-1β及TNF-α的变化
Table 3. The changes of IL-1β and TNF-α levels in serum (ng/L.Mean±SD.n=8)

GroupIL-1βTNF-αSham32.94±4.8213.25±3.07HIO314.37±60.66△116.68±24.03△DMSO+HIO309.50±54.86△108.02±26.42△ATRA+HIO168.73±39.05△*52.97±15.60△*
△P<0.05vssham group;*P<0.05vsHIO group or DMSO+HIO group.
5回肠组织MnSOD和NF-κBp65蛋白的表达
再灌注后,胞浆MnSOD蛋白表达在HIO组和DMSO+HIO组显著低于sham组(P<0.05),ATRA+HIO组则较HIO组及DMSO+HIO组明显增加(P<0.05),ATRA+HIO组与sham组比较,差异无统计学意义(P>0.05),见图2;胞核NF-κB p65蛋白表达在HIO、DMSO+HIO及ATRA+HIO组中,均较sham组显著升高(P<0.05),但与HIO或DMSO+HIO组比较,ATRA+HIO组的核内NF-κB p65蛋白水平明显降低,差异有统计学意义(P<0.05),见图3。

Figure 2. The expression of cytoplasmic MnSOD protein in ileum tissues analyzed by Western blotting.Mean±SD.n=8.*P<0.05vssham group;#P<0.05vsHIO group or DMSO+HIO group.
图2各组回肠组织中胞浆MnSOD蛋白的表达
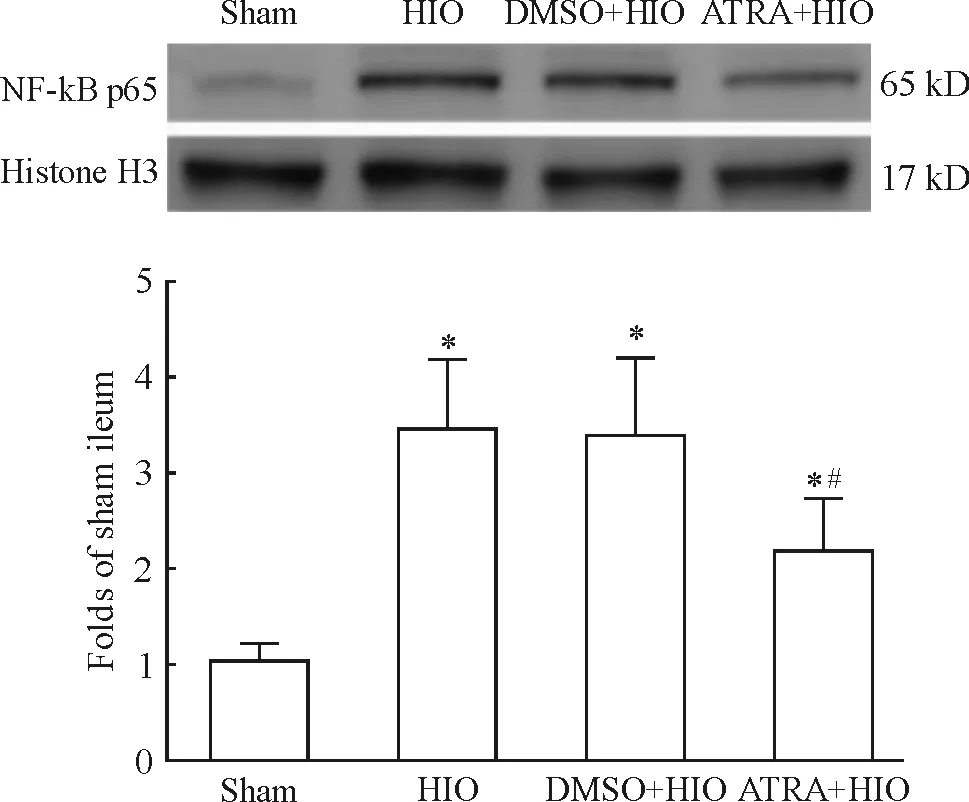
Figure 3. The expression of nuclear NF-κB p65 protein in ileum tissues analyzed by Western blotting.Mean±SD.n=8.*P<0.05vssham group;#P<0.05vsHIO group or DMSO+HIO group.
图3各组回肠组织中胞核NF-κBp65蛋白的表达
讨 论
为减少肝胆外科手术中出血,肝门阻断控制入肝血流是简单而有效的常用方法。动物实验研究表明[1,8],肝血流阻断可对多个器官的功能造成损害,肠道损伤是仅次于呼吸循环衰竭的主要并发症和致死原因。肝血流阻断后门脉压力急剧升高、血流淤滞,引起肠黏膜缺血缺氧、水肿脱落;再灌注后,氧自由基及各种促炎因子的产生又可进一步加剧肠道的损伤。DAO是具有高度活性的细胞内酶,主要由胃肠黏膜上皮细胞合成,当黏膜细胞出现损伤或坏死时,DAO即从肠道组织中释放入血液,因此血清DAO是反应肠黏膜机械屏障完整性和损伤程度的敏感指标[9]。我们的结果显示,肝血流阻断30 min、再灌注2 h后,大鼠血清DAO水平显著高于假手术组,而给予ATRA预处理,可使血清DAO水平明显降低,结合病理学改变及Chiu氏评分结果分析,我们发现长时间的肝血流阻断破坏了肠黏膜机械屏障功能,ATRA能有效缓解肝血流阻断造成的黏膜损伤。此外,在本研究中,溶媒对照组与肝血流阻断组的各实验结果均无统计学差异,表明DMSO作为ATRA的溶媒,并未对动物模型产生明显的生物学作用。
氧自由基通过脂质过氧化对细胞产生损害,是导致组织器官缺血再灌注损伤的关键环节。MDA是脂质过氧化的最终产物,其含量可以间接反映机体氧自由基的水平。本研究结果提示,肝血流阻断组的回肠MDA含量较假手术组明显增加,使用ATRA作预处理,可使组织中的MDA含量明显减少。这说明ATRA能有效降低肠道在肝门阻断再灌注后的氧自由基水平。细胞内外有多种抗氧化酶参与调节机体氧自由基水平及脂质过氧化,SOD是其中一种最重要的抗氧化酶,其活性代表了组织清除氧自由基的能力。我们在实验中测定了组织的总SOD活性,结果显示,肝血流阻断组的回肠SOD活性较假手术组明显下降,表明肠道在肝门阻断和再灌注过程中,由于SOD的大量消耗,导致了组织清除氧自由基能力的显著降低;然而,SOD活性在ATRA预处理组却显著高于肝血流阻断组,这证实了ATRA能上调肝门阻断后肠道组织的SOD活性。在真核生物中, SOD包括铜/锌超氧化物歧化酶(Cu/ZnSOD)和MnSOD,MnSOD存在于线粒体中,是机体主要的氧自由基清除剂。研究表明,增加MnSOD表达可以提高机体的抗氧化能力,对组织器官的氧化应激损伤具有保护作用[10]。ATRA是维生素A的活性代谢产物,它在细胞增殖分化、胚胎发育等方面发挥重要的生物学作用。近年的研究还发现,ATRA能够诱导MnSOD的合成而具有强烈的抗氧化作用[2-3]。本实验结果显示,肝血流阻断组的MnSOD蛋白表达水平较假手术组明显下降,而ATRA预处理组则较肝血流阻断组明显升高,说明肝门阻断再灌注使回肠组织中氧自由基清除剂MnSOD的产生明显减少,使用ATRA作预处理可以增加MnSOD的表达,提高肠道组织的抗氧化能力。ATRA促进MnSOD表达的确切机制尚未阐明,有学者提出,这与ATRA激活p38MAPK/Akt信号通路有关[11],其它的可能机制还有待进一步研究。
在缺血再灌注过程中,TNF-α、IL-1β等促炎因子诱导的过度炎症反应是造成组织损伤的另一关键因素。这些因子不仅可通过增加中性粒细胞对缺氧组织的趋化性和粘附性而加重局部损伤,而且还是全身炎症反应综合征及多器官功能不全综合征的重要启动因素。ATRA除了具有诱导分化和抗肿瘤的药理特性外,近年研究还发现,ATRA能够抑制单核巨噬细胞及树状突细胞表达多种促炎因子[12],在组织器官中具有抗炎和免疫调节的作用[4-5]。本研究结果显示,肝血流阻断可使大鼠血清TNF-α、IL-1β显著升高;经ATRA预处理,两者的水平均出现明显下降,表明ATRA在肝门阻断再灌注中可以抑制TNF-α、IL-1β的产生。目前认为,大多数促炎因子的表达都与NF-κB的激活有关[13]。正常情况下,NF-κB在细胞浆与其抑制蛋白IκB结合处于静止状态,当受到缺氧、炎症、损伤等因素的刺激时,IκB迅速发生磷酸化及降解,活化的NF-κB进入细胞核与相关的DNA序列结合,诱导众多靶基因包括TNF-α、IL-1β等多种促炎因子的表达,因此细胞核中NF-κB的水平可以反映NF-κB通路的激活程度[14]。我们采用Western blotting半定量检测胞核中NF-κB p65的水平,结果发现它在肝血流阻断组显著高于假手术组,使用ATRA作预处理可使胞核的NF-κB p65蛋白表达水平明显降低,这说明ATRA可抑制肝门阻断再灌注后NF-κB通路的激活,其机制可能与ATRA抑制IκB蛋白的磷酸化及降解有关[15]。
综上所述,ATRA可以增加肠道组织MnSOD表达、提高总SOD活性、减轻脂质过氧化,同时还可以抑制NF-κB通路的激活、减少促炎因子的产生,从而减轻大鼠肝血流阻断所造成的肠道损伤。
[1] Liu DL, Jeppsson B, Hakansson CH, et al. Multiple-system organ damage resulting from prolonged hepatic inflow interruption[J]. Arch Surg, 1996, 131(4):442-447.
[2] Kiningham KK, Cardozo ZA, Cook C, et al. All-trans-retinoic acid induces manganese superoxide dismutase in human neuroblastoma through NF-κB[J]. Free Radic Biol Med, 2008, 44(8):1610-1616.
[3] Choudhary R, Baker KM, Pan J. All-transretinoic acid prevents angiotensin II- and mechanical stretch-induced reactive oxygen species generation and cardiomyocyte apoptosis[J]. J Cell Physiol, 2008, 215(1):172-181.
[4] Ozdemir R, Yurttutan S, Sari FN, et al. All-trans-retinoic acid attenuates intestinal injury in a neonatal rat model of necrotizing enterocolitis[J]. Neonatology, 2013, 104(1):22-27.
[5] Nozaki Y, Yamagata T, Sugiyama M, et al. Anti-inflammatory effect of all-transretinoic acid in inflammatory arthritis[J]. Clin Immunol, 2006, 119(3):272-279.
[6] Filos KS, Kirkilesis I, Spiliopoulou I, et al. Bacterial translocation, endotoxaemia and apoptosis following Pringle manoeuvre in rats[J]. Injury, 2004, 35(1):35-43.
[7] Chiu CJ, McArdle AH, Brown R, et al. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal[J]. Arch Surg, 1970, 101(4):478-483.
[8] 高伟忠, 但 伶, 田泽丹, 等. 丙泊酚对肝缺血再灌注大鼠肺损伤及PI3K/Akt通路的影响[J]. 中国病理生理杂志, 2013, 29(3):488-492.
[9] 李 毅, 李坤河, 温仕宏, 等. JAK/STAT通路在大鼠肠缺血再灌注所致肠损伤中的作用[J]. 中国病理生理杂志, 2011, 27(12):2338-2344.
[10] Callio J, Oury TD, Chu CT. Manganese superoxide dismutase protects against 6-hydroxydopamine injury in mouse brains[J]. J Biol Chem, 2005, 280(18): 18536-18542.
[11] Rao J, Zhang C, Wang P, et al. All-trans retinoic acid alleviates hepatic ischemia/reperfusion injury by enhancing manganese superoxide dismutase in rats[J]. Biol Pharm Bull, 2010, 33(5):869-875.
[12] Wojtal KA, Wolfram L, Frey-Wagner I, et al. The effects of vitamin A on cells of innate immunityinvitro[J]. ToxicolInVitro, 2013, 27(5):1525-1532.
[13] 李 贤, 周长忍, 聂胜利. 核因子κB及其与其它信号通路的交互作用[J]. 中国病理生理杂志, 2010, 26(1): 181-187.
[14] Lawrence T. The nuclear factor NF-κB pathway in inflammation[J]. Cold Spring Harb Perspect Biol, 2009, 1(6):a001651.
[15] Rao J, Qian X, Wang P, et al. All-transretinoic acid preconditioning protects against liver ischemia/reperfusion injury by inhibiting the nuclear factor kappa B signaling pathway[J]. J Surg Res, 2013, 180(2):e99-e106.
Protectiveeffectofall-transretinoicacidpretreatmentagainstratintestinalinjuryinducedbyhepaticinflowocclusion
WANG Zhong-xing1, HUANG Chan-yan1, FANG Jia-feng2, CHEN Tu-feng2
(1DepartmentofAnesthesiology,theFirstAffiliatedHospitalofSunYat-senUniversity,Guangzhou510080,China;2DepartmentofGastrointestinalSurgery,theThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China.E-mail:dr_ctf@126.com)
AIM: To investigate the effect of all-trans retinoic acid (ATRA) on the intestinal injury induced by hepatic inflow occlusion (HIO) and its mechanisms.METHODSThirty-two male Sprague-Dawley rats were randomly divided into four groups: sham group, HIO group, dimethyl sulfoxide (DMSO) + HIO group and ATRA (15 mg·kg-1·d-1) + HIO group. The hepatoduodenal ligament of the rats in the latter three groups was occluded (Pringle manoeuvre) by clamp for 30 min. After reperfusion for 2 h by release of the clamp, samples of distal ileum and serum were collected. Histological changes and Chiu’s scores of the ileac mucosa were evaluated under light microscope. Serum content of diamine oxidase (DAO), and ileac tissue levels of malonaldehyde (MDA) and superoxide dismutase (SOD) were analyzed by colorimetry. Serum concentrations of interleukin (IL)-1β and tumor necrosis factor (TNF)-α were evaluated by enzyme-linked immunosorbent assay method. Expression of manganese superoxide dismutase (MnSOD) in cytoplasm and nuclear factor kappa B (NF-κB) p65 in nucleus was assessed by Western blotting.RESULTSCompared with sham group and DMSO+HIO group, ATRA significantly reduced the mucosal Chiu’s scores, the serum content of DAO and the tissue level of MDA, enhanced the serum activity of SOD and the protein expression of MnSOD, and decreased the content of NF-κB p65 in nucleus (allP<0.05). Subsequently, ATRA significantly reduced the levels of TNF-α and IL-1β in serum (P<0.05).CONCLUSIONATRA can attenuate rat intestinal injury induced by HIO through improving the antioxidant capacity of tissue, inhibiting the activation of NF-κB and suppressing the overexpression of pro-inflammatory factors.
All-transretinoic acid; Hepatic inflow occlusion; Reperfusion injury; Intestines
R656.7
A
1000- 4718(2013)09- 1620- 05
2013- 06- 18
2013- 08- 21
广东省科技计划(No. 2010B060900030;No. 2010B031600206)
△通讯作者 Tel: 020-85252228; E-mail: dr_ctf@126.com
10.3969/j.issn.1000- 4718.2013.09.014

