狗尾草水提取物对6种植物的化感作用
朱 强, 张得怀, 王雪剑, 田曾元, 郭予琦
(郑州大学生命科学学院,河南郑州 450001)
狗尾草水提取物对6种植物的化感作用
朱 强, 张得怀, 王雪剑, 田曾元, 郭予琦
(郑州大学生命科学学院,河南郑州 450001)
采用室内培养皿法测试了狗尾草地上部分水浸提液对小麦、高粱、绿豆、黄瓜、萝卜等农作物和牛筋草(杂草)的化感作用。结果表明:狗尾草水浸提液对植物种子萌发和幼苗生长具有较高的化感抑制作用;当水浸提液的质量浓度为0.025 0 g/mL时,除绿豆外,小麦、黄瓜、萝卜和高粱等农作物的种子萌发均受到显著或极显著的抑制作用,其发芽率的RI值分别为-0.56、-0.17、-0.28、-0.27;在0.050 0 g/mL浸提液处理下,除黄瓜苗高、苗鲜重、根鲜重、绿豆根鲜重外,5种农作物根和苗的生长受到极显著的抑制,小麦、绿豆、黄瓜、萝卜、高粱根长的RI值分别为-0.75、-0.60、-0.61、-1.00、-0.61;当浸提液浓度为0.030 g/mL时,牛筋草种子不能萌发,而小麦、绿豆的叶绿素含量和可溶性糖含量则从生理生化水平反映出不同程度的化感效应。综合研究结果可知,狗尾草显示出极强的化感作用,为进一步分离、鉴定和开发环境友好型除草剂提供了理论依据和支持。
狗尾草;水提取物;化感作用;抑制效应
化感作用是植物或微生物的代谢分泌物对环境中的其他植物或微生物的有利或不利的效应。植物化感作用通过淋溶、挥发、残体分解和根系分泌等方式向环境中释放化学物质,从而对周围植物产生直接或间接的、有害或有利的作用[1]。研究优势杂草的化感作用对实现杂草的有效控制、减少农业生态系统对化学农药的依赖具有重要意义[2]。目前国内学者已经对优势杂草进行了许多研究[3-6],但对于常见杂草狗尾草(Setariaviridis)的化感作用则鲜有报道。
狗尾草俗称毛毛狗、谷莠子、莠草,是谷类、麦类、玉米、棉花、豆类、马铃薯等作物田的主要杂草,也是果园、蔬菜田的常见杂草,更是草坪中的顽固性杂草[7]。狗尾草的发生极为普遍,除北非、东非和澳大利亚东部一些地区外,在大多数欧亚和中东国家均有分布[8],是我国农田的常见杂草。狗尾草繁殖能力强、生长速度快、生长期长、适应性强、耐旱耐贫瘠,在酸性或碱性土壤中均可生长。农田的狗尾草常与农作物竞争水分和养分,从而影响作物的生长和产量,发生严重时甚至可以形成优势种群密被田间,造成作物严重减产。国外曾报道狗尾草导致小麦、玉米、大豆分别减产44%、28%、29%,同时也可造成甜菜、葡萄和其他作物的产量损失[7]。据研究,狗尾草的竞争优势可能部分来自其化感作用[9-10],本试验对此作了进一步研究,以期为全面了解狗尾草的化感作用并在农业生产上利用其化感作用提供必要的试验依据。
1 材料与方法
1.1 试验材料
果实期狗尾草全株采于郑州大学新校区的校园内;化感作用受体植物小麦(Triticumaestivum)、绿豆(Vignaradiata)、黄瓜(Cucumissativus)、萝卜(Raphanussativus)、高粱(Sorghumvulgare)种子购于河南郑州豫研种子科技有限公司;牛筋草(Eleusineindica)种子采于郑州大学校园内。
1.2 试验方法
1.2.1 狗尾草浸提液的制备 选取发育良好的狗尾草,剪去根部后将地上部分用水冲洗干净,自然风干后用粉碎机粉碎并过40目筛(孔径为 0.42 mm),称取一定量的粉末,加入10倍质量体积(即1 g加10 mL水)的蒸馏水后置于摇床中,26 ℃振荡浸提24 h,用4层纱布过滤即得质量浓度为 0.1 g/mL 的狗尾草水浸提液;以此作为母液,分别用蒸馏水稀释成0.100 0、0.050 0、0.025 0、0.012 5 g/mL 浓度梯度的狗尾草水浸提物,用于测定不同浓度处理下小麦、绿豆、黄瓜、萝卜和高粱的形态指标,以0 g/mL处理作为对照。另外,由于预试验中发现种子的萌发和生长受到的抑制程度较高,因此为了获得足够的材料用于测定生理指标,将测定生理指标的浸提液浓度调整为0.05、0.03、0.02、0.01 g/mL。
为了进一步确定狗尾草中化感物质的存在及其作用,试验设计为:将狗尾草切成2 cm左右的小段,加入20倍蒸馏水进行浸提,浸提液经二重过滤,第一重用定量滤纸过滤,第二重经滤膜(0.45 μm)过滤,以得到的不含微生物的浸提液作为母液(0.05 g/mL),再取部分母液分别稀释为0.030、0.010、0.005 g/mL,用于测定对牛筋草的化感作用,保存在4 ℃冰箱中备用。
1.2.2 生物测定 采用培养皿滤纸法进行化感活性的生物测定。取一定数量的培养皿,垫上双层滤纸后高温蒸汽灭菌。先将选好的籽粒饱满的小麦、绿豆、黄瓜、萝卜、高粱、牛筋草种子冲洗干净,其中牛筋草种子用10%次氯酸钠消毒5 min,其余消毒10 min,取出后用蒸馏水冲洗5次。每个培养皿中放50粒种子,设3次重复。在培养皿(直径 9 cm)中加入10 mL(牛筋草加6 mL)不同浓度的狗尾草水浸提物,以蒸馏水作为对照,在28 ℃、16 h/d光照条件的恒温箱内培养7 d,期间补充浸提液以保持滤纸湿润。每天记录种子的萌发数量(种子萌发以胚根或胚芽达到种子自身长度一半以上为准),7 d 后每处理取10株植物,测量苗高、根长、鲜重,生理指标只测定小麦和绿豆。
1.2.3 数据处理方法
发芽率=(第7天种子的发芽数/供试种子数)×100%
发芽指数=∑(Gt/Dt)
式中:Gt为t天内的发芽种子数(个);Dt为相应的发芽天数(d)。
由于不同植物在各指标间存在很大的差异,因此本试验采用衡量化感效应的敏感指数RI值[11]来表示化感效应,以便对不同植物进行比较。计算公式为:
RI=1-C/T(T>C)
RI=T/C-1(T≤C)
式中:C为对照,是用蒸馏水培养的受体植物各项指标的平均值;T为处理值,是用浸提液培养的受体植物各项指标的平均值。当RI>0时,表示浸提液具有促进作用;当RI<0时,表示浸提液具有抑制作用;RI的绝对值代表作用强度的大小。
叶绿素、可溶性糖含量的测量方法参照张志良等的方法[12]。
1.2.4 统计分析 用SPSS 13.0软件对数据进行统计分析和差异显著性检验。
2 结果与分析
2.1 狗尾草水浸提物对5种农作物种子萌发的影响
狗尾草水浸提物对各种植物种子的萌发均起到较强的化感抑制作用,并且随着浸提液质量浓度升高,抑制作用增强,但不同植物的抑制程度有所差异。由表1可以看出,在0.025 0 g/mL浸提液处理下,除绿豆外,其他农作物的发芽率、发芽指数受到的抑制作用与对照相比均到达显著或极显著水平。小麦和黄瓜的发芽率、发芽指数在0.012 5 g/mL浸提液处理时即受到显著抑制,小麦、黄瓜的RI值分别为-0.26、-0.29,-0.20、-0.23。高粱的发芽率和发芽指数在低浓度时表现出轻微的化感促进作用,但未达到显著水平,化感效应指数都为0.04。在高浓度下,萝卜对浸提液的化感作用最为敏感,在0.050 0 g/mL浸提液处理的情况下,萝卜的发芽率和发芽指数的抑制程度较其他种子高,RI值分别为-0.86、-0.95。绿豆对浸提液的处理最不敏感,发芽率在各浓度下均未受到显著影响,发芽指数的抑制作用只有在 0.100 0 g/mL 浸提液处理下与对照相比达到极显著水平,RI值为 -0.19;其他浓度处理下的化感效应均不显著。
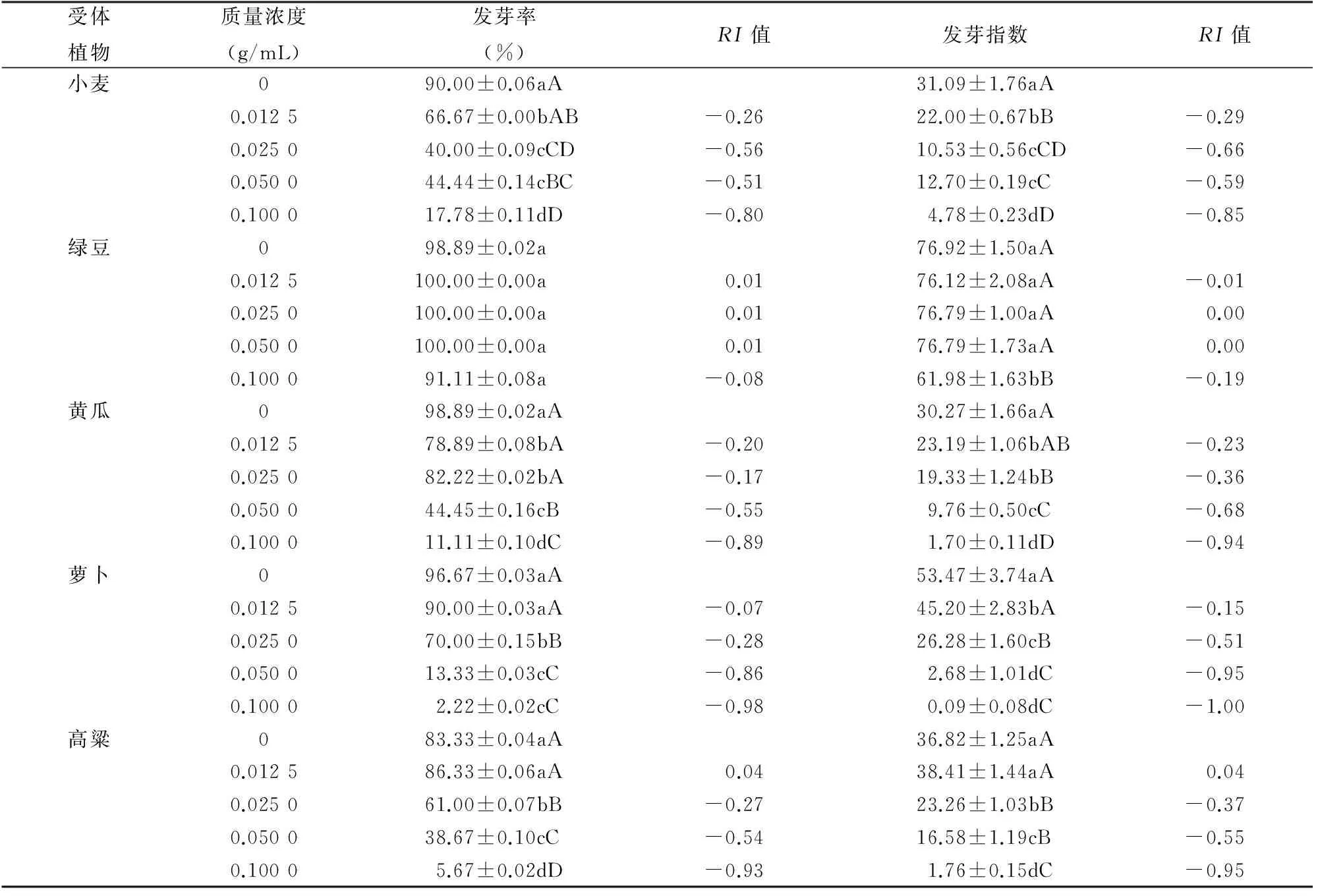
表1 狗尾草浸提液对5种作物种子萌发的影响Table 1 Effect of aqueous extracts from S. viridis on seed germination of five crops
注:同列数据后不同大、小写字母者分别表示差异极显著(P<0.01)、显著(P<0.05)。表2同。
2.2 狗尾草水浸提物对5种农作物幼苗生长的影响
不同质量浓度的狗尾草水浸提液对5种农作物的幼苗生长具有不同程度的影响。由表2可以看出,在0.100 0 g/mL浸提液浓度下,小麦、绿豆均未长出根;萝卜则在0.050 0 g/mL浓度下也未出根。萝卜、高粱在0.100 0 g/mL浸提液处理时受到极强的抑制作用而未能长出根和幼苗。在0.025 0 g/mL浓度下,高粱根和幼苗的生长受到显著抑制,苗高、根长的RI值分别为-0.41、-0.43。在0.050 0 g/mL浸提液处理下,除黄瓜的苗高、苗鲜重、根鲜重外,5种作物的各项指标受到的抑制程度均达到显著或极显著水平。小麦、黄瓜、萝卜的根长在0.012 5 g/mL浓度下即受到显著抑制,其中萝卜受到的抑制程度最高,RI值为-0.48。黄瓜的幼苗最不敏感,各浓度对苗高、苗鲜重的抑制作用均未达到显著水平。萝卜的苗高在0.012 5 g/mL浓度下受到极显著的促进作用,在其他作物中低浓度下也有轻微的促进作用出现,但未能达到显著水平。

表2 狗尾草浸提液对5种作物幼苗生长的影响Table 2 Effect of aqueous extracts from S. viridis on seeding growth of five crops.
2.3 狗尾草水浸提物对小麦、绿豆部分生理指标的影响
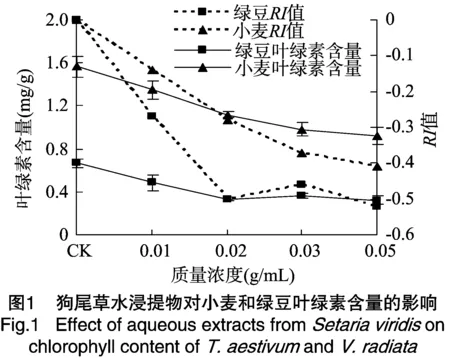
2.3.1 狗尾草水浸提物对小麦、绿豆叶绿素含量的影响 由图1可见,随着狗尾草水浸提液质量浓度升高,小麦和绿豆幼苗体内的叶绿素含量都下降,即叶绿素合成受到抑制的程度增加。在 0.01 g/mL 浸提液处理下,绿豆的叶绿素含量受到的抑制作用已经达到极显著水平,RI值为-0.28;在最高浓度0.05 g/mL浸提液处理下,RI值为 -0.52。小麦的叶绿素合成受到的抑制程度稍轻,在0.02 g/mL浸提液处理下,叶绿素含量比对照显著降低,RI值为-0.28;当用0.05 g/mL浸提液处理时,RI值为 -0.41。此外,在用低浓度浸提液处理时,绿豆和小麦的叶绿素含量急剧下降,而在高浓度时下降得较缓慢,说明2种植物的叶绿素含量对浸提物非常敏感,在浓度很低时即明显减少,进而影响光合作用。
2.3.2 狗尾草水浸提物对小麦和绿豆可溶性糖含
量的影响 由图2可以看出,随着浸提液质量浓度增加,小麦和绿豆的可溶性糖含量都表现出先增加后减少的趋势,但变化的程度存在差异。小麦的可溶性糖含量在各浓度下都比对照有所增加,在 0.02 g/mL 浓度时,增加量达到最大,RI值为0.15,与对照差异极显著。绿豆的可溶性糖含量在低浓度下有所增加,在高浓度下含量减少并与对照相比差异极显著,4个浓度下的RI值依次为0.02、0.08、-0.26、-0.31。结果表明,当化感物质在低浓度下时,绿豆的可溶性糖含量变化不如小麦敏感而缓慢增加;在高浓度的化感物质作用下则表现得非常敏感而急剧减少。

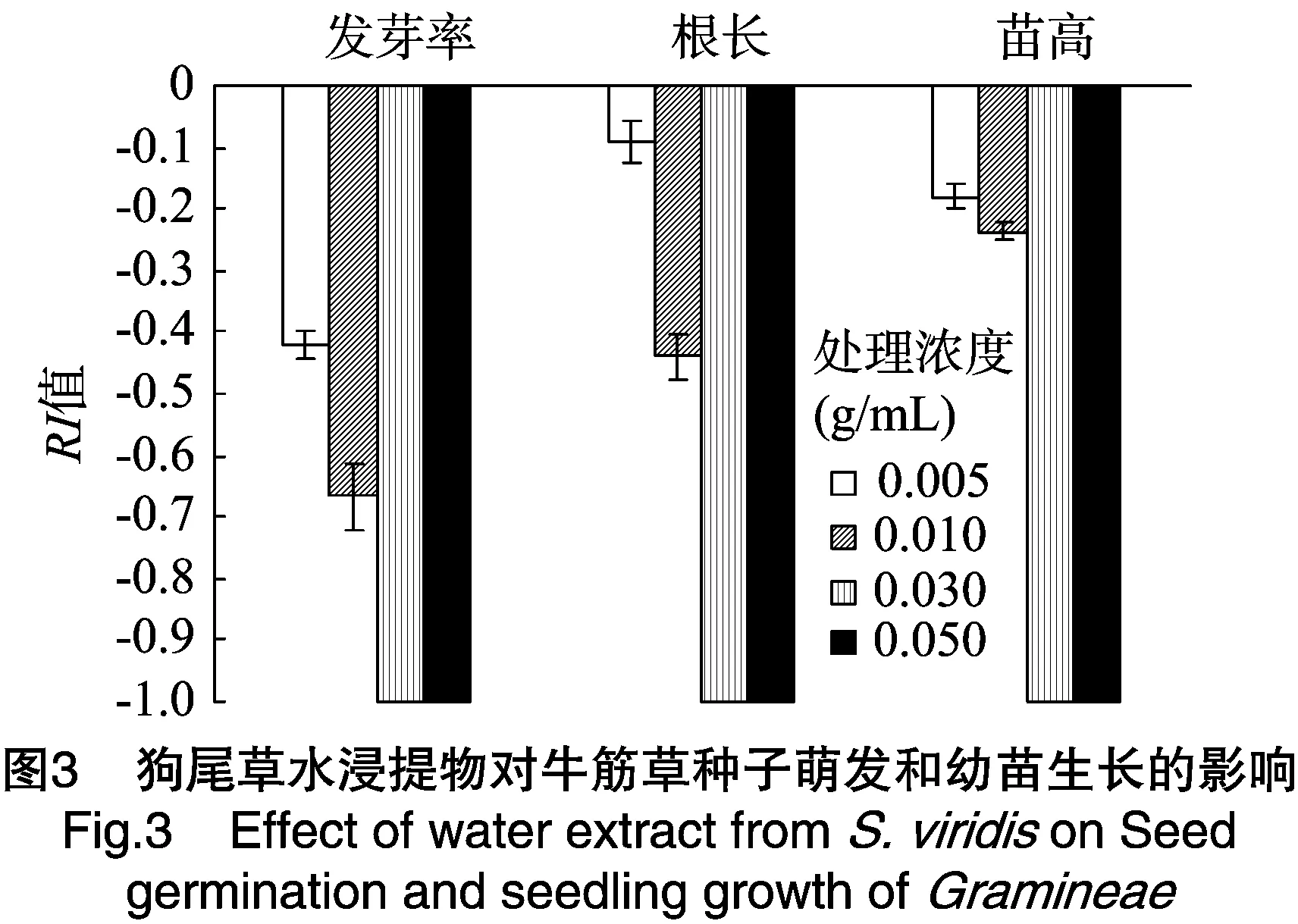
2.4 狗尾草水浸提物对牛筋草种子萌发和幼苗生长的影响 由图3可以看出,狗尾草浸提液对牛筋草种子萌发和幼苗生长均具有强烈的化感抑制作用。除了在0.005 g/mL浓度下牛筋草根长受到的抑制作用与对照相比未达到显著差异外,在其他各浓度下牛筋草的发芽率、根长、苗高均受到显著抑制;浸提液浓度在0.030 g/mL及以上时,牛筋草种子被完全杀死而不能萌发。从图中还可以看出,牛筋草发芽率受到的抑制作用在各浓度下均比根长和苗高强烈,在0.005 g/mL浸提液浓度下,牛筋草发芽率的RI值即达-0.42。
3 结论与讨论
试验结果表明,狗尾草地上部分水浸提液中含有活性极高的化感物质,浸提液在浓度很低的情况下即可对受试植物的种子萌发和幼苗生长产生显著的影响。当浸提液浓度为0.025 0 g/mL时,除绿豆外,小麦、黄瓜、萝卜、高粱的种子萌发受到显著或极显著的抑制。在0.050 0 g/mL浸提液处理下,除黄瓜苗高、苗鲜重、根鲜重,绿豆根鲜重外,5种作物根和幼苗生长受到的抑制程度均达到显著或极显著水平。因此无论是在种子萌发还是幼苗生长方面,浸提液对萝卜的影响都是最大。
为了排除了微生物的干扰,在对牛筋草的测试中,将浸提液进行了双重过滤,使结果更加可靠。浸提液在0.03 g/mL浓度时,牛筋草种子即不能萌发,可见狗尾草具有极强的化感作用,因而具有很大的应用潜力。通过不同浓度浸提液对不同受试植物的测试发现,相同浓度浸提液对不同植物的化感作用不同,这不仅反映出不同植物对化感物质的敏感性与物种的历史进化相关[13],同时也说明植物化感效应的专一性和选择性[14]。因此在应用化感作用控制其他植物生长时,不仅要选用强化感效应的材料,还应选择好目标植物[15]。不同浓度的浸提液对同一植物的作用也不同,即化感物质存在浓度效应,随着浓度的变化,其化感效应也不同[16]。值得注意的是,浓度效应并非仅由化感物质的作用强度改变造成,必然还存在溶液渗透压改变对植物造成的影响[17]。加入抽提物与水混合后的渗透压超过了影响受体种子发芽的渗透压阈值,即使没有化感物质也会对种子发芽产生抑制作用,因此在试验时一定要考虑植物材料与溶剂的比例[18]。
叶绿素含量是对化感作用十分敏感的一个生理指标,同时也是化感物质作用机理的重要方面[19]。化感物质也可以通过改变叶绿素合成间接影响光合作用[20],进而影响植物的生长发育。试验发现,随着狗尾草水浸提液质量浓度升高,小麦和绿豆幼苗体内的叶绿含量都下降,在0.02 g/mL浓度下,两者的叶绿含量即显著减少,从而影响光合作用中光能的吸收和传递,抑制受体生长[21-22]。生长在逆境中的植物代谢反映的变化趋势相同,即水解作用增强,合成作用减弱[23]。试验中小麦和绿豆的可溶性糖含量都呈现出先增加后减少的趋势,可能是因为在低浓度下小麦通过增加可溶性糖含量来增强其对化感作用的抵御能力;但在高浓度下,化感作用强度超过了小麦的承受限度,致使可溶性糖含量开始减少。可溶性糖含量的变化则从另一个方面体现了化感物质的作用机理。
研究、分离高活性化感物质并利用它们对不同植物作用效果不同的特点,可以用来合成选择性除草剂的先导化合物、仿生合成环境友好除草剂,从而使其对作物的不良影响降到最低[24]。狗尾草所含化感物质究竟是什么以及化感物质在自然界中的作用途径等还有待于进一步研究。
致谢:本研究得到郑州大学2013年度大学生创新创业训练计划项目资助,指导教师为田曾元副教授,特向他们表示感谢。
[1]Rice E L. Allelopathy[M]. New York:Academic Press.1984.
[2]曾任森,骆世明. 香茅、胜红蓟和三叶鬼针草植物他感作用研究[J]. 华南农业大学学报,1993,14(4):8-14.
[3]朱 慧,马瑞君,陈树思,等. 高寒草场主要牧草对黄帚橐吾水浸液化感胁迫的生理响应[J]. 草业学报,2007,16(5):102-106.
[4]钟 声,段新慧,奎嘉祥. 紫茎泽兰对16种牧草发芽及幼苗生长的化感作用[J]. 草业学报,2007,16(6):81-87.
[5]张开梅,石 雷,姜闯道,等. 紫茎泽兰对金毛狗孢子萌发和配子体发育的化感作用[J]. 草业学报,2008,17(2):19-25.
[6]郭晓霞,邬彩霞,沈益新. 毛苕子对3种杂草种子萌发和幼苗生长的化感抑制[J]. 草业学报,2007,16(2):90-93.
[7] 赵杏利,邓 晖,牛永春. 一种狗尾草病原真菌的鉴定及菌株致病性研究[J]. 菌物学报,2010,29(2):172-177.
[8] Holm L G,Pancho J V,Herberger J P,et al . Ageographical atlas of world weeds[M]. Krieger Publishing,1991:1-391.
[9]张 红. 常见杂草化感除草活性及其作用机理研究[D]. 兰州:西北师范大学,2007.
[10]沈慧敏,郭鸿儒,黄高宝. 不同植物对小麦、黄瓜和萝卜幼苗化感作用潜力的初步评价[J]. 应用生态学报,2005,16(4):740-743.
[11] Williamson G B,Richardson D.Bioassays for allelopathy:measuring treatment responses with independent controls[J]. Journal of Chemical Ecology,1988,14(1):181-187.
[12] 张志良,瞿伟菁,李小方. 植物生理学实验指导[M]. 4版. 北京:高等教育出版社,2009.
[13]胡 飞,孔垂华. 胜红蓟化感作用研究 Ⅵ.气象条件对胜红蓟化感作用的影响[J]. 应用生态学报,2002,13(1):76-80.
[14]孔垂华,胡 飞. 植物化感(相生相克)作用及其应用[M]. 北京:中国农业出版社,2001.
[15]迟 铭,刘增文. 杜仲叶水提取物对几种农作物的化感作用[J]. 西北农业学报,2011,20(6):168-173.
[16]曾任森,骆世明,石木标,等. 彩色豆马勃子实体的化感作用及其化感物质的分离鉴定[J]. 应用生态学报,1999,10(2):206-208.
[17]Leather G R,Einhellig F A. Bioassays in the study of allelopathy[M]//Putnam A R,Tang C S . The science of allelopathy. New York:Wiley,1986:133-145.
[18]耿广东,程智慧,张素勤,等. 植物化感作用研究方法的探讨[C]. 中国园艺学会第六届青年学术讨论会论文集,2004:717-722
[19]Patterson D T. Effects of allelopathic chemicals growth and physiological responses of soybean(Glycinemax)[J]. Weed Science,1981,29(1):53-59.
[20]王 倩,孙会军,孙令强. 化感物质及作用机理[J]. 中国蔬菜,2005(增刊):70-74.
[21]林文雄,何华勤,郭玉春,等. 水稻化感作用及其生理生化特性的研究[J]. 应用生态学报,2001,12(6):871-875.
[22]何华勤. 水稻化感作用的潜力及其机制研究[D]. 福州:福建农业大学,2000.
[23]王 硕,慕小倩,杨 超,等. 黄花蒿浸提液对小麦幼苗的化感作用及其机理研究[J]. 西北农林科技大学学报:自然科学版,2006,34(6):106-110.
[24]高兴祥,李 美,高宗军,等. 苍耳对不同植物幼苗的化感作用研究[J],草业学报,2009,18(2):95-101.
AllelopathicEffectofAqueousExtractsfromSetariaviridisonSixPlants
ZHU Qiang,ZHANG De-huai,WANG Xue-jian,TIAN Zeng-yuan,GUO Yu-qi
(College of Life Science,Zhengzhou University,Zhengzhou 450001,China)
The allelopathic effect of an aqueous extract from aerial parts ofSetariaviridison wheat,sorghum,mung bean,cucumber,radish and the weed goosegrass was tested in petri dishes. The extract had significant inhibited seed germination and seedling growth of all bioassay plants except mung bean. At a mass concentration of the aqueous extracts of 0.025 g/mL,RI values for seed germination for the four crops (mung bean excluded) were - 0.56,-0.17,-0.28,and -0.27,respectively. When the mass concentration of the aqueous extracts was increased to 0.05g/mL,the root and seeding growth of five crops were extremely inhibited except for the seedling height and seedling fresh weight of cucumber,the RI values for root length of wheat,mung bean,cucumber,radish,sorghum were -0.75,-0.60,-0.61,1.00,and -0.61,respectively. At a concentration of 0.03 g/mL,goosegrass seed did not germinate,while chlorophyll and soluble sugar content reflected different degrees of allelopathic effects on the physiology and biochemistry of the plant. ThereforeS.viridisextracts were strongly allelopathic,providing a lead for the purification,appraisal and development of a possible environmentally friendly herbicide.
Setariaviridis;aqueous extract;allelopathy;inhibitory effect
S432.2+2
A
1003-935X(2013)04-0025-06
朱 强,张得怀,王雪剑,等. 狗尾草水提取物对6种植物的化感作用[J]. 杂草科学,2013,31(4):25-30.
2013-09-16
郑州大学2013年度大学生创新创业训练计划。
朱 强(1991—),男,河南郑州人,本科生,从事植物化感方面的研究。E-mail:zhuqiang21@163.com。
郭予琦,女,副教授,从事植物生物化学和分子生物学的研究。E-mail:guoyuqi@zzu.edu.cn。

