硼酸亲和整体柱在富集中药活性物质中的应用
胡青红, 王超然, 李 静,2, 王 彦, 谷 雪, 阎 超*
(1.上海交通大学药学院,上海 200240;2.上海通微分析技术有限公司,上海 201203)
毛细管整体柱(monolithic column)是通过在毛细管内原位聚合或固化的方法制备得到的具有多孔结构的整体棒状固定相,因其具有特殊的多孔结构和简便的制备过程而受到关注[1]。其中,聚合物毛细管整体柱作为一种新型的色谱固定相,由于其比无机硅胶整体柱在生物相容性、pH稳定性和修饰选择性等方面更具有优势,自20世纪90年代被引入后,发展十分迅速[2,3]。Svec[4,5]和 Arrua 等[6]综述了近些年来聚合物毛细管整体柱的最新进展。
硼酸亲和整体柱是一类具有特异亲和性能的聚合物整体柱。它利用硼酸基团能够可逆结合含顺二羟基结构的化合物,生成稳定的五元环原理来进行特异性分离。其中以苯硼酸为功能基团的硼酸亲和材料用得最多。其反应机理如图1所示。在碱性条件(pH>8)下,硼酸基团经过羟化从原来的三键共面结构变成四面体硼酸阴离子,然后与顺二羟基化合物形成酯环;而在酸性条件下,此前产生的环状酯水解,使反应向反方向进行[7,8]。整体柱渗透性好、传质快等优势结合硼酸亲和色谱的专一性,非常适合于复杂样品的分析。目前,硼酸亲和整体柱主要用于生物样品的分离分析,如碳水化合物[9,10]、糖蛋白[11-13]等的分离分析,而将其应用于中药及其提取物的分析还鲜有报道。

图1 硼酸亲和作用原理Fig.1 Schematic illustration of the boronic acid method
中药提取物作为一类新兴的天然药物产品,正被广泛应用于医疗保健等行业[14]。但中药提取物成分复杂,且在很多中药材中,一些小分子活性物质的含量很低,往往要经过多步提取、浓缩才能进行测定。因而对这类小分子物质的检测,富集手段显得尤为重要。硼酸亲和整体柱因其专一的亲和性,能够特异性地结合含有顺二羟基结构的化合物,因此可以用于此类化合物的提取富集。本研究利用以4-乙烯基苯硼酸(VPBA)为功能单体,季戊四醇三丙烯酸酯(PETA)为交联剂所制备的poly(VPBA-co-PETA)硼酸亲和毛细管整体柱[15]选择性地富集两种常见中草药—— 蒲公英和刺果卫矛中的活性物质,如绿原酸等,发现经poly(VPBA-co-PETA)整体柱富集后,原样品中被分析物的浓度显著提高,达到了预期的效果。
1 实验部分
1.1 仪器、试剂与材料
TriSepTM-2100加压毛细管电色谱系统(美国Unimicro Technologies公司),包括溶剂输送系统、柱上紫外/可见光检测器、微流控系统、高压电源和数据采集系统;岛津高效液相色谱仪(日本岛津公司),包括LC-20AB泵、SPD-20A检测器、DGU-20A3脱气仪和LC solution工作站。石英毛细管(100 μm i.d.,365 μm o.d.,河北永年锐沣色谱器件有限公司);0.22 μm水相、有机相滤膜(上海半岛实业有限公司净化器材厂)。
甲醇和乙腈(色谱纯,美国TEDIA公司);γ-甲基丙烯酰氧丙基三甲氧基硅烷(γ-MAPS,纯度97%)、VPBA(纯度 98%)、PETA(纯度 98%)均购于英国Alfa Aesa公司;偶氮二异丁腈(AIBN)、乙二醇和二甘醇购于中国医药集团上海化学试剂有限公司;三氟乙酸(TFA)等其他试剂均为分析纯。
蒲公英(Herba Taraxaci)、刺果卫矛(Euonymus acanthocarpus)购于河北省安国市伊康药业有限公司,经上海交通大学药学院王梦月副教授鉴定为菊科植物蒲公英的干燥全草和卫矛科植物刺果卫矛的干燥根。
1.2 毛细管整体柱的制备[15]
毛细管首先经过碱洗、酸洗、甲醇冲洗等预处理步骤后进行硅烷化反应以修饰其内壁;然后称取单体VPBA、PETA、致孔剂乙二醇、二甘醇以及引发剂AIBN适量,混合均匀后抽入毛细管内,置于75℃水浴中反应12 h,得到poly(VPBA-co-PETA)硼酸亲和整体柱。
1.3 对照品储备液的制备
精密称定咖啡酸、绿原酸对照品各1 mg,用少量甲醇溶解,配制成0.5 g/L的对照品储备液,经0.22 μm 滤膜过滤,备用。
精密称定3,4-二羟基苯乙醇和2,3-二羟基苯甲酸苄酯精提物对照样品各约10 mg,用少量甲醇溶解,配制成1 g/L储备液,经0.22 μm滤膜过滤,备用。
所有样品在4℃条件下避光保存,实验前用流动相稀释配制至所需浓度。
1.4 中药样品的处理
蒲公英:经粉碎后称取适量蒲公英粉末,加10倍质量的甲醇超声提取、过滤;滤渣中再加8倍量的甲醇超声提取、过滤;合并两次滤液,旋转蒸发至干,加水定容至一定体积,得其醇提液。取适量醇提液用水(醇提液与水的体积比为1∶4)分散后依次用石油醚、氯仿、乙酸乙酯和正丁醇萃取、回收,冷冻干燥后用甲醇定容成1 g/L储备液。取正丁醇提取液,稀释后进样。
刺果卫矛:取刺果卫矛粉末1 g,加甲醇20 mL,回流30 min,抽滤,滤液蒸干,残渣中加水10 mL,加热使其溶解,抽滤,滤液用醋酸乙酯振摇提取2次(10 mL/次),合并醋酸乙酯液,蒸干,加甲醇使溶解,作为刺果卫矛样品储备液。储备液稀释后进样。
1.5 色谱条件
1.5.1 毛细管液相色谱分析条件
毛细管poly(VPBA-co-PETA)硼酸亲和整体柱柱长45 cm(有效长度25 cm)。流动相:A相为乙腈-10 mmol/L磷酸盐缓冲液(pH 8.5)(20∶80,v/v),B相为乙腈-1%乙酸(pH 2.8)(20∶80,v/v);洗脱程序:先用碱性的A相平衡系统,待不保留物质出峰(约10 min)后,切换至酸性的B相洗脱25 min;流速50 μL/min。检测波长为214 nm。样品环体积约为0.8 μL;分流比约为38∶1,实际进样量约为20 nL。
1.5.2 高效液相色谱分析条件
色谱柱:TSK gel ODS-100V(250 mm×4.6 mm)。流动相:A 相为乙腈-水(10∶90,v/v;含0.1%TFA),B 相为乙腈-水(90∶10,v/v;含 0.1%TFA);线性梯度洗脱程序:0~35 min,100%A~100%B。流速1 mL/min;检测波长为214 nm。
2 结果与讨论
2.1 毛细管整体柱对蒲公英中活性物质的富集
蒲公英提取物中富含酚酸类化合物,具有广谱抗菌、抗氧化、消炎利胆、促进新陈代谢等作用[16]。绿原酸和咖啡酸是其中主要的有效成分[17](其结构见图2),两者均是含有顺二羟基结构的化合物。

图2 绿原酸和咖啡酸的分子结构Fig.2 Molecular structures of chlorogenic acid and caffeic acid
2.1.1 绿原酸和咖啡酸标准品的分离
按1.5.2节的色谱条件对绿原酸和咖啡酸标准品进行分离,得到的图谱见图3a。从图3a中可以看出,绿原酸和咖啡酸在高效液相色谱中分离效果良好,并依其极性的大小顺序先后出峰,出峰时间分别为17.0 min左右和19.5 min左右。以此作为绿原酸和咖啡酸保留时间的参考标准。
2.1.2 蒲公英提取物中绿原酸和咖啡酸的分离
取制备好的蒲公英提取物样品进样,按1.5.2节分析条件分离,得到的色谱图如图3b所示。从图3b中可见,在17.0 min和19.5 min的位置只出现了极小的色谱峰,说明蒲公英正丁醇提取液中绿原酸和咖啡酸的含量很少,直接检测困难。
2.1.3 蒲公英提取物中绿原酸和咖啡酸富集后的分离
由于绿原酸和咖啡酸的分子结构中含有顺二羟基,所以能够被poly(VPBA-co-PETA)硼酸亲和整体柱特异捕获。实验中,先用碱性流动相平衡系统,取制备好的蒲公英提取物样品进样富集分离,此时绿原酸和咖啡酸被保留在整体柱上,其余物质被直接洗脱;将流动相切换成酸性流动相后,保留在整体柱上的绿原酸和咖啡酸被洗脱,收集洗脱液,按1.5.2节条件进行HPLC检测,得到的色谱图如图3c所示。由此可以看到,经整体柱富集后,蒲公英提取物中绿原酸和咖啡酸的色谱峰显著增大,表明poly(VPBA-co-PETA)整体柱能很好地富集提取样品中的绿原酸和咖啡酸。

图3 (a)绿原酸和咖啡酸标准品、(b)蒲公英提取物样品直接进样和(c)经亲和整体柱富集后进样的高效液相色谱图Fig.3 HPLC chromatograms of(a)a mixture of chlorogenic acid and caffeic acid standards,(b)an extract sample of Herba Taraxaci and(c)an extract sample of Herba Taraxaci after enrichment by the monolithic column
2.2 毛细管整体柱对刺果卫矛中活性物质的富集
为了进一步考察poly(VPBA-co-PETA)整体柱对中药中小分子活性物质的富集作用,我们选择了另一种中草药刺果卫矛。刺果卫矛提取物中含有3,4-二羟基苯乙醇和2,3-二羟基苯甲酸苄酯等小分子活性物质,这两种化合物的结构式如图4所示,可见它们均含有顺二羟基结构,推测可以被poly(VPBA-co-PETA)亲和整体柱特异性捕获。
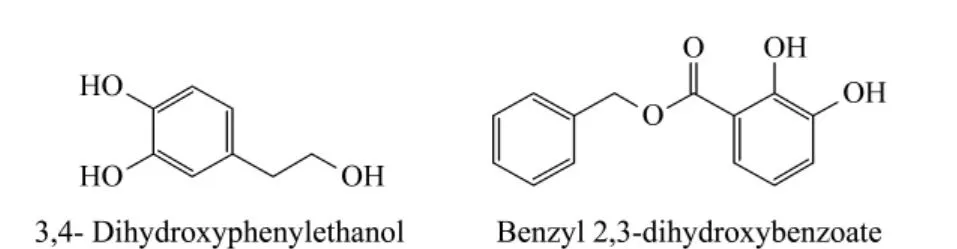
图4 3,4-二羟基苯乙醇和2,3-二羟基苯甲酸苄酯的分子结构图Fig.4 Molecular structures of 3,4-dihydroxyphenylethanol and benzyl 2,3-dihydroxybenzoate
在1.5.2节条件下对3,4-二羟基苯乙醇和2,3-二羟基苯甲酸苄酯精提物的对照品进行HPLC分离,结果分别如图5a和图5b所示。它们在反相液相色谱柱上的保留时间分别约为17 min和31 min。出峰顺序与其极性大小顺序一致。
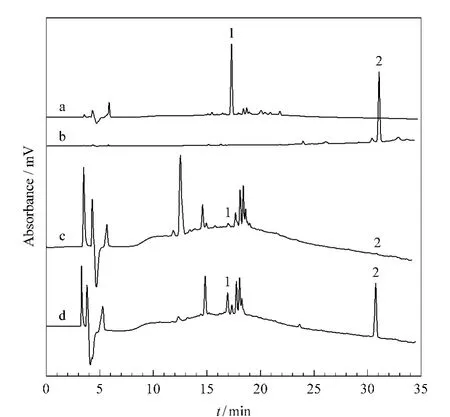
图5 (a)3,4-二羟基苯乙醇精提物对照样品、(b)2,3-二羟基苯甲酸苄酯精提物对照样品、(c)刺果卫矛提取物样品直接进样和(d)经亲和整体柱富集后进样的高效液相色谱图Fig.5 HPLC chromatograms of(a)3,4-dihydroxyphenylethanol reference, (b)benzyl 2,3-dihydroxybenzoate reference,(c)an extract sample of Euonymus acanthocarpus and(d)an extract sample of Euonymus acanthocarpus after enrichment by the monolithic column
在同样的分析条件下对刺果卫矛提取物直接进样分析。从图5c中可见,刺果卫矛提取物中大约有10余种活性物质,在17 min处3,4-二羟基苯乙醇的出峰位置只有一个很小的色谱峰,在31 min处2,3-二羟基苯甲酸苄酯的出峰位置几乎看不到色谱峰,说明刺果卫矛提取物中3,4-二羟基苯乙醇和2,3-二羟基苯甲酸苄酯的含量很低,直接用HPLC分析检测不到。将上述样品经过poly(VPBA-co-PETA)硼酸亲和整体柱后,收集酸性条件下的洗脱液,然后进行HPLC分析,得到的色谱图见图5d。与图5c对比可看出,经硼酸亲和整体柱富集后,在17 min和31 min均有明显的色谱峰出现,说明3,4-二羟基苯乙醇和2,3-二羟基苯甲酸苄酯被很好地富集在硼酸亲和柱上,使得其浓度显著提高,从而得到检测。
3 结论
本研究在自制的poly(VPBA-co-PETA)硼酸亲和整体柱上可以特异性地捕获含有顺二羟基的化合物。在前期实验的基础上,我们将其用于蒲公英中的绿原酸和咖啡酸、刺果卫矛中的3,4-二羟基苯乙醇和2,3-二羟基苯甲酸苄酯等含顺二羟基结构的小分子活性物质的富集,使其色谱峰响应显著提高,达到了检测要求,为中药中低含量活性物质的分离检测提供了新的思路。
[1]Chen X,Tolley H D,Lee M L.J Sep Sci,2011,34:2088
[2]Cao Q,Xu Y,Liu F,et al.Anal Chem,2010,82:7416
[3]Connolly D,Currivan S,Paull B.Proteomics,2012,12:2904
[4]Svec F.J Chromatogr A,2010,1217:902
[5]Svec F.J Chromatogr A,2012,1228:250
[6]Arrua R D,Talebi M,Causon T J,et al.Anal Chim Acta,2012,738:1
[7]Liu X C.Chinese Journal of Chromatography(刘小川.色谱),2006,24(1):73
[8]Hage D S.Clin Chem,1999,45:593
[9]Shoji E,Freund M S.J Am Chem Soc,2002,124(42):12486
[10]Westmark P R,Gardiner S J,Smith B D.J Am Chem Soc,1996,118:11093
[11]Zhang Q B,Tang N,Brock J W C,et al.J Proteome Res,2007,6(6):2323
[12]Ren L B,Liu Y C,Dong M M,et al.J Chromatogr A,2009,1216:8421
[13]Lin Z A,Pang J L,Lin Y,et al.Analyst,2011,136:3281
[14]Xu W G,Xu P.Research& Information of Traditional Chinese Medicine(徐为公,徐鹏.中药研究与信息),2005,7(10):34
[15]Wang C R,Wang Y,Gao Y,et al.Chinese Journal of Analytical Chemistry(王超然,王彦,高也,等.分析化学),2012,40(8):1207
[16]Lü J H,Qiu S C,Zhang L T,et al.Lishizhen Medicine and Materia Medica Research(吕俊华,邱世翠,张连同,等.时珍国医国药),2002,13(4):215
[17]Huang C J,Lin X D,Li J,et al.Modern Chinese Medicine(黄昌杰,林晓丹,李娟,等.中国现代中药),2006,8(5):32

