胃液总胆汁酸和幽门螺杆菌感染与胃黏膜肠化生的相关性研究
丁 慧 陈胜良 李 吉 杨 华
上海交通大学医学院附属仁济医院消化内科 上海市消化疾病研究所1(200001)上海市长宁区中心医院检验科2 内镜室3 病理科4
胃黏膜肠化生被认为是肠型胃癌的重要癌前状态,流行病学研究显示胃肠化生患者的胃癌发生风险增高达10倍以上,不完全型肠化生与胃癌的关系更为密切[1]。临床和实验研究显示幽门螺杆菌(Helicobactor pylori,Hp)感染和胃内胆汁反流与胃黏膜肠化生和癌变密切相关[2,3],但其机制尚不完全清楚。尾型同源框基因2(caudal type homeobox 2,CDX2)为尾型同源框转录因子基因家族成员之一,其编码蛋白是一种肠道特异性基因关键调控因子,胃黏膜肠化生和Barrett食管上皮中均可见CDX2异位表达。杯状细胞特异性基因黏蛋白2(mucin 2,MUC2)为肠道特异性基因之一,其表达受CDX2调控。Xu等[3]分别以鹅去氧胆酸和胆汁酸核受体法尼酯X受体(FXR)激动剂作用于正常大鼠胃上皮细胞,发现两者均可诱导CDX2、MUC2 mRNA和蛋白表达,且该作用可为FXR拮抗剂所阻断,表明胆汁酸系通过FXR诱导胃黏膜肠化生和癌变。本研究以有胆汁反流的慢性胃炎患者为研究对象,分析胃液总胆汁酸(total bile acid,TBA)浓度和Hp感染情况与肠化生指标CDX2、MUC2蛋白表达的相关性,为探索胆汁酸参与胃黏膜癌变的机制提供实验依据。
材料与方法
一、标本来源
收集2011年6月~2012年7月81例因上消化道症状于上海市长宁区中心医院接受胃镜检查发现有胃内胆汁反流[内镜下见胃黏液湖黄染和(或)黏膜有黄色黏液附着]且无腹部手术史者和40例无胆汁反流(胃黏液湖清)者的胃液标本(15 mL),于胃窦部至少取2块活检标本。同时采集受检者空腹静脉血,离心分离血清,留取3 mL血清,-20℃保存。
胆汁反流组男41例,女40例,年龄21~82岁,平均(49.23±16.54)岁;对照组(无胆汁反流)男20例,女20例,年龄19~82岁,平均(53.75±13.81)岁。两组间性别构成、年龄差异无统计学意义。
二、方法
1.病理诊断:胃黏膜活检标本常规石蜡包埋、切片,行HE染色,由一名资深病理科医师根据“中国慢性胃炎共识意见”[4]中的相关标准作出病理诊断。
肠化生分型:胃黏膜标本蜡块4 μm连续切片,行AB-PAS、HID-AB染色,染色液为珠海贝索生物技术有限公司产品。以结肠和小肠组织作为阳性对照,以正常胃黏膜组织作为阴性对照。完全结肠型:腺体结构规则,未见细胞异型,可见Paneth细胞,可见蓝色AB(+)和黑色HID(+)染色细胞;完全小肠型:腺体结构规则,未见细胞异型,可见Paneth细胞,可见蓝色AB(+)染色细胞;不完全结肠型:腺体结构不规则,可见细胞异型,Paneth细胞少或无,可见蓝色AB(+)、红色 PAS(+)和黑色HID(+)染色细胞;不完全小肠型:腺体结构不规则,可见细胞异型,Paneth细胞少或无,可见蓝色AB(+)和红色PAS(+)染色细胞。
2.胃液 TBA检测:胃液标本3350×g离心15 min,取上清液。TBA测定试剂盒(循环酶法)为德赛诊断系统(上海)有限公司产品,线性范围为0.5~190 μmol/L,使用罗氏 MODULAR P800 全自动生化分析仪进行检测。由于标本为含有胆汁的胃液,胆汁酸浓度较高,故将生化分析仪设置为超过线性范围时自动以0.9%NaCl溶液5倍稀释标本,以保证检测结果的准确性。
3.血清Hp IgG抗体检测:Hp IgG抗体检测试剂盒(间接固相免疫层析法)为新加坡MP Biomedicals Asia Pacific Pte.Ltd产品,按试剂盒说明进行操作。
4.CDX2、MUC2免疫组化染色:胃黏膜标本蜡块4 μm连续切片,以EnVision二步法行CDX2、MUC2免疫组化染色。鼠抗人CDX2单克隆抗体、鼠抗人MUC2单克隆抗体为上海长岛生物技术有限公司产品(1:50稀释),ChemMateTMEnVision+/HRP/DAB兔/鼠通用型免疫组化检测试剂盒为DAKO公司产品。以PBS代替一抗作为阴性对照,以结肠或小肠组织作为阳性对照。CDX2蛋白阳性染色定位于细胞核,MUC2蛋白阳性染色定位于细胞质/细胞外膜,根据阳性细胞比例和细胞染色强度进行评分,总分为两项评分之积。阳性细胞比例:<10%,0分;10% ~30%,1分;31% ~60%,2分;>60%,3分。细胞染色强度:浅黄色,0分;黄色,1分;棕黄色,2分。总分≤3判为阴性(-),≥4判为阳性(+)。
三、统计学分析
结 果
一、病理诊断
胆汁反流组慢性非萎缩性胃炎(chronic nonatrophic gastritis,CNAG)37例,其中15例伴活动性,4例伴肠化生;慢性萎缩性胃炎(chronic atrophic gastritis,CAG)44例,均伴肠化生,其中高级别上皮内瘤变1例,低级别上皮内瘤变31例。对照组40例均为CNAG,未见伴活动性或肠化生者。
根据AB-PAS、HID-AB染色结果,胆汁反流组44例CAG患者中,18例(40.9%)肠化生分型为完全结肠型(见图1),26例(59.1%)为完全小肠型(见图2),未见不完全结肠型肠化生和不完全小肠型肠化生。
二、胃液TBA浓度和血清Hp IgG抗体阳性率
胆汁反流组胃液TBA浓度明显升高,与对照组相比差异有统计学意义,其中CAG组显著高于CNAG组。胆汁反流组血清Hp IgG抗体阳性率略低于对照组,但差异无统计学意义,CAG组与CNAG组间差异亦无统计学意义(见表1)。
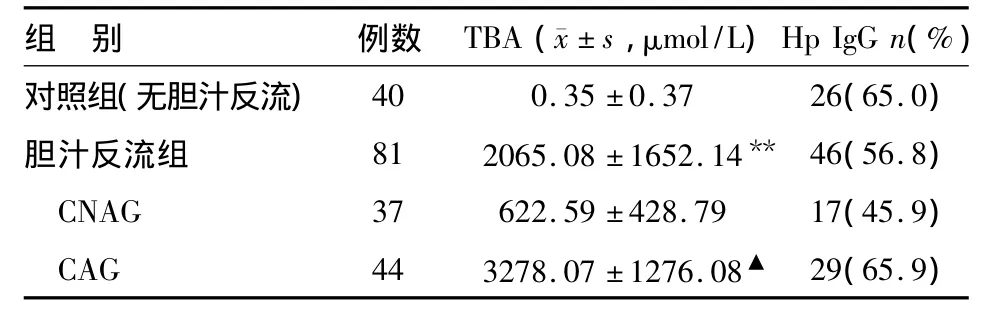
表1 各组胃液TBA浓度、血清Hp IgG抗体阳性率比较
三、胃黏膜CDX2、MUC2蛋白表达
CDX2蛋白表达定位于细胞核,肠化生上皮中阳性细胞着色均匀、清晰(见图3);MUC2蛋白表达定位于细胞质,在肠化生上皮中主要分布于阳性细胞(以杯状细胞为主)的周边部胞质,以核周、核膜处最为明显,形似“戒指”,或胞质弥漫着色呈细颗粒状(见图4)。胆汁反流组CDX2、MUC2蛋白阳性表达率明显高于对照组,差异有统计学意义,其中CAG组显著高于CNAG组(见表2)。

表2 各组胃黏膜CDX2、MUC2蛋白阳性表达率比较n(%)
四、胆汁反流组胃液TBA浓度、Hp感染情况与胃黏膜CDX2、MUC2蛋白表达的关系
根据胃液TBA浓度将胆汁反流组分为四个亚组:0~500、501~1000、1001~3000 和 >3000 μmol/L亚组,各亚组间胃黏膜CDX2、MUC2蛋白表达差异有统计学意义(P<0.01),阳性表达率随TBA浓度的逐级增高呈上升趋势;血清Hp IgG抗体阳性与阴性组间CDX2、MUC2蛋白表达差异亦有统计学意义(P<0.05),Hp感染阳性者阳性表达率明显高于Hp感染阴性者。胃液 TBA>3000 μmol/L者的CDX2、MUC2蛋白阳性表达率显著高于Hp感染阳性者(P<0.01)(见表3)。

表3 胆汁反流组胃液TBA浓度、Hp感染情况与胃黏膜CDX2、MUC2蛋白表达的关系n(%)
讨 论
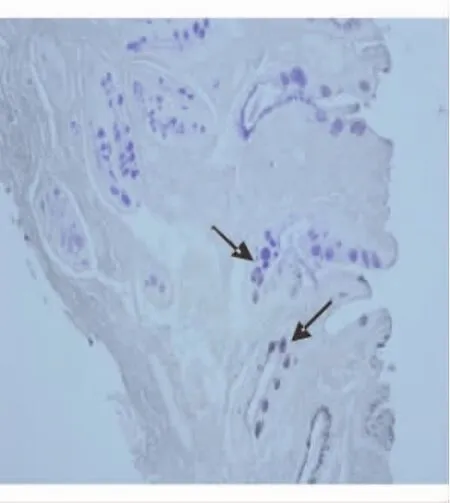
图1 完全结肠型肠化生(HID-AB染色,×200)

图2 完全小肠型肠化生(HID-AB染色,×200)

图3 CDX2在肠化生细胞中的表达(免疫组化EnVision二步法,×400)
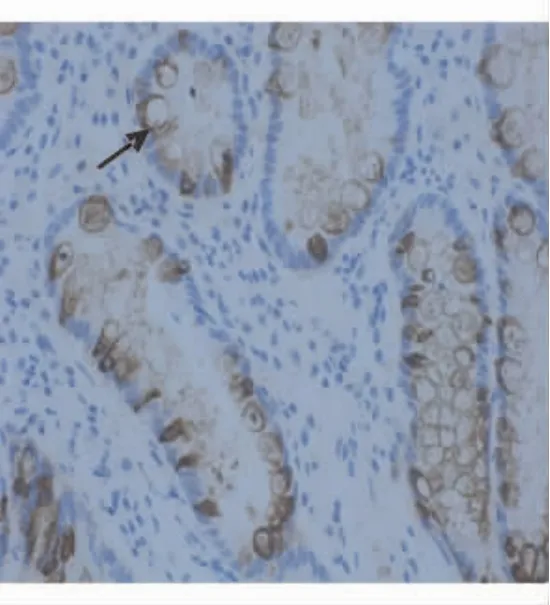
图4 MUC2在肠化生细胞中的表达(免疫组化EnVision二步法,×400)
尽管胃黏膜癌变的机制尚未完全阐明,但现有研究认为胃癌,尤其是肠型胃癌的发生与Hp感染有关,Hp感染可引起慢性胃炎,经过多个步骤的癌前病变(肠化生、异型增生)进展至胃癌[5]。除Hp感染外,胃内胆汁反流亦可促成胃黏膜肠化生和癌变[3]。本研究中有胆汁反流的CAG组肠化生发生率为100%,而CNAG组肠化生发生率仅为10.8%,前者胃液TBA浓度显著高于后者,证实胆汁酸在胃黏膜肠化生的形成过程中起重要作用。胆汁反流组Hp感染率略低于无胆汁反流的对照组(56.8%对65.0%),但差异无统计学意义,可能与胆汁反流可抑制Hp在胃黏膜中的定植有关[6]。
CDX2基因编码的肠特异性转录因子参与正常肠上皮细胞的生长、分化和表型维持,正常胃黏膜上皮中检测不到CDX2表达,一旦检出CDX2,则意味着肠化生的发生[2]。MUC2基因产物是一种分泌型肠型大分子黏蛋白,广泛表达于杯状细胞中,胃癌及其癌前病变如肠化生黏膜中可检出异位表达的 MUC2[7]。Babu 等[8]研究了 Hp 感染胃癌前病变患者的胃黏膜黏蛋白表达谱,发现肠化生黏膜中胃型黏蛋白MUC5AC、MUC6表达明显下调(>50%),并出现肠型黏蛋白MUC2表达(>75%),表达形式为杯状细胞胞质弥漫表达,表明MUC2表达可作为胃黏膜肠化生的可靠指标。本研究中有胆汁反流的CAG组肠化生发生率明显高于CNAG组,胃黏膜CDX2、MUC2蛋白阳性表达率亦显著高于 CNAG组,证实CDX2和MUC2可作为胃黏膜肠化生的分子标记物。
尽管目前许多研究结果支持Hp感染是引起胃黏膜肠化生的重要因素之一[2],但 Satoh等[9]的研究却发现,15例Hp感染胃肠化生患者接受Hp根除治疗,其中13例Hp根除后12个月肠化生并未消退,CDX2表达亦未消失,表明Hp感染并非引起胃黏膜肠化生的惟一因素。本研究发现在有胆汁反流的患者中,胃黏膜CDX2、MUC2蛋白阳性表达率随胃液TBA浓度的逐级增高呈上升趋势,TBA>3000 μmol/L者两种蛋白阳性表达率均高达91.2%,明显高于TBA浓度为0~500、501~1000和1001~3000 μmol/L者,证实高浓度胆汁酸亦为引起胃黏膜肠化生和CDX2、MUC2表达的重要因素。胆汁反流组Hp感染阳性者的CDX2、MUC2蛋白阳性表达率虽然显著高于Hp感染阴性者(63.0%对31.4%和60.9%对37.1%),但显著低于TBA>3000 μmol/L者的相应阳性表达率,表明在有胆汁反流的患者中,高浓度胆汁酸(TBA>3000 μmol/L)是较Hp感染更主要的致肠化生因素。
本研究采用AB-PAS、HID-AB染色对44例有胆汁反流的CAG患者进行肠化生分型,结果显示40.9%为完全结肠型,59.1%为完全小肠型。关于肠化生分型与胃癌的关系目前仍有争议。多数学者认为肠化生是胃癌前病变,尤其是不完全型肠化生与肠型胃癌关系密切[1],但 Petersson 等[10]发现正常人群的胃黏膜肠化生检出率高达23%,不完全型肠化生检出率亦达4%,Conchillo等[11]发现尽管不完全型肠化生仅见于肠型胃癌,但其检出率仅为26.3%,提示这一改变并非胃癌发生所必须,肠化生作为癌前病变在胃癌发生中的作用可能被高估。Cassaro等[12]认为在胃癌高危人群中,肠化生的分布范围同样能提示癌变风险。本研究中有胆汁反流的CAG患者无一例存在不完全型肠化生,因此从肠化生分型的角度不能说明高浓度胆汁酸有致胃黏膜癌变的可能性。
综上所述,本研究结果表明高浓度胆汁酸是Hp感染之外另一个引起胃黏膜肠化生和CDX2、MUC2表达的重要因素且其作用可能大于Hp感染,有效治疗胃内胆汁反流和Hp感染可能预防肠型胃癌的发生。由于条件限制,本研究未能采用快速尿素酶试验等其他Hp感染检测方法,仅以血清Hp IgG抗体阳性作为科研诊断Hp感染的标准不够严谨,本研究亦未能进一步探讨胃内胆汁反流与Hp感染在诱导胃黏膜肠化生中是否具有协同作用,上述局限有待后续研究加以完善。
1 Leung WK,Sung JJ.Review article:intestinal metaplasia and gastric carcinogenesis[J].Aliment Pharmacol Ther,2002,16(7):1209-1216.
2 Stairs DB,Kong J,Lynch JP.Cdx genes,inflammation,and the pathogenesis of intestinal metaplasia[J].Prog Mol Biol Transl Sci,2010,96:231-270.
3 Xu Y,Watanabe T,Tanigawa T,et al.Bile acids induce cdx2 expression through the farnesoid x receptor in gastric epithelial cells[J].J Clin Biochem Nutr,2010,46(1):81-86.
4 中华医学会消化病学分会.中国慢性胃炎共识意见[J].胃肠病学,2006,11(11):674-684.
5 Correa P,Piazuelo MB.Helicobacter pylori infection and gastric adenocarcinoma[J].US Gastroenterol Hepatol Rev,2011,7(1):59-64.
6 Lynch DA,Mapstone NP,Clarke AM,et al.Cell proliferation in the gastric corpus in Helicobacter pylori associated gastritis and after gastric resection[J].Gut,1995,36(3):351-353.
7 de Bolos C,Real FX,Lopez-Ferrer A.Regulation of mucin and glycoconjugate expression:from normal epithelium to gastric tumors[J].Front Biosci,2001,6:D1256-D1263.
8 Babu SD,Jayanthi V,Devaraj N,et al.Expression profile of mucins(MUC2,MUC5AC and MUC6)in Helicobacter pylori infected pre-neoplastic and neoplastic human gastric epithelium[J].Mol Cancer,2006,5:10.
9 Satoh K,Mutoh H,Eda A,et al.Aberrant expression of CDX2 in the gastric mucosa with and without intestinal metaplasia:effect of eradication of Helicobacter pylori[J].Helicobacter,2002,7(3):192-198.
10 Petersson F,Borch K,Franzén LE.Prevalence of subtypes of intestinal metaplasia in the general population and in patients with autoimmune chronic atrophic gastritis[J].Scand J Gastroenterol,2002,37(3):262-266.
11 Conchillo JM,Houben G,de Bruïne A,et al.Is typeⅢintestinal metaplasia an obligatory precancerous lesion in intestinal-type gastric carcinoma[J]?Eur J Cancer Prev,2001,10(4):307-312.
12 Cassaro M,Rugge M,Gutierrez O,et al.Topographic patterns of intestinal metaplasia and gastric cancer[J].Am J Gastroenterol,2000,95(6):1431-1438.

