中国急性胰腺炎诊治指南(2013,上海)
中华医学会消化病学分会胰腺疾病学组 《中华胰腺病杂志》编辑委员会 《中华消化杂志》编辑委员会
·指南与共识·
中国急性胰腺炎诊治指南(2013,上海)
中华医学会消化病学分会胰腺疾病学组 《中华胰腺病杂志》编辑委员会 《中华消化杂志》编辑委员会
急性胰腺炎的发病率逐年升高,病死率仍居高不下。中华医学会消化病学分会曾于2003年颁布了《中国急性胰腺炎诊治指南(草案)》[1],对提高我国急性胰腺炎的救治水平起到重要作用。近10年来,随着对急性胰腺炎诊断和分类标准的更新,以及国内外对该病的临床诊治研究的不断深入,有必要修订新的急性胰腺炎的指南,以进一步规范我国该疾病的临床诊治。
急性胰腺炎(acute pancreatitis, AP)是指多种病因引起的胰酶激活,继以胰腺局部炎症反应为主要特征,伴或不伴有其他器官功能改变的疾病。临床上,大多数患者的病程呈自限性,20%~30%患者临床经过凶险,总体病死率为5%~10%。
一、术语和定义
根据国际AP专题研讨会最新修订的AP分级和分类系统(2012年,美国亚特兰大)[2],结合我国具体情况,规定有关AP术语和定义,旨在对临床和科研工作起指导作用,并规范该领域学术用词。
(一)临床术语
1.轻度AP(mild acute pancreatitis,MAP):具备AP的临床表现和生物化学改变,不伴有器官功能衰竭及局部或全身并发症,通常在1~2周内恢复,病死率极低。
2.中度AP(moderately severe acute pancreatitis,MSAP):具备AP的临床表现和生物化学改变,伴有一过性的器官功能衰竭(48 h内可自行恢复),或伴有局部或全身并发症而不存在持续性的器官功能衰竭(48 h内不能自行恢复)。对于有重症倾向的AP患者,要定期监测各项生命体征并持续评估[2]。
3.重度AP(severe acute pancreatitis,SAP):具备AP的临床表现和生物化学改变,须伴有持续的器官功能衰竭(持续48 h以上、不能自行恢复的呼吸系统、心血管或肾脏功能衰竭,可累及一个或多个脏器)。SAP病死率较高,为36%~50%,如后期合并感染则病死率更高[3]。
4.建议:①MSAP由2003年版《中国急性胰腺炎诊治指南(草案)》[1]中定义的“SAP”中划分出来,符合原“SAP”的条件,但不伴有持续的器官功能衰竭。②不建议使用“暴发性胰腺炎(fulninant acute pancreatitis, FAP)”,因该术语提及的起病时间“72 h之内”不能反映预后,并且其诊断标准之一的全身炎症反应综合征(systenic inflammatory response syndrome, SIRS)也只是部分AP的临床表现,不能反映病情的严重度。
(二)影像学术语[2]
1.间质水肿性胰腺炎(interstitial edematous pancreatitis):大多数AP患者由于炎性水肿引起弥漫性胰腺肿大,偶有局限性肿大。CT表现为胰腺实质均匀强化,但胰周脂肪间隙模糊,也可伴有胰周积液。
2.坏死性胰腺炎(necrotizing pancreatitis):5%~10%的AP患者伴有胰腺实质坏死或胰周组织坏死,或二者兼有。早期增强CT有可能低估胰腺及胰周坏死的程度,起病1周之后的增强CT更有价值,胰腺实质坏死表现为无增强区域。
(三)其他术语[2,4]
1.急性胰周液体积聚(acute peripancreatic fluid collection,APFC):发生于病程早期,表现为胰腺内、胰周或胰腺远隔间隙液体积聚,并缺乏完整包膜,可以单发或多发。
2.急性坏死物积聚(acute necrotic collection,ANC):发生于病程早期,表现为液体内容物包含混合的液体和坏死组织,坏死物包括胰腺实质或胰周组织的坏死。
3.胰腺假性囊肿(pancreatic pseudocyst):有完整非上皮性包膜包裹的液体积聚,内含胰腺分泌物、肉芽组织、纤维组织等,多发生于AP起病4周后。
4.包裹性坏死(walled-off necrosis,WON):是一种成熟的、包含胰腺和(或)胰周坏死组织、具有界限分明炎性包膜的囊实性结构,多发生于AP起病4周后。
5.胰腺脓肿(infected necrosis):胰腺内或胰周的脓液积聚,外周为纤维囊壁,增强CT提示气泡征,细针穿刺物细菌或真菌培养阳性。
二、AP病因
在确诊AP基础上,应尽可能明确其病因,并努力去除病因,以防复发。
1.常见病因:胆石症(包括胆道微结石),高三酰甘油血症,酒精。胆源性胰腺炎仍是我国AP的主要病因[5],高三酰甘油血症性胰腺炎的发病率呈上升态势。当三酰甘油≥11.3 mmol/L,临床极易发生AP;而当三酰甘油<5.65 mmol/L时,发生AP的危险性减少[6]。
2.其他病因:壶腹乳头括约肌功能不良(sphincter of Oddi dysfunction, SOD),药物和毒物,外伤性,高钙血症,血管炎,先天性(胰腺分裂、环形胰腺、十二指肠乳头旁憩室等),肿瘤性(壶腹周围癌、胰腺癌),感染性(柯萨奇病毒、腮腺炎病毒、获得性免疫缺陷病毒、蛔虫症),自身免疫性(系统性红斑狼疮、干燥综合征),α1-抗胰蛋白酶缺乏症等。近年来,内镜下逆行性胰胆管造影术(endoscopic retrograde cholangio pancreatography, ERCP)后、腹部手术后等医源性因素诱发的AP的发病率也呈上升趋势。
3.经临床与影像、生物化学等检查,不能确定病因者称为特发性。
三、AP病因调查
1.详细询问病史:包括家族史、既往病史、酒精摄入史、药物服用史等。计算体重指数。
2.基本检查:包括体格检查,血清淀粉酶、血清脂肪酶、肝功能、血脂、血糖及血钙测定,腹部超声检查。
3.进一步检查:病毒、自身免疫标志物、肿瘤标记物(CEA、CA19-9)测定;增强CT扫描、ERCP或核磁共振胰胆管成像术、内镜超声检查、壶腹乳头括约肌测压(必要时)、胰腺外分泌功能检测等。
四、AP诊断流程
(一)AP临床表现
腹痛是AP的主要症状,位于上腹部,常向背部放射,多为急性发作,呈持续性,少数无腹痛,可伴有恶心、呕吐。发热常源于SIRS、坏死胰腺组织继发细菌或真菌感染。发热、黄疸者多见于胆源性胰腺炎。临床体征方面,轻症者仅表现为轻压痛,重症者可出现腹膜刺激征、腹水、Grey-Turner征、Cullen征。少数患者因脾静脉栓塞出现门静脉高压,脾脏肿大。罕见横结肠坏死。腹部因液体积聚或假性囊肿形成可触及肿块。其他可有相应并发症所具有的体征。
局部并发症包括急性液体积聚、急性坏死物积聚、胰腺假性囊肿、包裹性坏死和胰腺脓肿,其他局部并发症还包括胸腔积液、胃流出道梗阻、消化道瘘、腹腔出血、假性囊肿出血、脾静脉或门静脉血栓形成、坏死性结肠炎等。局部并发症并非判断AP严重程度的依据[2]。
全身并发症主要包括器官功能衰竭、SIRS、全身感染、腹腔内高压(intra-abdominal hypertension, IAH)或腹腔间隔室综合征(abdominal compartment syndrome, ACS)、胰性脑病(pancreatic encephalo-pathy, PE)。
1.器官功能衰竭:AP的严重程度主要取决于器官功能衰竭的出现及持续时间(是否超过48 h),出现2个以上器官功能衰竭称为多脏器功能衰竭(multiple organ failure, MOF)。呼吸衰竭主要包括急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),循环衰竭主要包括心动过速、低血压或休克,肾功能衰竭主要包括少尿、无尿和血清肌酐升高[2]。
2.SIRS:符合以下临床表现中的2项及以上,可以诊断为SIRS。①心率>90次/min;②体温<36℃或>38℃;③WBC <4×109/L或>12×109/L;④呼吸频率>20次/min或PCO2<32 mm Hg(1 mm Hg=0.133 kPa)。SIRS持续存在将会增加器官功能衰竭发生的风险。
3.全身感染:SAP患者若合并脓毒症(sepsis),病死率升高,为50%~80%。主要以革兰阴性杆菌感染为主,也可有真菌感染。
4.IAH和ACS:SAP时IAH和ACS的发生率分别约为40%和10%,IAH已作为判定SAP预后的重要指标之一,容易导致多器官功能不全综合征(multiple organ dysfunction syndrome,MODS)[7]。膀胱压(urinary bladder pressure, UBP)测定是诊断ACS的重要指标,UBP≥20 mm Hg,伴有少尿、无尿、呼吸困难、吸气压增高、血压降低时应考虑出现ACS[8]。
5.PE:是AP的严重并发症之一,可表现为耳鸣、复视、谵妄、语言障碍及肢体僵硬、昏迷等,多发生于AP早期,但具体机制不明。
(二)辅助检查
1.血清酶学检查:强调血清淀粉酶测定的临床意义,尿淀粉酶变化仅作参考。血清淀粉酶活性高低与病情严重程度不呈相关性。患者是否开放饮食或病情程度的判断不能单纯依赖于血清淀粉酶是否降至正常,应综合判断。血清淀粉酶持续增高要注意病情反复、并发假性囊肿或脓肿、疑有结石或肿瘤、肾功能不全、高淀粉酶血症等。要注意鉴别其他急腹症引起的血清淀粉酶增高。血清脂肪酶活性测定具有重要临床意义,尤其当血清淀粉酶活性已经下降至正常,或其他原因引起血清淀粉酶活性增高时,血清脂肪酶活性测定有互补作用。同样,血清脂肪酶活性与疾病严重程度不呈正相关。
2.血清标志物:推荐使用CRP,发病72 h后CRP>150 mg/L提示胰腺组织坏死。动态测定血清IL-6水平增高提示预后不良。血清淀粉样蛋白升高对AP诊断也有一定价值。
3.影像学诊断:在发病初期24~48 h行超声检查,可以初步判断胰腺组织形态学变化,同时有助于判断有无胆道疾病,但受AP时胃肠道积气的影响,对AP不能做出准确判断。推荐CT扫描作为诊断AP的标准影像学方法,且发病1周左右的增强CT诊断价值更高,可有效区分液体积聚和坏死的范围。在SAP的病程中,应强调密切随访CT检查,建议按病情需要,平均每周1次。按照改良的CT严重指数(modified CT severity index,MCTSI)[9],胰腺炎性反应分级为正常胰腺(0分),胰腺和(或)胰周炎性改变(2分),单发或多个积液区或胰周脂肪坏死(4分);胰腺坏死分级为无胰腺坏死(0分),坏死范围≤30%(2分),坏死范围>30%(4分);胰腺外并发症,包括胸腔积液、腹水、血管或胃肠道等(2分)。评分≥4分可诊断为MSAP或SAP。此外,MRI也可以辅助诊断AP。
(三)AP的诊断体系
1.AP的诊断标准:临床上符合以下3项特征中的2项,即可诊断为AP。①与AP符合的腹痛(急性、突发、持续、剧烈的上腹部疼痛,常向背部放射);②血清淀粉酶和(或)脂肪酶活性至少高于正常上限值3倍;③增强CT/MRI或腹部超声呈AP影像学改变。
2.AP的分级诊断:①MAP:符合AP诊断标准。满足以下情况之一,无脏器衰竭、无局部或全身并发症,Ranson评分<3分,APACHEⅡ评分<8分,BISAP评分<3分,MCTSI评分<4分。②MSAP:符合AP诊断标准。急性期满足下列情况之一,Ranson评分≥3分,APACHEⅡ评分≥8分,BISAP评分≥3分,MCTSI评分≥4分,可有一过性(<48 h)的脏器功能障碍。恢复期出现需要干预的假性囊肿、胰瘘或胰周脓肿等。③SAP:符合AP诊断标准。伴有持续性(>48 h)脏器功能障碍(单器官或多器官),改良Marshall评分≥2分(表1)[2]。
3.建议:①临床上完整的AP诊断应包括疾病诊断、病因诊断、分级诊断、并发症诊断,例如AP(胆源性、重度、ARDS)。②临床上应注意一部分AP患者从MAP转化为SAP可能,因此必须对病情作动态观察。除 Ranson评分、APACHEⅡ评分外,其他有价值的判别指标如BMI>28 kg/m2、胸膜渗出(尤其是双侧胸腔积液)、72 h后CRP>150mg/L并持续增高等均为临床上有价值的严重度评估指标。
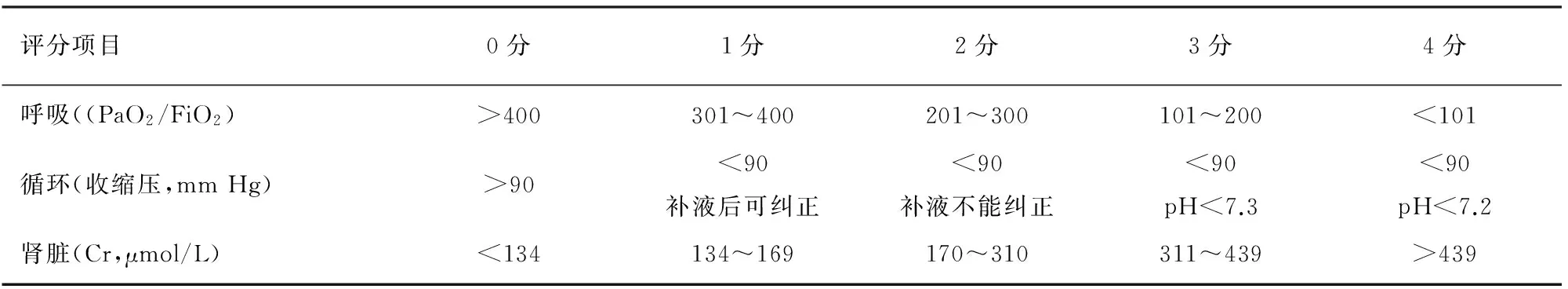
表1 判断重度急性胰腺炎伴有器官功能衰竭的改良Marshall评分系统
注:FiO2为吸入气氧浓度,按照空气(21%)及纯氧2 L/min(25%)、4 L/min(30%)、6~8 L/min(40%)、9~10 L/min(50%)换算;1 mm Hg=0.133 kPa
(四)AP诊断流程图
AP诊断流程见图1。
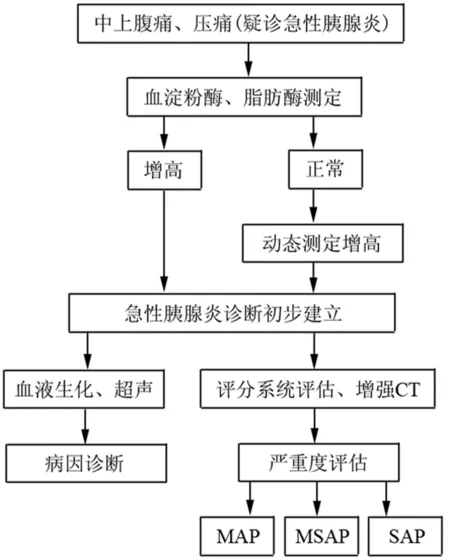
图1 急性胰腺炎诊断流程图
五、AP处理原则(图2)
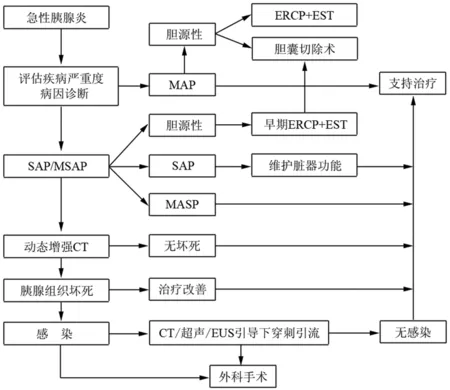
图2 急性胰腺炎临床处理流程
1.发病初期的处理:目的是纠正水、电解质紊乱,支持治疗,防止局部及全身并发症。观察内容包括:血、尿、凝血常规测定;粪便隐血、肾功能、肝功能测定;血糖、血钙测定;心电监护;血压监测;血气分析;血清电解质测定;胸部X线摄片;中心静脉压测定。动态观察腹部体征和肠鸣音改变。记录24 h尿量和出入量变化。上述指标可根据患者具体病情做相应选择。根据APACHEⅡ评分、Ranson评分、BISAP评分、CT Balthazar分级等指标判断AP的严重程度和预后。SAP病情危重时,建议入重症监护病房密切监测生命体征,调整输液速度和液体成分。常规禁食,对有严重腹胀、麻痹性肠梗阻者应采取胃肠减压等相应措施。在患者腹痛减轻或消失、腹胀减轻或消失、肠道动力恢复或部分恢复时可以考虑开放饮食,开始以糖类为主,逐步过渡至低脂饮食,不以血清淀粉酶活性高低作为开放饮食的必要条件。
2.脏器功能的维护:①早期液体复苏。一经诊断应立即开始进行控制性液体复苏[10],主要分为快速扩容和调整体内液体分布2个阶段,必要时使用血管活性药物。补液量包括基础需要量和流入组织间隙的液体量。输液种类包括胶体物质、0.9% NaCl溶液和平衡液。扩容时应注意晶体与胶体的比例,并及时补充微量元素和维生素。②针对急性肺损伤或呼吸衰竭的治疗。SAP发生急性肺损伤时给予鼻导管或面罩吸氧,维持氧饱和度在95%以上,要动态监测患者血气分析结果。当进展至ARDS时,处理包括机械通气和大剂量、短程糖皮质激素的应用,有条件时行气管镜下肺泡灌洗术。③针对急性肾损伤或肾功能衰竭的治疗。治疗急性肾功能衰竭主要是支持治疗,稳定血流动力学参数,必要时透析。持续性肾脏替代疗法(continuous renal replacement therapy,CRRT)的指征是:伴急性肾功能衰竭,或尿量≤0.5 ml·kg-1·h-1;早期伴2个或2个以上器官功能障碍;SIRS伴心动过速、呼吸急促,经一般处理效果不明显;伴严重水、电解质紊乱;伴胰性脑病。可联合持续性静脉-静脉血液滤过(continuous venous-venous hemofiltration,CVVH)和持续性血浆滤过吸附(continuous plasma filtration adsorption, CPFA)两种模式[11]。④其他脏器功能的支持。出现肝功能异常时可予以保肝药物,弥散性血管内凝血(DIC)时可使用肝素,上消化道出血可应用质子泵抑制剂。对于SAP患者还应特别注意维护肠道功能,因肠黏膜屏障的稳定对于减少全身并发症有重要作用,需要密切观察腹部体征及排便情况,监测肠鸣音的变化,及早给予促肠道动力药物,包括生大黄、芒硝、硫酸镁、乳果糖等,应用谷氨酰胺制剂保护肠道黏膜屏障。同时可应用中药,如皮硝外敷。病情允许情况下,尽早恢复饮食或实施肠内营养对预防肠道功能衰竭具有重要意义。
3.抑制胰腺外分泌和胰酶抑制剂应用:生长抑素及其类似物(奥曲肽)可以通过直接抑制胰腺外分泌而发挥作用,对于预防ERCP术后胰腺炎也有积极作用。H2受体拮抗剂或质子泵抑制剂可通过抑制胃酸分泌而间接抑制胰腺分泌,还可以预防应激性溃疡的发生。蛋白酶抑制剂(乌司他丁、加贝酯)能够广泛抑制与AP发展有关胰蛋白酶、弹性蛋白酶、磷脂酶A 等的释放和活性,还可稳定溶酶体膜,改善胰腺微循环,减少AP并发症,主张早期足量应用。
4.营养支持:MAP患者只需短期禁食,故不需肠内或肠外营养。MSAP或SAP患者常先施行肠外营养,待患者胃肠动力能够耐受,及早(发病48 h内)实施肠内营养[12]。肠内营养的最常用途径是内镜引导或X线引导下放置鼻空肠管。输注能量密度为4.187 J/ml的要素营养物质,如能量不足,可辅以肠外营养,并观察患者的反应,如能耐受,则逐渐加大剂量。应注意补充谷氨酰胺制剂。对于高脂血症患者,应减少脂肪类物质的补充。进行肠内营养时,应注意患者的腹痛、肠麻痹、腹部压痛等胰腺炎症状和体征是否加重,并定期复查电解质、血脂、血糖、总胆红素、血清白蛋白、血常规及肾功能等以评价机体代谢状况,调整肠内营养的剂量。可先采用短肽类制剂,再逐渐过渡到整蛋白类制剂,要根据患者血脂、血糖的情况进行肠内营养剂型的选择。
5.抗生素应用:业已证实,预防性应用抗生素不能显著降低病死率[13-14],因此,对于非胆源性AP不推荐预防性使用抗生素。对于胆源性MAP或伴有感染的MSAP和SAP应常规使用抗生素。胰腺感染的致病菌主要为革兰阴性菌和厌氧菌等肠道常驻菌。抗生素的应用应遵循“降阶梯”策略,选择抗菌谱为针对革兰阴性菌和厌氧菌为主、脂溶性强、可有效通过血胰屏障的药物。推荐的方案:①碳青霉烯类;②青霉素+β-内酰胺酶抑制剂;③第三代头孢菌素+抗厌氧菌;④喹诺酮+抗厌氧菌。疗程为7~14 d,特殊情况下可延长应用时间。要注意真菌感染的诊断,临床上无法用细菌感染来解释发热等表现时,应考虑到真菌感染的可能,可经验性应用抗真菌药,同时进行血液或体液真菌培养。
6.胆源性胰腺炎的内镜治疗:推荐在有条件的单位,对于怀疑或已经证实的AP患者(胆源型),如果符合重症指标,和(或)有胆管炎、黄疸、胆总管扩张,或最初判断是MAP、但在治疗中病情恶化者,应行鼻胆管引流或内镜下十二指肠乳头括约肌切开术(endoscopic sphincterotomy, EST)。胆源性SAP发病的48~72 h内为行ERCP最佳时机,而胆源性MAP于住院期间均可行ERCP治疗。在胆源性AP恢复后应该尽早行胆囊切除术,以防再次发生AP[15]。
7.局部并发症的处理:大多数APFC和ANC可在发病后数周内自行消失,无需干预,仅在合并感染时才有穿刺引流的指征[16]。无菌的假性囊肿及WON大多数可自行吸收,少数直径>6 cm且有压迫现象等临床表现,或持续观察直径增大,或出现感染症状时可予以微创引流治疗。胰周脓肿和(或)感染首选穿刺引流,引流效果差则进一步行外科手术,外科手术为相对适应证[17-18]。建议有条件的单位开展内镜下穿刺引流术或内镜下坏死组织清除术。
8.全身并发症的处理:发生SIRS时应早期应用乌司他丁或糖皮质激素。CRRT能很好地清除血液中的炎症介质,同时调节体液、电解质平衡,因而推荐早期用于AP并发的SIRS,并有逐渐取代腹腔灌洗治疗的趋势。菌血症或脓毒症者应根据药敏结果调整抗生素,要由广谱抗生素过渡使用至窄谱抗生素,要足量足疗程使用。SAP合并腹腔间隔室综合征者应采取积极的救治措施,除合理的液体治疗、抗炎药物的使用之外,还可使用血液滤过、微创减压及开腹减压术等。
9.中医中药:单味中药(如生大黄、芒硝),复方制剂(如清胰汤、柴芍承气汤等)被临床实践证明有效。中药制剂通过降低血管通透性、抑制巨噬细胞和中性粒细胞活化、清除内毒素达到治疗功效。
10.手术治疗:在AP早期阶段,除因严重的腹腔间隔室综合征,均不建议外科手术治疗[19-20]。在AP后期阶段,若合并胰腺脓肿和(或)感染,应考虑手术治疗。
11.其他措施:疼痛剧烈时考虑镇痛治疗。在严密观察病情下可注射盐酸哌替啶(杜冷丁)。不推荐应用吗啡或胆碱能受体拮抗剂,如阿托品、氢溴酸东莨菪碱(654-2)等,因前者会收缩奥狄括约肌,后者则会诱发或加重肠麻痹。免疫增强制剂和血管活性物质如前列腺素E1制剂、血小板活化因子拮抗剂等,可考虑在SAP中选择性应用。益生菌可调节肠道免疫和纠正肠道内菌群失调,从而重建肠道微生态平衡,但目前对SAP患者是否应该使用益生菌治疗尚存争议。
(王兴鹏 李兆申 袁耀宗 杜奕奇 曾悦整理)
参加本指南修订的专家(按姓氏汉语拼音排序)
陈旻湖(中山大学附属第一医院)
陈其奎(中山大学附属第二医院)
陈卫昌(苏州大学附属第一医院)
杜奕奇(第二军医大学长海医院)
郭晓钟(沈阳军区总医院)
郭学刚(第四军医大学西京医院)
郝建宇(北京朝阳医院)
冀 明(北京友谊医院)
贾 林(广州市第一人民医院)
金 钢(第二军医大学长海医院)
黎介寿(南京军区总医院)
李晓燕(昆明医科大学第一附属医院)
李维勤(南京军区总医院)
李延青(山东大学齐鲁医院)
李兆申(第二军医大学长海医院)
廖 专(第二军医大学长海医院)
刘 俊(武汉华中科技大学同济医学院附属协
和医院)
楼文晖(复旦大学中山医院)
吕农华(南昌大学第一附属医院)
钱家鸣(北京协和医院)
邵成伟(第二军医大学长海医院)
唐承薇(华西医大医院)
陶小红(重庆医科大学附属第一医院)
田字彬(青岛大学医学院附属医院)
屠振兴(第二军医大学长海医院)
王兴鹏(上海交通大学附属第一人民医院)
谢渭芬(第二军医大学长征医院)
许建明(安徽医科大学第一附属医院)
徐 萍(上海松江中心医院)
袁耀宗(上海交通大学附属瑞金医院)
湛先保(第二军医大学长海医院)
曾 悦(上海交通大学附属第一人民医院)
张圣道(上海交通大学附属瑞金医院)
张澍田(首都医科大学附属北京友谊医院)
赵晓晏(第三军医大学新桥医院)
邹晓平(南京大学医学院附属鼓楼医院)
[1] 王兴鹏,许国铭,袁耀宗,等. 中国急性胰腺炎诊治指南(草案). 中华消化杂志,2004, 24: 190-192.
[2] Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis-2012: revision of the Atlanta classification and definitions by international consensus. Gut, 2013, 62:102-111.
[3] Vege SS, Gardner TB, Chari ST, et al. Low mortality and high morbidity in severe acute pancreatitis without organ failure: a case for revising the Atlanta classification to inculde "moderately severe acute pancreatitis". Am J Gastroenterol, 2009, 104: 710-715.
[4] Zaheer A, Singh VK, Qureshi RO, et al. The revised Atlanta classification for acute pancreatitis: updates in imaging terminology and guidelines. Abdom Imaging, 2013, 38: 125-136.
[5] Bat Y, Liu Y, Jia L, et al. Severe acute pancreatitis in China: etiology and mortality in 1976 patients. Pancreas, 2007, 35: 232-237.
[6] Oh RC, Lanier JB. Management of hypertriglyceridemia. Am Fam Physician, 2007, 75: 1365-1371.
[7] Ke L, Ni HB, Tong ZH, et al. Intra-abdominal pressure and abdominal perfusion pressure: which is a better marker of severity in patients with severe acute pancreatitis. J Gastrointest Surg, 2011, 15: 1426-1432.
[8] 中华外科学会胰腺外科学组. 重症急性胰腺炎诊治指南. 中华外科杂志,2007, 45: 727-729.
[9] Bollen TL, Singh VK, Maurer R, et al. Comparative evaluation of the modified CT severity index in assessing severity of acute pancreatitis. Am J Roentgenol, 2011, 197: 386-392.
[10] Fisher JM, Gardner TB. The "Golden Hours" of management in acute pancreatitis. Am J Gastroenterol, 2012, 107: 1146-1150.
[11] He C, Zhang L, Shi W, et al. Coupled plasma filtration adsorption combined with continuous veno-venous hemofiltration treatment in patients with severe acute pancreatitis. J Clin Gastroenterol, 2013, 47: 62-68.
[12] Mirtallo JM, Forbes A, McClave SA, et al. International consensus guidelines for nutrition therapy in pancreatitis. J Parenter Enteral Nutr, 2012, 36: 284-291.
[13] Besselink MG, van Santvoort HC, Buskens E, et al. Probiotic prophylaxis in predicted severe acute pancreatitis: a randomised, double-blind, placebo-controlled trial. Lancet, 2008, 371: 651-659.
[14] Villatoro E, Mulla M, Larvin M. Antibiotic therapy for prophylaxis against infection of pancreatic necrosis in acute pancreatitis. Cochrane Database Syst Rev, 2010, 12: CD002941.
[15] van Baal MC, Besselink MG, Bakker OJ, et al. Timing of cholecystectomy after mild biliary pancreatitis: a systematic review. Ann Surg, 2012, 255: 860-866.
[16] 许建明, 周晓兰. 急性胰腺炎临床和形态学分类标准的新认识. 中华消化杂志, 2012, 32: 577-579.
[17] 杜奕奇,湛先保,谢沛,等. 以内科综合治疗为特色的重症急性胰腺炎1064例次临床总结. 中华胰腺病杂志,2012, 12: 363-367.
[18] 李维勤, 童智慧, 全竹富,等. 1033例重症急性胰腺炎治疗经验总结. 中华外科杂志, 2009, 47: 1472-1474.
[19] Babu RY, Gupta R, Kang M, et al. Predictors of surgery in patients with severe acute pancreatitis managed by the Step-Up approach. Ann Surg, 2013, 257: 737-750.
[20] Freeman ML, Werner J, van Santvoort HC, et al. Interventions for necrotizing pancreatitis: summary of a multidisciplinary consensus confernce. Pancreas, 2012,41: 1176-1194.
2013-01-22)
(本文编辑:吕芳萍)
10.3760/cma.j.issn.1674-1935.2013.02.001
王兴鹏,上海交通大学附属第一人民医院,200080,Email:wangxp1965@yahoo.com.cn;李兆申,第二军医大学长海医院,200433,Email:zhsli@81890.net;袁耀宗,上海交通大学附属瑞金医院,200025,Email:yyz28@medmail.com.cn

