正极材料钴酸锂表面固体电解质相界面膜的研究*
王 坤,张 玥,任春燕,刘大凡,赵 洪,安 峰,张晓行
(中海油天津化工研究设计院,天津 300131)
对锂离子电池SEI膜的研究最初主要集中在负极方面,对于正极表面SEI膜的研究直到近年才得到重视。经研究发现:正极活性物质表面被一层表面膜所包覆,这层膜与电极和电解液的相互作用有关,它对电极的阻抗和动力学特性有很大影响。目前普遍认为,在锂离子电池首次充放电过程中,电极材料与电解液在固液相界面上发生反应,形成一层覆盖于电极材料表面的钝化层。这种钝化层是一种界面层,具有固体电解质的特征,是电子绝缘体,同时也是Li+的优良导体,因此这层钝化膜被称为固体电解质相界面膜,简称 SEI膜[1-4]。SEI膜是锂离子电池中锂离子进入材料内部的通道,锂离子在SEI膜中的传输性能将影响到电池充放电特性,从而对电池的倍率性能产生影响。LiCoO2作为目前广泛应用的锂离子电池正极材料,具有电压高、放电平稳、比能量高、电化学性能稳定等优点。笔者采用循环伏安方法和交流阻抗方法对正极材料LiCoO2表面的SEI膜进行初步研究。
1 实验部分
1.1 电池装配
按质量比将90%LiCoO2(中海油天津化工研究设计院)、5%聚偏二氟乙烯(PVDF)黏合剂(日本吴羽)和5%乙炔黑(上海昊华)制成电极浆料,然后把浆料均匀涂覆在铝片上,将涂好的铝片放入干燥箱烘干,得到正极极片。以金属锂片作为负极,Celgard 2400聚丙烯复合膜为隔膜,1 mol/L LiPF6/碳酸乙烯酯(EC)+碳酸二甲酯(DMC)(EC 与 DMC 的体积比为1︰1)为基础电解液(天津市金牛电池材料有限公司),在手套箱中[φ(H2O)<1×10-6,φ(O2)<1×10-6]组装成CR2025扣式电池。
1.2 电化学性能测试
EIS测试和循环伏安测试均在PARSTAT 2273型电化学工作站(Advanced Electrochemical System)上进行。循环伏安测试:电压范围为3.0~4.2 V,扫描速率为 0.1 mV/s。EIS 测试:频率范围在 10-2~105Hz,交流信号振幅为5 mV,开始测试前电极在极化电位平衡1 h。
充放电测试在CT2001A型蓝电(LAND)电池测试系统上进行:以恒电流方式充电至4.2 V,静置5 min后以0.1 C恒流放电至2 V为止。
电池化成条件:以0.1 C恒流充电至4.2 V,然后在0.1 C恒流放电至3.0 V,静置10 min后循环充放电3次。
2 结果与讨论
2.1 循环伏安测试
图1为LiCoO2/Li电池循环伏安曲线。由图1可以看出,样品的循环伏安曲线出现了两对氧化还原峰,但在不同的循环次数之间有较大的差异。第1次循环中的氧化峰和还原峰的面积与第2次和第3次循环的氧化峰和还原峰的面积相比明显不相等,有较大的不可逆性,分析其原因可能是在循环过程中Li+参与生成了SEI膜,导致电池的不可逆性增强;另一方面,正极材料、黏合剂以及锂片负极组成的纽扣电池必须要经过活化才能使锂离子的嵌入和脱出通道更加顺畅,从而引起首次循环氧化峰和还原峰电位的滞后。但是,第2次循环与第3次循环相比,氧化峰和氧化峰以及还原峰和还原峰开始趋于合并,不可逆性减小。因此分析电池的SEI膜的形成是在第1次循环过程中形成的。
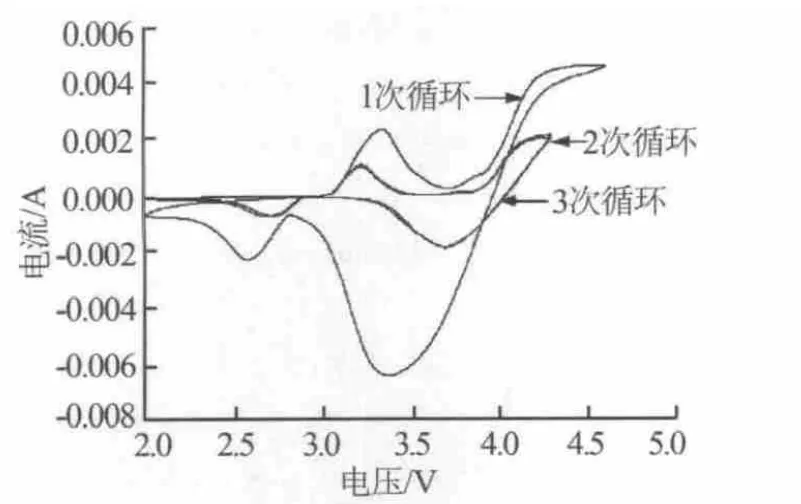
图1 LiCoO2/Li电池循环伏安曲线
2.2 EIS测试
2.2.1 不同充放电倍率条件下阻抗变化
常规电化学阻抗谱图由3部分组成,在高频区和中频区各出现一个半圆,在低频区为一条直线。其中高频区最高频点与横轴的交点为电池本体电阻Rl,其为电解液、隔膜和电极的固有电阻;高频区的半圆反应了电极表面膜的电阻Rsei和膜电容Csei,反应了Li+在表面膜和活性物质表面的迁移。中频区的半圆表示电极反应电荷转移电阻Rct和双层电容Cdl,反映了电荷传递过程及材料的电子电导。低频区的斜线为Warburg阻抗,斜线斜率的大小反映了Li+在电极材料中的扩散速度。
图2为不同充放电倍率条件下电池EIS谱图。由图2看出,在不同充放电倍率条件下其阻抗有着明显变化。在0.5 C循环条件下其阻抗值明显大于0.1 C和0.2 C,0.1 C时其阻抗值小于0.2 C。因此,在电池充放电过程中倍率越小其阻抗越小。分析其原因可能是,在较小的充放电倍率条件下电解液中的Li+与正极材料表面的活性物质接触更加充分,形成的SEI膜会更薄、更致密,并且锂离子的通过性能更好。因此,后续实验采用0.1 C对电池进行测试分析。

图2 不同充放电倍率条件下EIS谱图
2.2.2 不同储存时间对SEI膜的影响
图3为电池不同储存时间对正极材料SEI膜的影响。由图3可以看出,其谱图基本类似,在高频区为电极表面生成的膜电阻和膜电容,但是静置1 d和静置7 d的阻抗相比,静置1 d产生的阻抗要比静置7 d产生的阻抗大得多。分析其原因,可能是由于1 d的静置时间太短,电解液和极片及隔膜没有完全浸润,接触阻抗较大,静置7 d后电池各部分充分浸润,阻抗变小。并且在放置过程中电解液与活性物质表面会形成沉积物,这些沉积物经过不断地溶解再沉积后经过化成而形成SEI膜,形成的SEI膜更加致密,并且有利于锂离子的迁移,因此其SEI膜电阻更小。低频区为Warburg阻抗线。但是,由图3还可以看出,电池经化成后,与静置电池的角度相比,向角度更大的方向偏离了。分析该现象产生的原因,可能是由于锂离子在活性物质晶格中积累和消耗所引起的“嵌入电容”的缘故。

图3 不同放置条件与化成后电池EIS谱图
2.2.3 不同温度条件下的阻抗变化
图4和图5分别为常温和高温条件下充放电循环次数对SEI膜阻抗的影响。由图4、图5看出,在常温和高温条件下,随着充放电次数的增加,其SEI膜电阻会逐渐减小,当循环次数高于3次时,其膜电阻不再有明显变化。但是,在高温条件下其阻抗明显高于常温条件下的阻抗,分析其原因可能是因为,在高温条件下,由于电池所形成的SEI膜稳定性差,同时由于温度的升高膜在自我修复过程中逐渐加厚,造成其阻抗较大。因此,常温条件电池的循环效率较高,而高温条件其循环效率较低。

图4 常温条件下不同循环次数样品EIS谱图
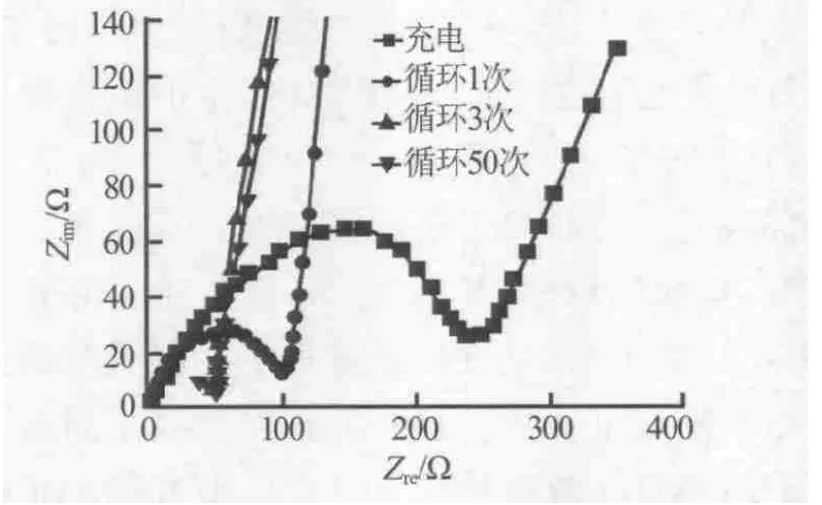
图5 高温条件下(55℃)不同循环次数样品EIS谱图
表1为不同温度条件下电池放电比容量变化。由表1可以看出,在低温下其放电效率更高。分析其原因是因为,在较低温度下形成的SEI膜更加薄并且更加致密,其消耗的Li+量更少,因此其容量更高。这一结果与图4、图5分析结果一致。

表1 不同温度条件下电池放电比容量变化
3 结论
锂离子电池正极材料SEI膜的形成受到多方面的影响:组装的电池需要静置一段时间,其交流阻抗值才会减小;循环过程中常温条件下形成的SEI膜相比高温条件下形成的SEI膜更加稳定。
[1]徐仲榆,郑洪河.锂离子蓄电池碳负极/电解液相容性研究进展:I碳电极界面化学与碳负极/电解液的相容性[J].电源技术,2000,24(3):171-177.
[2]Peled E.The electrochemical behavior of alkali and alkaline earth metals in nonaqueous battery systems-the solid electrolyte interphase model[J].J.Electrochem.Soc.,1979,126(12):2047-2051.
[3]Munichandraiah N,Scanlon L G,Marsh R A.Surface films of lithium:an overview of electrochemical studies[J].J.Power Sources,1998,72(2):203-210.
[4]Aurbach D,Zinigrad E,Cohen Y,et al.A short review of failure mechanisms of lithium metal and lithiated graphite anodes in liquid electrolyte solutions[J].Solid State Ionics,2002,148 (3/4):405-416.

