HSC Chem istry软件在高校化学科研中的应用
王艳坤
(河南教育学院 化学系,河南 郑州 450046)
众所周知,建立在热力学三大定律基础上的化学热力学是人类经验的高度概括和总结,由它们导出的结论和结果的正确性与可靠性,古今中外还未遇到过任何例外.运用热力学原理解决问题,不但结论正确,结果可靠,而且解决问题的过程和方式也十分简洁,因此化学热力学已广泛应用于自然科学的若干学科领域[1].但在实际应用过程中,由于热力学函数计算存在大量非线性问题及计算量繁冗的特点,使得用人工来完成这样的热力学分析过程成为巨大的工程技术难题[2],而HSC Chemistry软件的出现则可较为圆满地解决这一困扰广大化学工作者的问题.
HSC Chemistry是世界上使用最广泛的集成热力学数据库软件,由芬兰奥托昆普(Outokumpu)研究中心开发研制,其最新的7.0版拥有一个超过20 000种无机物详细热力学性质的数据库以及针对不同应用而设计的22个计算模块,其模拟图表可以被编辑,数据可以各种形式导出以便于第三方软件进行分析和作图.作为较成熟的综合热力学数据库,HSC Chemistry软件目前已被广泛应用于化学、化工、冶金、材料、环保等多个领域[3].本文拟对HSC 5.0版中的反应平衡(Reaction Equation)、平衡组成(Equilibrium Composition)、Eh-pH图(Eh-pH-Diagrams)3个计算模块结合具体实例来介绍该软件在高校化学科研中的应用.
1 反应平衡热力学计算
该模块在计算过程中主要根据吉布斯自由能最低原理和熵增加原理[4],按式(1)~(4)进行计算:

针对系统可能发生的反应,先用HSC Chemistry软件分别计算各反应的吉布斯自由能ΔG随温度T变化情况,再通过比较各反应的ΔG变化趋势,得出各反应式进行的相对难易程度.例如在太阳能熔融盐热化学循环制氢和合成气反应体系研究[5]实验中,首先利用资源丰富的CH4还原金属氧化物MxOy为金属单质M,再由金属M分解水制备H2,其两步化学循环步骤为

首先选取一些相对稳定并能与H2O反应生成H2的金属,如Ca、Mg、Al、Zn、Fe、Sn及Ti等,其相应金属氧化物MxOy与CH4的反应如下:

由HSC Chemistry软件的反应平衡模块可快速计算出各反应在不同温度下的标准焓变ΔHθ、熵变ΔSθ及吉布斯自由能改变值ΔGθ,通过热力学原理可筛选出适于利用太阳能作热源,在熔融盐反应介质中用CH4作还原剂制备金属单质和合成气新工艺的金属氧化物原料.图1为根据软件计算所得反应(7)~(13)的标准吉布斯自由能与反应温度的变化关系曲线图.根据热力学原理可得知在1 200 K以下时,只有Fe3O4、ZnO和SnO2可被CH4还原,能发生反应的最低温度相应分别为921 K、1 093 K和881 K,由此可得出CH4分别与Fe3O4、ZnO和SnO2气—固相反应于1 200 K以下在热力学上是可行的.
2 平衡相组成的计算
该模块的计算原理为首先拟合出体系中各相的热力学性质表达式,在满足物料平衡方程的前提下使恒温、恒压系统的吉布斯自由能最小,从而得到系统的平衡相组成.在计算过程中,只需输入反应系统的总压和初始物质的种类、数量、状态以及在随后变化过程中可能出现的稳定相,就可以获得在一定压力和温度条件下的平衡相组成[3].在上例通过HSC Chemistry软件计算筛选出太阳能熔融盐热化学循环制氢和合成气反应体系中适合被CH4还原成金属单质以制备H2的金属氧化物及其最低反应温度,工业上常采用在与这几种金属氧化物的还原热力学温度较接近的质量比为1∶1的Na2CO3和K2CO3熔融盐(熔点约983 K)反应介质中进行.由于反应在熔融Na2CO3和K2CO3介质中进行,故还需进一步考虑所选金属氧化物是否会与碱金属碳酸盐反应,该计算可通过HSC Chemistry软件的平衡组成模块来分析.在平衡计算窗口中将反应(7)、(8)、(13)按其化学反应计量系数,即Fe3O4∶CH4=1∶4、ZnO∶CH4=1∶1、SnO2∶CH4=1∶2并各自加上Na2CO3∶K2CO3=1∶1输入进行计算,可计算出101.325 kPa下反应系统中各组分含量与温度的关系,如图2所示.
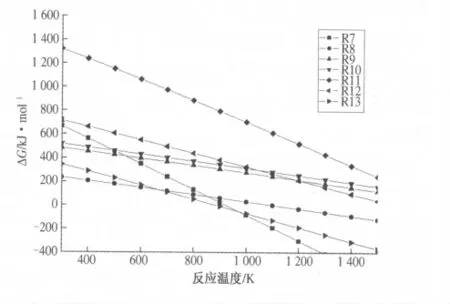
图1 反应(7)~(13)ΔGθ随温度T变化关系曲线图Fig.1 The curve graph ofΔGθ w ith the temperature for reactions(7)~(13)

图2 CH4与Fe3O4(a)、ZnO(b)、SnO2(c)熔融盐反应平衡组成图Fig.2 Equilibrium com position diagrams of CH4w ith Fe3O4(a)、ZnO(b)、SnO2(c)reactions
由图2可以看出,对Fe3O4来说(图2(a)),反应介质Na2CO3在约1 400 K时就完全反应生成了NaOH与金属Na,而部分Fe3O4可与K2CO3生成极为稳定的K2O·Fe2O3氧化物,说明Fe3O4与CH4不适于在熔融碱金属碳酸盐介质中反应.而对ZnO与SnO2来说(图2(b)、(c)),它们均未与熔融盐发生任何反应,在1 200 K时均与CH4基本反应完全,得到CO和H2摩尔比近似为1∶2的气相产物及金属单质蒸气,这个组成非常适合制备甲醇及Fischer-Tropsch合成,并且反应没有碳化物、CO2及其他不需要的物质产生,因此可得出ZnO或SnO2为较理想的并适于在熔融Na2CO3和K2CO3介质中反应的金属氧化物.
3 Eh-pH的计算
HSC Chemistry软件进行Eh-pH计算原理为依据电池反应的能斯特(Nernst)方程[6],把不同温度或电解质的不同离子浓度代入即可计算出其电池电势E,以电势E为纵坐标,溶液的pH值为横坐标,可绘出电势E随pH变化的关系,即Eh-pH曲线图.根据Eh-pH曲线图,可方便快捷判断电解质溶液中不同组分的热力学稳定区域.例如在讨论温度对ZnO薄膜电沉积的影响[7]实验中,由HSC Chemistry软件可计算出浓度为0.1 mol/L的Zn(NO3)2溶液在不同温度下ZnO沉积区域的电势Eh-pH图,结果如图3所示.
图3中右上方斜线从上到下分别代表101.325 kPa下氧气和水温度由25℃到90℃相应的两相平衡线.从图3可看出,随着温度升高,ZnO沉积的稳定区朝着更低的pH方向移动,相应Zn2+/Zn电对的还原电势几乎没有改变.一般电沉积ZnO系统温度控制在60℃~80℃范围内,显然只要调节溶液的pH为5~6,则沉积电势在-0.75 V(vs NHE)左右即可由Zn2+离子直接在衬底上电沉积生成ZnO,最后的实验结果也验证了用HSC Chemistry软件进行热力学理论分析的正确性.
以上只是作者结合具体实例简要介绍了HSC Chemistry 5.0版软件14个计算模块中常见的3个模块的应用,更多的应用可参考其软件用户手册.需要指出的是由于没有考虑到化学反应的动力学(速率)因素,因此HSC Chemistry并不能全面解决所有化学反应的实际问题,然而在许多情况下该软件仍不失为一款高效、绿色、经济及强有力的化学科研辅助工具,能为化学研究快速准确寻找到理论上最佳的反应条件和最高产率,已在众多领域获得了广泛应用.

图3 不同温度下0.1 mol/L Zn(NO3)2溶液中ZnO沉积区域的Eh-pH图Fig.3 The Eh-pH diagram of ZnO deposition region in 0.1 mol/L Zn(NO3)2solution at different tem peratures
[1]刘光灿.物理化学中化学热力学的教与学[J].中国校外教育,2011(6):174-175,179.
[2]段毅文,李彬,齐光辉,等.计算机辅助模拟计算热力学函数[J].内蒙古石油化工,2007,15(6):23-25.
[3]张光明,冯可芹,邓伟林,等.钒钛磁铁矿碳热合成铁基复合材料的热力学分析[J].四川大学学报:工程科学版,2012,44(4):191-196.
[4]曹锡章,宋天佑,王杏乔.无机化学:上册[M].3版.北京:高等教育出版社,2003:270-276.
[5]敖先权,王华,魏永刚.太阳能熔融盐热化学循环制氢和合成气反应体系研究[J].太阳能学报,2008,29(12):1528-1533.
[6]印永嘉,奚正楷,张树永,等.物理化学简明教程[M].4版.北京:高等教育出版社,2007:243.
[7]王艳坤,张建民,兰梦.温度对ZnO薄膜电沉积的影响[J].物理化学学报,2009,25(10):1998-2004.

