黄河三角洲潮间带泥螺重金属含量与生物质量评价
李秉钧, 王全超, 李宝泉, 冯俊荣
(1. 烟台大学 海洋学院, 山东 烟台 264005; 2. 中国科学院 烟台海岸带研究所, 山东 烟台 264003; 3. 中国科学院大学, 北京, 100049)
黄河三角洲作为典型的海岸带生态系统, 具有丰富的生物资源, 目前正受到人类活动的干扰。黄河三角洲的发育受入海径流, 黄河携带的悬浮物以及黄河入海口的影响。黄河三角洲自20世纪以来进行了大规模的围海造地以及海水养殖, 这已经造成河流和沼泽湿地面积减少, 而水库、水田、虾池、滩涂湿地面积明显增加[1]。海水养殖面积2005年比1985年增加超过300倍。围海造田和海水养殖同时也导致黄河口和邻近海域湿地面积减少和明显的富营养化问题。赤潮已造成了大量的经济损失, 如2004年黄河口及邻近海域赤潮, 造成直接经济损失300万元, 同时浮游动物和浮游植物生物多样性也明显下降[2]。
泥螺(Bullacta exarata(Philippi, 1848))隶属软体动物门、腹足纲、后鳃亚纲、头楯目、阿地螺科、泥螺属, 为太平洋西岸海水及咸淡水特产的种类,多分布于潮间带区域的泥沙或沙泥的滩涂上, 尤其密集于风浪小、潮流缓慢的海湾和河口。在我国沿海分布较广, 但主要分布于黄渤海和东海, 在浙江和山东两省潮间带滩涂上分布较丰。泥螺为表层沉积物舔食习性, 对饵料没有明显的选择性, 可舔食沉积物表层的底栖硅藻、有机碎屑、小型甲壳类和某些无脊椎动物的卵[3]。作为重要的经济软体动物之一, 泥螺从20世纪80年代就开始人工养殖, 并对其开展了大量的调查和研究工作, 包括泥螺个体行为特性[4]、繁殖生物学特征[4-5]、生态毒理学[6], 泥螺种群特征和空间分布[7-8]。
2001年泥螺首次引入黄河三角洲区域并开展潮间带人工养殖, 由于生境和饵料的适应, 泥螺种群在该区域快速扩展, 2005年其产量达到5万t, 产值达3亿元, 当年获纯效益2.8亿元[9]。泥螺养殖给黄河三角洲当地带来巨大经济效益的同时, 该种群的迅速扩张所带来的后续生态效应却知之甚少。近年来由于该区域经济的快速发展, 人类活动加剧, 使得该海域环境受到的干扰日益加重, 如过度捕捞、污染等都对该海域栖息的海洋生物产生明显的影响。重要渔业资源种类体内的残毒富集对于食品安全生产和人们的身体健康都产生直接或间接的影响, 许多海域的水生生物体内残毒都已经接近或超过允许残留量标准[10-13]。与其他动物不同的是, 泥螺为表层沉积物舔食习性, 大部分体表都与滩涂沉积物直接接触,对沉积物中重金属的富集可通过进食行为及体表渗透两种方式进行, 这样就更增加了对重金属的富集能力。随着泥螺产量的增大, 其食品安全也不容忽视,基于此作对该海域沉积物和泥螺进行重金属检测和分析比较, 以了解该海域泥螺资源质量状况, 为海域污染防控与治理和生物质量现状提供科学依据。
1 材料与方法
1.1 样品采集
在黄河三角洲潮间带高、中、低潮区分别设置9个采样点进行沉积物样品采集、选择每个潮区中的一个采样点同时采集泥螺样品(图1)。沉积物和泥螺样品采集后使用封口袋密封, 置于冰桶中保存并带回实验室分析。泥螺样品去除贝壳后, 软体部分经冷冻干燥至恒重, 研磨后, 取3个平行样测定各类重金属含量。

图1 黄河三角洲潮间带泥螺采样点Fig. 1 The sampling stations of sediment and mud snail from intertidal zone in Yellow River Delta
1.2 分析方法
生物残毒分析中重金属离子包括Cr、Cu、Zn、As、Cd、Pb和Ni。其中, Cu、Pb、Zn、Cd用原子吸收分光光度计(PE-4100ZL)分析, 采用标准为GB17378.4-1998; Hg和As采用原子荧光光谱法, 仪器为AF Spectrophotometer (AF-610A), 检测方法采用GB17378.5-1998。样品的分析步骤均按海洋监测规范[14]和水生生物监测手册[15]的规定进行, 严格保证质量。
1.3 数据处理和评价方法
由于海洋生物对重金属的富集作用和重金属不易降解的特性, 重金属在生物体内的浓度远高于水体中的浓度。作者采用残留量指数I和富集系数K以及金属污染指数(IMP)来评价它们的污染程度[11]。计算公式如下:
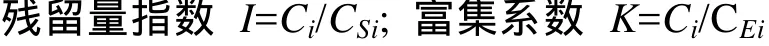
式中,Ci为生物组织(器官、个体、种群)体内某重金属质量分数(×10-6);CSi为某重金属允许残留量(×10-6);CEi为受检生物所在沉积物中某重金属的实测浓度(×10-6)。
当I≤1 时, 表明未受污染; 大于1时, 表明存在污染, 并可按I值大小, 划分污染程度。K值大小表明受检生物对海水重金属的富集能力。
金属污染指数[16]IMP= (Cf1×Cf2× ·· ×Cfn)1/n,其中Cfn为样品中第n种重金属的浓度。
2 结果
2.1 沉积物与泥螺体内重金属含量
调查区域不同采样点沉积物中六种重金属数值标准差均较小, 且不同区域分布的泥螺体内重金属含量差别较小, 空间差异性不大。按照国家海洋沉积物质量标准(GB18668-2002), 调查区域沉积物中的六种重金属含量均符合国家海洋沉积物质量标准第一类(表 1, 表 2)。
2.2 富集系数 K
泥螺对不同重金属的富集系数K有明显差别(表3),其中对Cu和Cd的富集能力最强, 分别达到7.5和4.0,其次为Zn 1.2, 对As、Pb和Cr的富集能力较低, 分别为0.4、0.1和0.1。
2.3 金属污染指数
金属污染指数(IMP)可用于评价生物体内重金属的总体状况, 结果显示, 黄河口潮间带泥螺金属污染指数为14.2±1.2, 总体状况较好, 即金属污染情况不严重。
2.4 残留量指数 I
从表3可以看出, As、Cd和Pb的残留量指数I均小于1, 说明该海域所测样品体内残毒含量都低于允许残留量标准, 且I数值较小, 说明样品体内残毒富集含量较低。

表1 黄河三角洲潮间带沉积物中各重金属含量Tab. l Trace metal contents in sediment in Yellow River Delta (×10 -6)
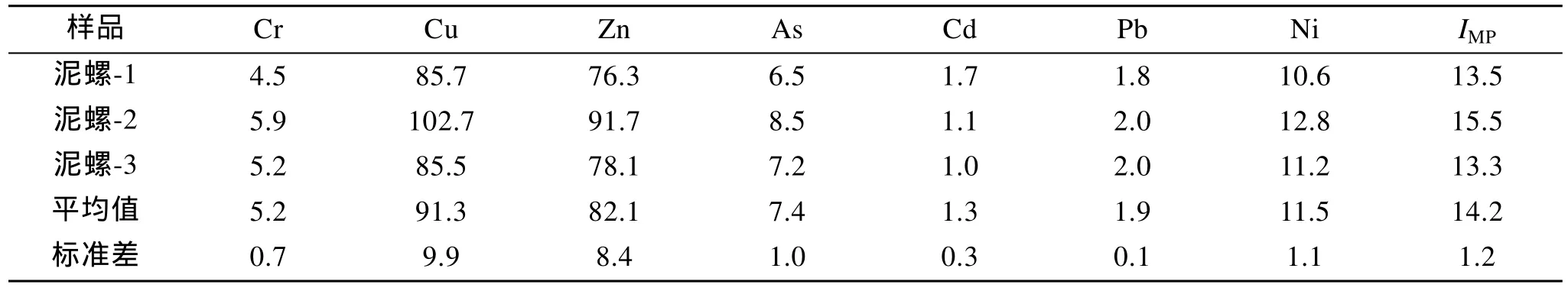
表2 黄河三角洲潮间带泥螺体内重金属含量 (生物体以干质量计)Tab. 2 Trace metal contents in mud snail body obtained from Yellow River Delta (×10-6)
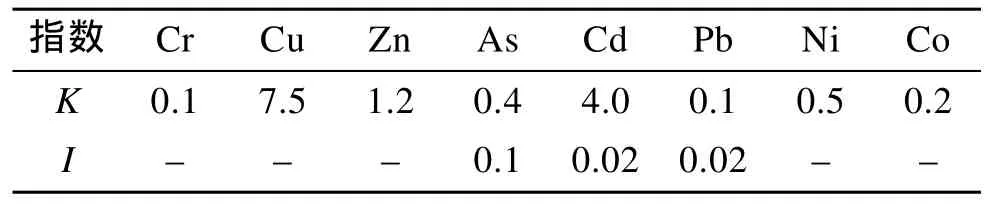
表3 乳山海域海洋动物体内重金属残留量指数I和富集系数KTab. 3 The leftover index (I)and enrichment coefficient(K)of trace metals in marine animal body
3 讨论
3.1 黄河三角洲潮间带沉积物与泥螺体内重金属含量
与长江口区域的泥螺相比, 黄河三角洲潮间带泥螺重金属含量数值较低(表 4), 这与区域人口密度、人类工农业活动和经济发展有关, 上述活动均可导致潮间带沉积物中重金属含量增加。李丽娜等[20]等报道长江口滨岸带泥螺对Cu的富集系数高达50.1,对 Zn的富集系数为 2。由于两个区域沉积物中 Cu含量相差不大(长江口为 11.4 ×10-6, 黄河口为12.3×10-6), 即Cu的环境背景值相近, 因此长江口泥螺对Cu的富集系数远大于黄河口泥螺的原因可能较为复杂, 两地泥螺个体大小、年龄组成、生理状态、采样季节等都可能影响到泥螺对Cu的富集。泥螺对不同重金属的富集能力也存在较大的差异, 其中对Cu 和Cd这两种重金属在体内具有高度生物浓缩效应, 可认为是这两种金属元素的强浓缩者[21]。泥螺对沉积物中重金属的富集存在一个动态过程, 而且富集的重金属之间具有一定的协同作用, 研究表明,泥螺体内Cu浓度的增加可促进对沉积物中Zn和Ni的吸收, 而抑制对Cr的富集[20]。

表4 与其他海域泥螺体内重金属含量的比较Tab. 4 Comparison of trace medal contents in mud snail between different area (×10-6)
残留量指数I因不同重金属和水生动物而异, 岳丽娟、史宝成[11]调查了葫芦岛市近岸海域水生动物重金属污染的状况, 发现在该海域动物体内的镉和砷的残留量指数I均大于1, 超过允许残留量标准, 说明海洋动物受污染较为严重。张云丽等[13]综合调查了烟台市近岸海域的入海污染源及环境质量状况,发现烟台市近岸海域生物残毒与20世纪80年代相比无明显变化, 基本未受重金属的污染。
3.2 黄河三角洲潮间带泥螺生物质量现状
根据我国海洋生物质量标准(GB18421-2001)的规定, 第一类标准适用于海洋渔业水域、海水养殖区、海洋自然保护区和人类食用直接相关的工业用水区; 第二类标准适用于一般工业用水区、滨海风景旅游区。国标GB18421-2001中的计算方法为以贝类去壳部分的鲜重计, 本研究中的泥螺体内重金属含量为软体部分的干质量, 按照干湿质量比例 1:10换算后, 与国标GB18421-2001相比, 泥螺体内除铅为第二类标准, 铬略超过第一类标准外, 其余重金属含量Cu、Zn、As、Cd均符合第一类标准, 说明黄河三角洲潮间带泥螺的生物质量总体较好。
在底栖生物食用标准方面, 根据澳大利亚国家卫生和医用研究理事会制定的人体消费标准[22], Hg、As、Pb、Cd的人体消费标准依次为0.5、1.0、1.5、0.2 µg/g, 据此标准, 黄河三角洲潮间带泥螺体内As、Pb、Cd含量分别为0.7、0.2和0.1, 均低于人体消费标准, 说明该区域的泥螺食用质量较好。珠江口软体类的Cd含量等于人体消费标准值[12], 这应该与该区域经济发达, 沉积物中重金属含量相对较高,生物富集较多有关。
重金属在生物体内的含量是诸多生物、生物物理和化学过程的综合结果, 其中包括生物对重金属的富集和降解、沿食物链的传递率、污染源的排放控制等过程, 这些都为相关渔业管理和安全生产带来一些困难, 但唯有控制其“源”, 即海洋动物的生存环境-海水水质状况及污染情况, 对污染源的进行预处理并达标排放, 才能从根本上改善生物体内重金属累积效应并解决生物食品安全问题。
致谢: 感谢中国科学院烟台海岸带研究所高学鲁研究员及其课题组人员在泥螺样品分析过程中给予的帮助和指导。
[1]张高生, 王仁卿. 现代黄河三角洲生态环境的动态监测[J]. 中国环境监测, 2008, 28(4): 380-384.
[2]纪大伟. 黄河口及邻近海域生态环境状况与影响因素研究[D]. 青岛: 中国海洋大学, 2006.
[3]於宏, 王一农, 王国良, 等. 泥螺养殖滩面饵料生物的调查研究[J]. 浙江海洋学院学报(自然科学版),2003, 22(3): 214-217.
[4]郑怀平. 泥螺行为与繁殖生物学特征的初步研究[J].海洋科学, 2003, 27 (1): 69-71.
[5]尤仲杰, 王一农, 丁伟, 等. 几种环境因子对不同发育阶段的泥螺Bullacta exarata的影响[J]. 浙江水产学院学报, 1994, 13 (2): 79-85.
[6]包坚敏, 王志铮, 陈启恒, 等. 4种重金属对泥螺的急性毒理和联合毒理研究[J]. 浙江海洋学院学报(自然科学版), 2007, 26 (3): 252-256.
[7]叶属峰, 陆健健. 长江口泥螺的种群特征及其生态学意义[J]. 长江流域资源与环境, 2001, 10 (3): 216-222.
[8]叶属峰, 陆健健. 长江口泥螺种群夏季的空间格局分析[J]. 动物学研究, 2001, 22(2): 131-136.
[9]苑春亭, 刘金明, 薄学锋, 等. 东营市潮间带泥螺增养殖调查报告[J]. 齐鲁渔业, 2006, 23 (3): 25-26.
[10]姚野梅, 金有坤. 长江口水质污染及生物惨毒状况调查[J]. 水产学报, 1995, 19(3): 280-287.
[11]岳丽娟, 史宝成. 葫芦岛市近岸海域水生动物重金属污染状况的检测[J]. 中国环境检测, 2001, 17(4):45-48.
[12]张敬怀, 欧强. 珠江口底栖生物重金属含量现状与评价[J]. 海洋环境科学, 2005, 24(2): 50-52.
[13]张云丽, 李爱珠. 烟台市近岸海域生物残毒调查研究[J]. 甘肃环境研究与检测, 2001, 14(1): 30-32.
[14]国家海洋局. 海洋监测规范[M]. 北京: 海洋出版社,1991.
[15]国家环保局《水生生物监测手册》编委会. 水生生物监测手册[M]. 南京: 东南大学出版社, 1993.
[16]Usero J, Gonzalez-Regalado E, Gracia I. Trace metal in the bivalve mollusksRuditapes decussatesandRuditapes philippinarumfrom the Atlantic coast of southern Spain[J]. Environment International, 1997, 23 (3): 291-298.
[17]叶属峰. 滩涂湿地泥螺(Bullacta exarata)的空间分布、重金属积累特征及其生态经济价值评估[D]. 上海: 华东师范大学, 2006.
[18]李丽娜, 陈振楼, 许世远, 等. 铜锌铅铬镍重金属在长江口滨岸带软体动物体内的富集[J]. 华东师范大学(自然科学版), 2005, 3(3): 65-70.
[19]毕春娟, 陈振楼, 许世远, 等. 长江口潮滩大型底栖动物对重金属的累积特征[J]. 应用生态学报, 2006,17 (2): 309-314.
[20]李丽娜, 陈振楼, 许世远, 等. 长江口滨岸潮滩底栖动物泥螺受铜污染的毒理学研究[J]. 海洋环境科学,2004, 23 (3): 24-26.
[21]Dallinger R, Berger B, Hunziker P, et al. Metallothionein in snail Cd and Cu metabolism [J]. Nature, 1997,388: 237-238.
[22]余日清, 谢镜明, 杨广杏, 等. 湛江港湾海产品的品质与污染物积累[J]. 海洋环境科学, 1998, 17 (2):45-49.

