利用数字化实验研究硫代硫酸钠与硫酸反应速率的影响因素
陈 功 罗榆琴 佘文静 马宏佳
(南京师范大学教师教育学院 江苏 南京 210046)
一、问题提出
硫代硫酸钠与硫酸的反应是高中化学教学中研究温度对化学反应速率影响的重要实验之一。在实际教学中,常在反应器底部垫一张画有十字的白纸,通过观察生成的硫单质沉淀使十字完全看不见所需要的时间来判断反应的快慢。但这样的判断往往因人而异,没有量化的数据。而应用色度计和温度传感器,可以很好地解决这一问题。
此外,能否在教学中用该实验介绍浓度对反应速率的影响,不同反应物浓度的变化对反应速率的影响是否一致?笔者也用色度计和温度传感器进行了研究。
二、实验原理与设计
1.实验反应方程式
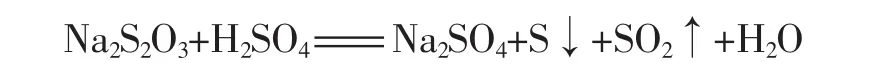
2.温度对反应速率的影响
大多数化学反应速率随温度升高而增加。范特霍夫曾总结出一条近似规律:温度每升高10K,反应速率变为原来的2~4倍。范特霍夫规则可用于对反应速率的粗略估算,但适用范围有限。阿仑尼乌斯提出了一个较为精确地描述反应速率常数与温度关系的经验公式:
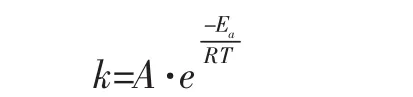
式中k为速率常数,A为指前因子,Ea为反应的活化能。速率常数是单位浓度下的反应速率,速率常数越大的反应,反应速率越快。由阿仑尼乌斯公式可知,温度对反应速率的影响与反应的活化能大小和反应的温度区间有关。
3.色度计原理
色度计可测量溶液的透光率 (T),相当于一台简易的分光光度计。它通过滤光片发出一定波长的平行光,当一束平行光通过比色皿中均匀的溶液介质时,光的一部分被吸收(It),一部分被透过(Io)。通过比对透射光强度与发射光强度,即可得到透光度T(T=It/Io)。根据朗伯比尔定律,溶液的吸光度(A)与吸光物质的浓度 (c)和吸收层厚度(b)的乘积成正比,且等于透光率倒数的对数:
吸光度 A =lg(1/T)=Kcb(K 为比例常数)
本实验中生成的硫为颗粒极小的悬浮物,在溶液中分布均匀,当生成硫的量不断增加时,透射光强度逐渐减少,吸光度 (A)与生成硫的量成正比,可以据此确定反应速率。本实验采用稀释法获取一组不同浓度的溶液,将装有溶液的容器在恒温电磁搅拌器上加热保温,获得不同温度的溶液,然后取一定量溶液在比色皿中混合反应,并用实时数据采集软件记录反应过程。
三、实验过程
1.仪器与药品
Vernier色度计 (COL-BTA型),Venier温度传感器(TMP-BTA),Vernier LabPro 数据采集器,数据采集软件(Logger Pro 3.8.5.1),比色皿,滴管,量筒(10 mL),恒温磁力搅拌器。
硫代硫酸钠溶液,硫酸溶液。
2.实验步骤
(1)如装置图 1所示连接各装置,接好数据采集器外接电源,打开数据采集软件。
图1 实验装置
(2)色度计用蒸馏水校准,并取硫代硫酸钠与硫酸混合液样品寻找最大吸收波长,经实测效果验证,选用吸收波长为430 nm。
(3)将 0.025 mol/L 硫代硫酸钠和 0.025mol/L 硫酸放置在恒温搅拌器上水浴保温。 分别取60、50、40、30、20℃下溶液各2mL,在比色皿中混合,放入色度计内并记录数据。(每0.25s读取1个数据,采集时间300s,下同)。
(4) 将 0.1mol/L 硫酸与 0.05、0.025、0.0125mol/L 硫代硫酸钠各2mL,在比色皿中混合,放入色度计内并记录数据。
(5) 将 0.05mol/L 硫 代 硫 酸 钠 与 0.05、0.025、0.0125mol/L 硫酸各 2 mL,在比色皿中混合,放入色度计内并记录数据。
四、实验数据记录与分析
1.温度对于反应速率的影响
2 mL 0.025mol/L 硫代硫酸钠与 2 mL 0.025mol/L 硫酸混合, 分别在 60℃(a)、50℃(b)、40℃(c)、30℃(d)、20℃(e)下反应的吸光度(A)随时间变化曲线如图2所示。
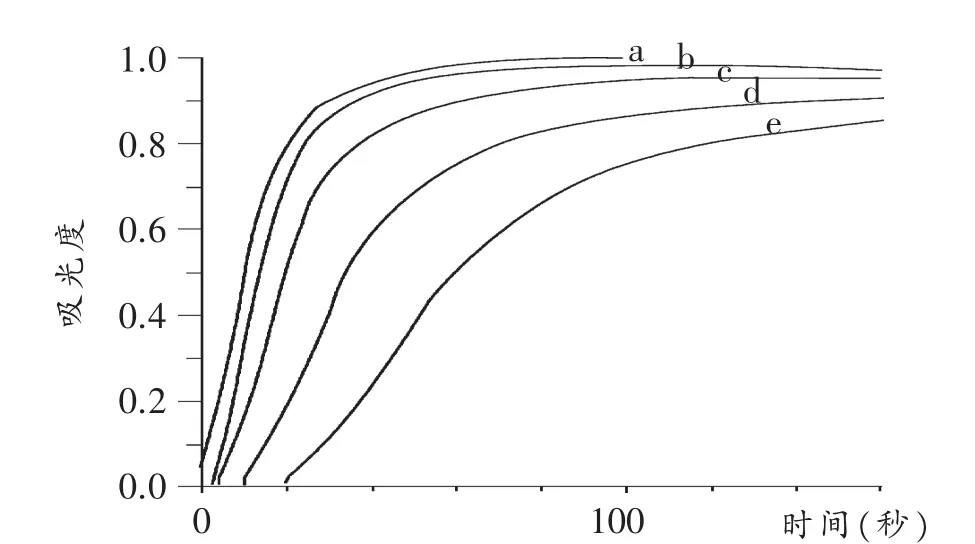
图2 不同温度下硫代硫酸钠与硫酸反应吸光度随时间变化曲线
显然,不同温度下,反应达到相同吸光度所需要的时间是不同的。选取吸光度(A)为0.5和0.7为观察点,定义相应吸光度与达到所需时间的比为表观速率(由朗伯比尔定律可知,表观速率与实际速率成正比),并计算同一温度下吸收度(A)分别为0.5和0.7时的表观速率的均值,得实验数据及处理结果见表1。
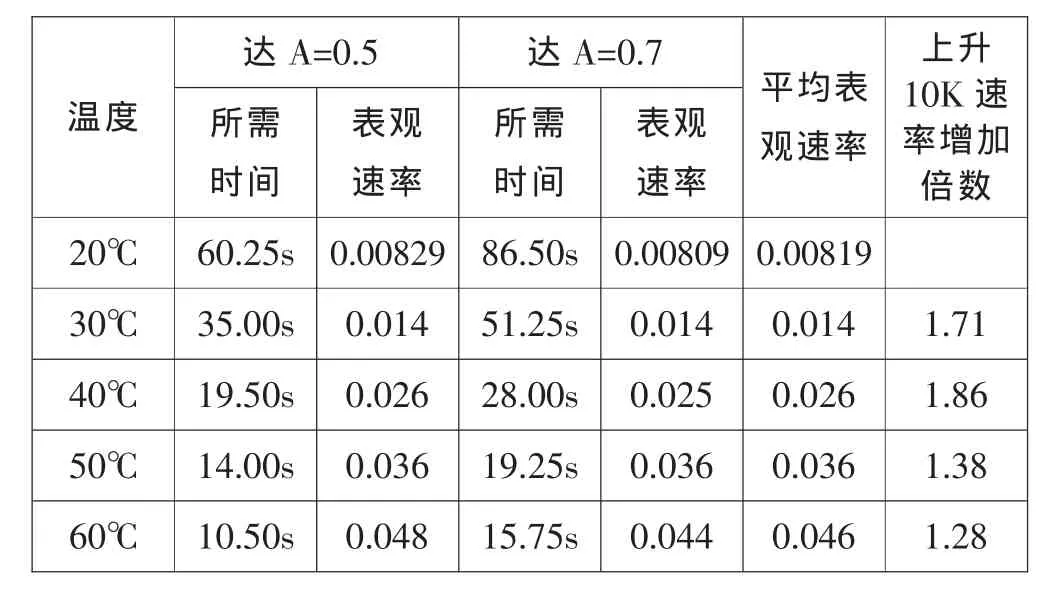
表1 不同温度反应速率数据表
即温度从20℃上升到30℃,反应速率增加1.71倍(v30/v20=1.71), 同理有 v40/v30=1.86,v50/v40=1.38,v60/v50=1.28。
2.浓度对于反应速率的影响
(1)测定硫代硫酸钠浓度变化对反应速率的影响
2 mL 0.1mol/L 硫 酸 分 别 与 2 mL 0.05mol/L (a)、0.025 mol/L (b)、0.0125 mol/L (c) 硫代硫酸钠溶液混合,测得反应的吸光度(A)随时间变化曲线如图3所示。
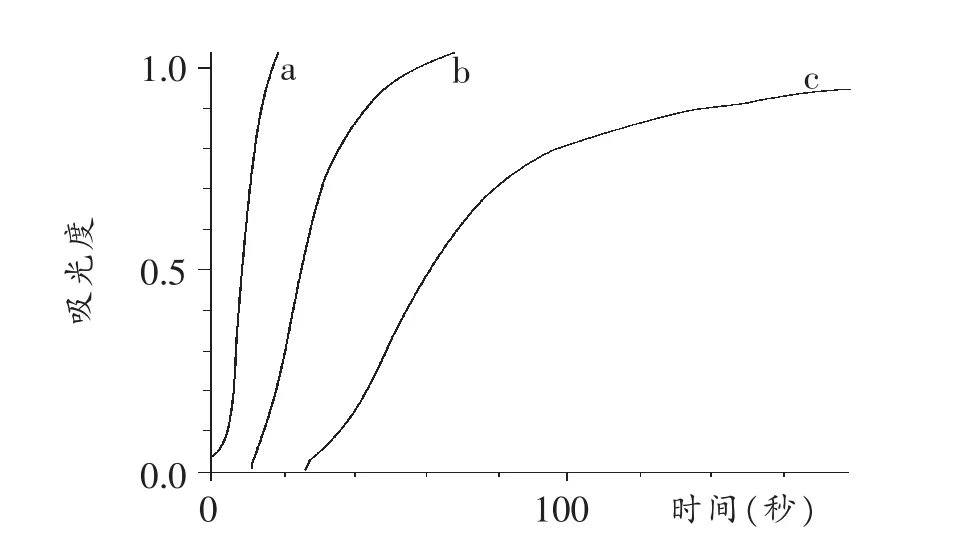
图3 不同浓度硫酸与硫代硫酸钠反应吸光度随时间变化曲线
选取吸光度(A)为 0.5 和 0.7 为观察点,不同浓度下反应时间如表2:
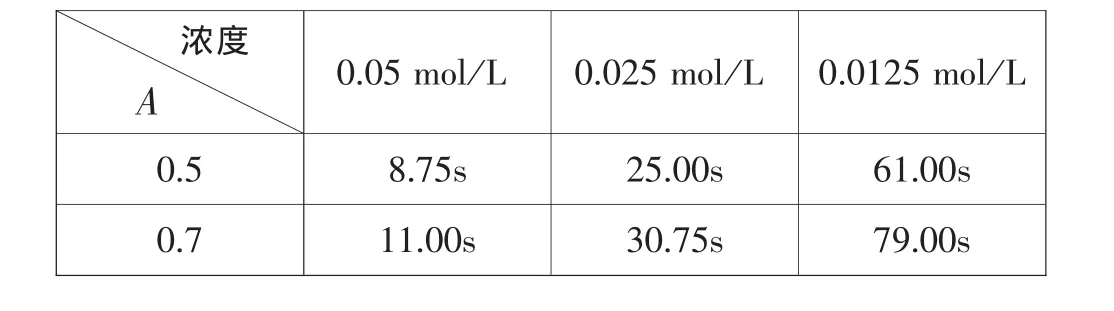
表2 不同浓度硫代硫酸钠反应达到相应吸光度所需时间
为比较浓度对速率影响的大小,我们定义一个速率影响因子X。X为在不同浓度时,达到某一吸光度(A)所需的最长时间与最短时间的差值与最短时间之间的比值。
表示为 XA=(tmax-tmin)/tmin
则 X0.5=5.97,X0.7=6.18,取均值,X=6.08。
(2)测定硫酸浓度变化对反应速率的影响
2 mL 0.05 mol/L 硫代硫酸钠分别与 2 mL 0.05 mol/L(a)、0.025 mol/L(b)、0.0125 mol/L(c)硫酸溶液混合,测得反应的吸光度(A)随时间变化曲线如图4所示。
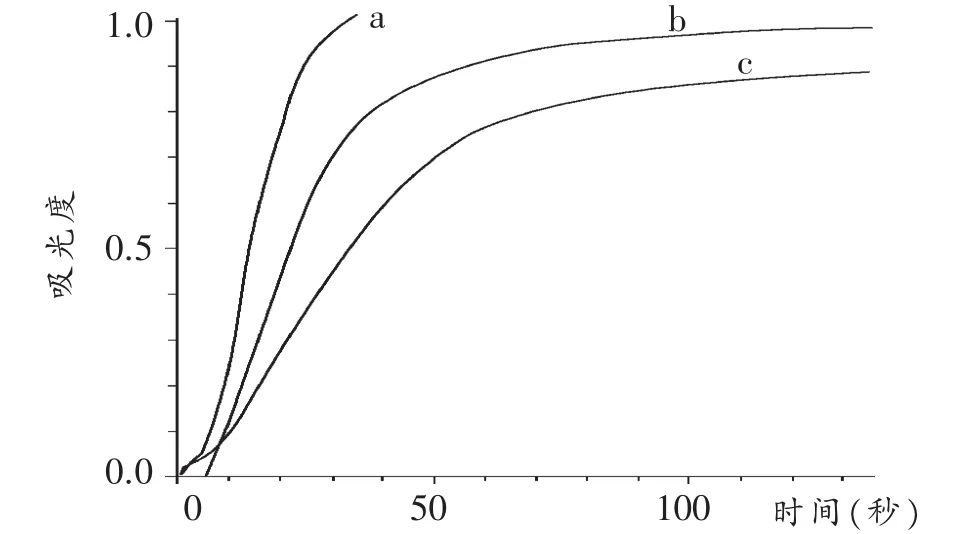
图4 不同浓度硫代硫酸钠与硫酸反应吸光度随时间变化曲线
选取吸光度(A)为 0.5 和 0.7 为观察点,不同浓度下反应时间如表3:
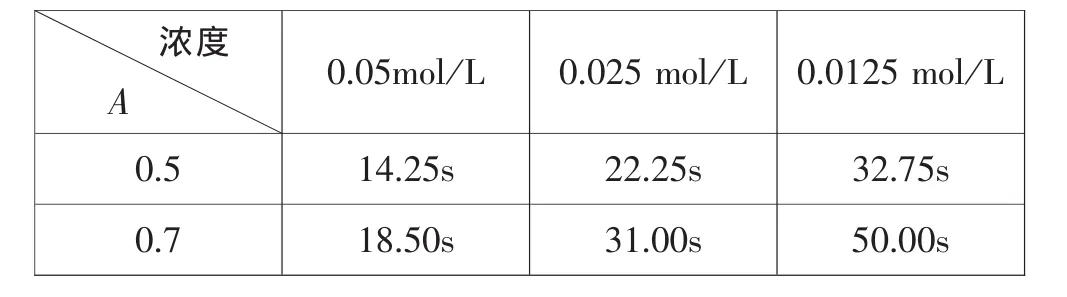
表3 不同浓度硫酸反应达到相应吸光度所需时间
同理,X0.5=1.30,X0.7=1.70,取均值 X=1.50。
五、研究结果与讨论
1.升高温度可以提高反应速率。在本实验条件下,硫代硫酸钠与硫酸的反应每升高10K反应速率提高1.28-1.86倍,且在温度较低时,升高温度可以更显著的提高反应速率。
2.不同反应物浓度变化对反应速率的影响可能不同。根据速率影响因子大小,可以看出在相同条件下,硫代硫酸钠的浓度对于反应速率的影响比硫酸浓度影响要大得多(6.08>>1.50)。 对于该现象的初步解释是硫代硫酸钠与硫酸反应可能分为两步进行:
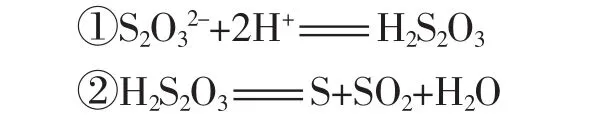
其中反应①速率快,而②反应速率较慢,为决速步,故总反应速率受氢离子浓度影响不大。
3.本实验设计的优势在于引入定量及半定量的方式研究温度对反应速率的影响。学生可以利用色度计获得实验数据,计算出温度升高确定数值时反应速率增加的倍数,并发现不同温度区间内温度对速率的影响程度是不同的。这对有兴趣的学生进一步认识范特霍夫规则甚至阿仑尼乌斯经验公式具有很好的启发性。
4.用定量及半定量的方式研究浓度对反应速率的影响可以深化学生的认知,开发了课本上该实验的潜在教学价值。之前的学习中学生只知道反应速率与反应物浓度成正比这一模糊的概念,而本实验探究可以较好地引发认知冲突,让学生初步意识到不同反应物浓度对反应速率的影响程度可能不同,从而激活学生的思维。
[1] 北京师范大学无机化学教研室.无机化学(上册)(第四版)[M].北京:高等教育出版社:272-278
[2] 北京师范大学,华中师范学院,南京师范学院无机化学教研室.无机化学(上册)(第 1 版)[M].北京:人民教育出版社:135-137
[3] 宋心琦.普通高中课程标准实验教科书化学4 (必修)[M].北京: 人民教育出版社,2007: 20
——硫代硫酸钠

