美洲大蠊提取物的质量标准研究
张臻,宋芹,胡慧玲,何瑶,傅超美
现代研究表明,美洲大蠊具有组织修复、改善微循环、清除自由基、消肿、促血管增生、抗炎镇痛、抗菌、抗病毒、抗肿瘤及增强免疫等众多功效。尤其是蛋白质和氨基酸含量高于50%以上,具有很好的护肤功效,因此逐渐成为国际上近年来比较流行的美容用品原材料和日化原材料。本课题所用美洲大蠊提取物是由美洲大蠊药材粗粉以水为溶媒经闪式提取、除杂、冷冻干燥后所得实验室自制粉末,课题组前期研究验证表明美洲大蠊提取物的制备工艺稳定可行[1]。在工艺确定的基础上,为了确保以其为原料开发的美容制剂疗效可靠,课题组主要选取了与护肤功能相关的蛋白质、氨基酸、水分为指标控制其质量[2~3]。
1 试验仪器与材料
1.1 仪器
UV1100紫外可见分光光度计(上海天美科学仪器有限公司);Mili-Q超纯水处理仪(美国密理博公司);恒温干燥箱(上海森杏实验有限公司,DGG-9240);BP211D电子天平(德国Sartorius公司);电子恒温水浴锅(北京中兴伟业仪器有限公司,DZKW-4);DL-360超声波清洗器;高速台式离心机(TGL-16G);96孔酶标板(NUNC MaxiSorp)。
1.2 材料
美洲大蠊药材提取物(实验室自制);谷氨酸对照品(成都瑞芬思生物科技有限公司,批号:G-025-110305);茚三酮(天津市瑞金特化学品有限公司,批号:110518);PBS(pH7.2~7.4,)(北京中金桥生物技术有限公司)、氯化亚锡、硅胶G均为分析纯。
2 试验方法与结果
2.1 TLC鉴别
2.1.1 供试品溶液的制备 取提取物0.12 g,加水10 mL搅拌使溶解,作为供试品溶液。
2.1.2 对照药材溶液的制备 取美洲大蠊对照药材粉末1 g,加水10 mL研磨使溶解,滤过,滤液作为对照药材溶液。
2.1.3 阴性对照溶液的制备 取10 mL水,同供试品与对照药材溶液制备方法研磨,滤过,滤液作为阴性对照溶液。
2.1.4 薄层色谱试验 照薄层色谱法(《中国药典》2010年版一部 附录ⅥB)试验,吸取上述三种溶液各10 µL,分别点于同一硅胶G薄层板上,以正丁醇-冰醋酸-水(19:5:5)为展开剂,展开,取出。晾干,喷以0.5%茚三酮溶液,在105 ℃加热至斑点显色清晰。
供试品色谱中,在与对照色谱相应的位置上显相同颜色的斑点,而阴性对照溶液在此相应位置上无对应斑点。结果见图1。

图1 美洲大蠊药材提取物TLC鉴别图
2.2 水分检查
照《中国药典》2010年版一部附录IX H项下水分测定第一法进行测定。取美洲大蠊药材提取物3 g,平铺于干燥至恒重的扁形称量瓶中,精密称定,打开瓶盖在100~105 ℃干燥5小时,将瓶盖盖好,移置干燥器中,冷却30 min,精密称定,再在上述温度干燥1小时,冷却,称重,至连续两次称重的差异不超过5 mg为止。根据减失的重量,计算供试品中含水量。
三批样品水分检查结果见表1。结果表明,美洲大蠊药材提取物的平均含水量为4.67%。将美洲大蠊药材提取物的含水量标准按150%降低,故规定水分不得过7.0%。
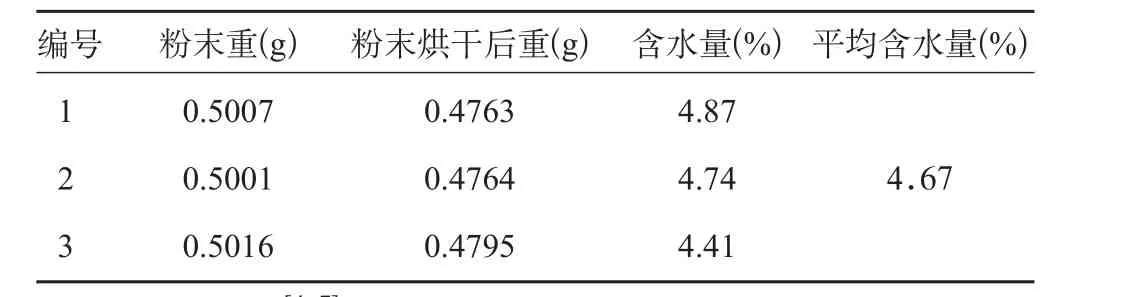
表1 美洲大蠊药材提取物水分考察结果(n=3)
2.3 含量测定 [4~7]
根据参考文献与预实验,选用紫外可见分光光度法来测定本品中总氨基酸的含量。
2.3.1 测定方法 对照品溶液的制备:取谷氨酸对照品适量,精密称定,加PBS液(pH=7.2~7.4)配制成1 mg﹒mL-1的对照品母液[8]。
供试品溶液的制备:取美洲大蠊药材提取物12 g,精密称定,加纯水定容至1000 mL,配成每1 mL含25 mg原生药量的溶液。量取该溶液0.3 mL,置于25 mL容量瓶中,依次加入1.0 mL PBS液(pH=7.2~7.4), 0.5 mL 2%的茚三酮溶液,在沸水浴中加热15分钟,冷却后加纯水定容,即得。
测定法:对照品和供试品溶液均在570 nm处测定吸光度。供试品可通过标准曲线算出谷氨酸的含量(mg),并按以下公式由测定的谷氨酸含量计算样品总氨基酸含量:
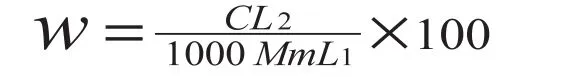
(W-氨基酸总量,% ;C-根据标准曲线查得的谷氨酸量,mg;L1-测定用试样量,mL;L2-试液总量,mL;M-试样质量,g;m-试样干物率,%)。
2.3.2 线性关系考察 取谷氨酸对照品母液,稀释10倍作为工作溶液,再取工作溶液2.0,2.5,3.0,3.5,4.0,4.5,5.0,5.5 mL于一组25 mL容量瓶中,依次各加1.0 mL PBS液(pH=7.2~7.4),0.5 mL 2%的茚三酮溶液,在沸水浴中加热15 min,冷却后加纯水定容,放置10分钟后,以不同浓度标准品的吸光度对应浓度绘制标准曲线。结果:得到一元线性方程Y=21.467X+0.1399,r2=0.9981,在0.008~0.022 mg﹒mL-1范围内呈良好线性关系。
2.3.3 精密度试验 精密量取谷氨酸对照品工作溶液3.0 mL于25 mL容量瓶中,加1.0 mL PBS液(pH=7.2~7.4),0.5 mL 2%的茚三酮溶液,在沸水浴中加热15分钟,冷却后加纯水定容,一天内连续测定6次吸光度。结果:RSD<2%,仪器精密度良好。
2.3.4 稳定性试验 精密量取样品溶液0.3 mL于25 mL容量瓶中,依次加入1.0 mL PBS液(pH=7.2~7.4),0.5 mL 2%的茚三酮溶液,在沸水浴中加热15分钟,冷却后加纯水定容,分别于0,1,2,4,8 h后测定吸光度,结果:RSD<2%,稳定性良好。
2.3.5 重复性试验 取美洲大蠊药材提取物6份,按“2.3.1”进行供试品制备和测定,计算总氨基酸的含量。结果:RSD=2.2%,该方法重复性良好。
2.3.6 加样回收率试验 取已知含量M的药材提取物5份,分别精密加入对照品适量,按“2.3.1”项下方法制备加样回收率样品,加样回收率的结果见表1。平均回收率为99.3%,RSD值为2.11%。
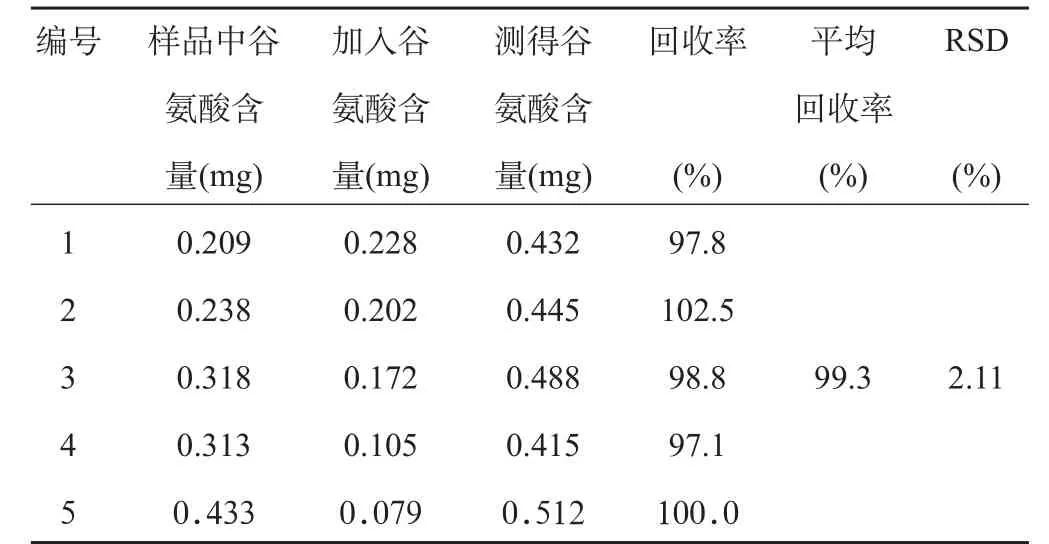
表1 加样回收率试验结果
2.3.7 样品测定 取三批美洲大蠊药材提取物,按“2.3.1”项下进行供试品制备和测定,计算总氨基酸的含量。三批样品测定结果见表2。
结果表明,谷氨酸含量均值为0.061%,氨基酸含量的均值为8.79%。综合考虑药材来源、制剂生产及贮存等因素,将美洲大蠊药材水提物总氨基酸的含量标准略为降低,暂定本品谷氨酸含量不得少于0.049%,总氨基酸含量不得少于7.03%。
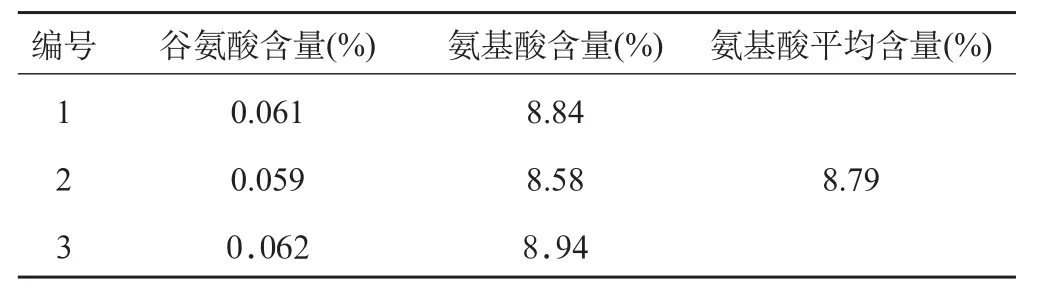
表2 美洲大蠊药材提取物总氨基酸含量测定结果(n=3)
3 讨论
本论文研究美洲大蠊提取物的质量控制标准,相比植物药,动物药的化学成分更为复杂,主要成分多是蛋白质与氨基酸。该药材的蛋白质与氨基酸含量高于50%以上,且两种物质具有组织修复、改善微循环、清除自由基等功效,符合课题组以其为原料开发美容制剂的需要。因此,课题组采用氨基酸和蛋白质为质控指标,以UV控制氨基酸含量,以TLC作为蛋白质指标质控的方法,同时,因为该水提物易吸潮,因此对其水分进行控制。质量标准中暂定本品水分不得超过8.0%,总氨基酸含量不得少于7.03%。所制定的质量控制方法简便易行,选取的质量控制指标合理,能保证提取物的质量稳定可控。
[1] 张臻.M乳膏的药学研究[D].成都:成都中医药大学,2012.
[2] 董玉秀,李中心,赵君玫.偏复康胶囊质量标准的实验研究[J].河南中医学院学报,2003,7(4):26.
[3] 边海疆.莪术残油软膏剂的制备工艺及质量标准研究[D].辽宁:辽宁中医药大学,2010.
[4] 夏明,麻辰韶.红花籽粕水溶性蛋白的提取与氨基酸组成分析[J].农产品加工,2009,(9): 41.
[5] 范婉萍,吴婕.用分光光度法测定含氮基酸类制品中的氨基酸含量[J].中国测试技术,2007,33(3):117.
[6] 章丽,刘松雁.氨基酸测定方法的研究进展[J].河北化工,2009,32(5): 27.
[7] 吴月娜,黄松,刘梅,等.青天葵中总游离氨基酸的提取工艺研究[J].中国中医药信息杂志,2011,(18)1:53.
[8] 周国兰,何萍,郑文莉.茚三酮比色法测定茶叶中游离氨基酸总量方法存在问题的探讨[J].化学分析计量,2009,(18)5: 79.

