菲对斜生栅藻(Scenedesmus obliquus)自由基的诱导及胁迫效应*
蒋丽娟,尹 颖**,杨柳燕,尹大强,王晓蓉,郭红岩
(1:南京大学环境学院,污染控制与资源化研究国家重点实验室,南京210046)
(2:同济大学环境科学与工程学院,长江水环境教育部重点实验室,上海200092)
藻类是水体中的主要初级生产者,也是水生食物链的基础环节.它们的存在无论是对水体生产力还是水体污染的自净作用均具有十分重要的意义.因此,在研究毒物或废水对水环境的影响时,都把藻类测试作为一项重要内容.斜生栅藻(Scenedesmus obliquus)在分类上隶属绿藻门的栅藻科,是常见的浮游藻类.在国内,斜生栅藻和小球藻最常用于毒性测试.以前以重金属为目标污染物的研究较多[1],近年来主要研究有机污染物对藻类的毒性效应[2-3],而关于污染物对藻类产生的影响的研究大多集中于光合色素、蛋白质含量、藻的生长和半效应抑制浓度等生理指标,以及污染物长期暴露导致的藻细胞结构和群落形态的变化等方面.污染物对藻产生生物效应的机理还有待进一步深入研究.自由基被医学上认为是万病之源,其对机体产生的毒性效应目前已经得到大量的证实[4-5],而藻类在污染物作用下是否也产生自由基的累积,还鲜有文献报道.
多环芳烃(PAHs)是一类典型持久性有机污染物,因其“三致”效应受到广泛关注.目前,在各种环境介质中均发现了多环芳烃,菲是多环芳烃中含量较高的化合物,在各类已检测出多环芳烃的样品中几乎都含有菲;研究表明,PAHs等有机污染物在生物体内代谢时会产生自由基,进而引起各种抗氧化系统酶活性的变化[6],但其对藻类产生自由基诱导及胁迫作用的研究报道不多.本文以斜生栅藻为材料,研究了不同浓度的菲静态暴露96 h后,对栅藻的生长、自由基的产生、各项抗氧化系统指标的响应以及它们之间的相互关联,为菲污染对水生生态环境的影响研究提供更多的理论依据.
1 材料和方法
1.1 供试材料
仪器:主要有Bruker EMK10/12型电子顺磁共振谱仪、岛津RF-5000型荧光分光光度计、J2-HS高速冷冻离心机、UV1600紫外可见分光光度计、Labconco冷冻干燥器、DK-S24恒温水浴锅、PIX生化恒温多用培养箱.
试剂:菲(纯度99%)、2-硫代巴比妥酸,牛血清蛋白购自Sigma公司,均采用分析纯以上试剂.
1.2 实验方法
斜生栅藻(Scenedesmus obliquus)由中国科学院水生生物研究所提供.将藻种接种至MA培养基中,培养至对数生长期后进一步扩大培养.培养条件:温度25℃ ±0.5℃,pH 7~8,光暗比12 h∶12 h,光强3000 lx,静置培养,每天定时人工摇动3次.藻进入对数生长期(105cells/ml),设置5个菲浓度组(0.005、0.01、0.025、0.05、0.1 mg/L)和对照组,每组设8 个平行.96 h 后取样检测.
1.3 分析测定方法
1.3.1 生长抑制 采用显微镜下血球计数板计数,在波长687 nm下测定斜生栅藻吸光度,建立藻细胞浓度-吸光度标准曲线.根据96 h暴露后藻液的吸光度计算藻细胞的浓度.将藻液4500转/min离心15 min后收集藻细胞.
1.3.2 自由基的测定 藻细胞冷冻干燥,称量0.01 g,装入内径为3 mm的石英管中进行ESR分析,操作过程中避免水分沾入.ESR的操作参数:测试温度为室温,微波功率(SP)为20 mW,微波频率(SF)为X-band,调制频率(MF)为 100 kHz,调制幅度(MA)为 1.0 Gs,中心磁场(CF)为 3470 Gs,扫描时间(TI)为 84 s,时间常数(TC)为 41 ms,扫场宽度(SW)为 200 Gs,信号 2 次叠加[7].
1.3.3 抗氧化酶活性的测定 粗酶提取液:取一定量藻细胞,加入2 ml Tris-硼酸缓冲液(0.01 mol/L Tris,0.05 mol/L H3BO4,0.05 mol/L EDTA,1 μl 95% 巯基乙醇),冰浴中抽提 10 min,4℃ 离心(10000 转/min)20 min,取上清液待测.
超氧化物歧化酶(SOD)用氮蓝四唑法[8]测定.过氧化物酶(POD)用邻苯三酚法[9]测定.谷胱甘肽硫转移酶(GST)活性的测定采用Habig法[10].
1.3.4 谷胱甘肽含量的测定 采用荧光分光光度法,参照Hissin等[11]的方法,将液氮固定的鲜样,加入一定量的0.1 mol/L磷酸钠缓冲液(0.005 mol/L EDTA,pH=8.0)和 25%HPO3,冰浴上充分研磨,冷冻离心(4℃,13000 转/min,15 min),上清液冷藏待测.
还原型谷胱甘肽(GSH)含量测定:取100 μl组织液,加入2.8 ml 0.1 mol/L磷酸缓冲液(pH=8.0)及100 μl(1 mg/ml)荧光试剂邻苯二甲醛(OPT),混匀,室温放置10 min后以343 nm为激发光,在425 nm处测定荧光强度.
氧化型谷胱甘肽(GSSG)含量测定:取500 μl组织液与200 μl 0.04 mol/L N-乙酰顺丁烯二酰亚胺(NEMI)溶液混匀,室温放置 20 min 后,取 100 μl加入 2.8 ml 0.1 mol/L NaOH 及 100 μl(1 mg/ml)OPT 荧光试剂,充分混合,之后同上.
酶的活性和谷胱甘肽含量均用蛋白标定.蛋白质含量用色素结合法测定[12],以小牛血清蛋白为标准蛋白.
1.3.5 脂质过氧化产物含量的测定 采用硫代巴比妥酸(TBA)比色法[13],脂质过氧化产物(MDA)以每毫克蛋白中含硫代巴比妥酸反应产物(TBARS)的量(nmol/ml)表示,摩尔消光系数e=1.56 ×105mol/(ml·cm).
1.4 统计分析
实验结果表示为平均数±标准误差.使用SPSS统计软件和单边ANOVA法对组间数据进行差异性显著分析,P<0.05表明差异显著.Origin 7.0统计软件处理自由基数据.
2 结果
2.1 菲对斜生栅藻生长的影响
经过96 h暴露后,斜生栅藻的生长量随菲浓度的增高而降低,当菲浓度为0.005 mg/L时,藻细胞的生长开始受到抑制,随着菲暴露浓度的升高(≥0.01 mg/L),藻细胞的生长受到显著抑制.菲的暴露浓度继续增大至0.025 mg/L时,藻细胞的生长变化较小(图1).

图1 菲对斜生栅藻生长效应的影响Fig.1 Effect of phenanthrene on the growth of S.obliquus
2.2 菲诱导斜生栅藻产生自由基
用电子自旋共振(EPR)直接测得菲诱导下斜生栅藻细胞中自由基的产生(图2),EPR谱图在3468~3478 mT宽度内有较强的信号,经计算机拟合分析,根据公式h·v=g·β·B(h为自旋电子角动量,v为电子共振频率,β为电子的波尔磁子,B为中心磁场强度,g光谱分裂因子),g=2.0033,幅宽为 10.15 mT,为一单峰.暴露浓度为0.01 mg/L时,菲诱导斜生栅藻产生的自由基信号强度与对照组相比有显著差异(P<0.05).在实验设置的暴露浓度中,暴露组样品产生的自由基信号均比空白强(图3),说明斜生栅藻在菲的胁迫下诱导产生了自由基.

图2 菲暴露下斜生栅藻产生的EPR图谱Fig.2 EPR spectra of free radicals in S.obliquus exposed to phenanthrene

图3 自由基信号强度与菲暴露的剂量效应关系Fig.3 Dose-effect relationship between free radical signal intensity and phenanthrene contents
2.3 菲对斜生栅藻抗氧化酶活性的影响
菲暴露下,斜生栅藻SOD、POD、GST活性与对照组相比均被诱导,SOD活性在低浓度暴露时没有出现显著性差异,当菲的暴露浓度达到0.05 mg/L时,SOD活性出现显著诱导(P<0.05),0.1 mg/L菲暴露组 SOD 活性达到对照组的2.03倍;0.005 mg/L菲暴露组POD活性与对照组相比没有变化,随着暴露浓度的增高,POD活性显著增强,0.01 mg/L菲暴露组的酶活最强,菲暴露浓度继续升高,POD活性则有下降的趋势;GST活性在0.005 mg/L菲暴露时显著诱导,随着暴露浓度的增高,GST的活性轻微下降后又逐渐增强,0.05 mg/L暴露组的酶活最强,高浓度的两组酶活变化较小(图4).

图4 菲对斜生栅藻抗氧化酶活性的影响Fig.4 Antioxidant defense enzyme activity in S.obliquus under phenanthrene exposure
2.4 菲对斜生栅藻谷胱甘肽含量的影响
菲暴露对斜生栅藻GSH、GSSG的影响表明,GSH随菲暴露浓度变化趋势与SOD活性变化相似,菲的暴露诱导GSH含量升高,这种诱导作用在0.1 mg/L暴露组最显著,为对照组的2.15倍;GSSG含量在低浓度菲暴露(≤0.01 mg/L)时轻微降低,与对照组没有显著性差异,在高浓度菲暴露时(≥0.025 mg/L),GSSG含量显著升高,并在浓度达到0.1 mg/L时有下降趋势,但与对照组相比还是显著升高的(图5).谷胱甘肽总量变化与GSSG变化相似,低浓度组与对照组没有差异,高浓度组显著升高.

图5 菲对斜生栅藻GSH和GSSG的影响Fig.5 GSH and GSSG contents in S.obliquus under phenanthrene exposure
2.5 菲对斜生栅藻MDA含量的影响
菲诱导对斜生栅藻MDA含量的影响表明,各暴露组均诱导MDA含量升高,随着菲浓度增大,MDA含量也随之增大,暴露浓度≥0.025 mg/L时与对照组相比具有显著性差异(P<0.05),暴露浓度为0.1 mg/L时,MDA含量最高,为对照组的1.85倍(图6).
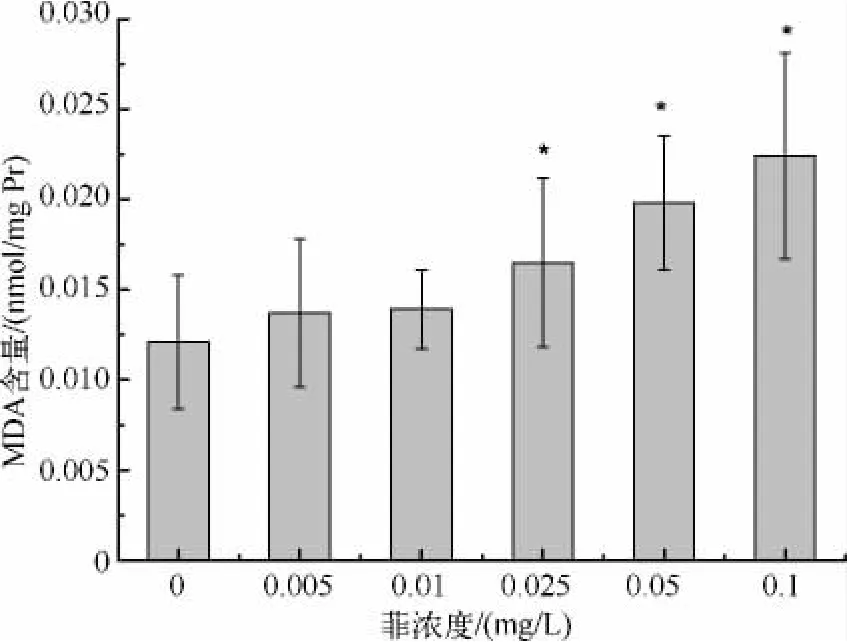
图6 菲暴露对斜生栅藻MDA含量的影响Fig.6 MDA content in S.obliquus under phenanthrene exposure
3 讨论
水体中的污染物对藻类生长产生胁迫作用,这种胁迫作用的程度直观地反映在对藻细胞生长的促进或抑制作用上.低浓度污染物对藻类产生刺激作用是一种普遍现象,Stebbing称之为“毒物的兴奋效应”或“毒物刺激作用”[14],例如,丙体“六六六”浓度小于0.2 mg/L时对斜生栅藻生长有促进作用,在0.2 mg/L时则表现为抑制作用[15].赵云英[16]的研究表明,当藻类暴露于PAHs时,一般会导致叶绿素浓度的迅速下降、细胞和无机组分发生变化,影响细胞分裂速度,造成细胞密度的改变.在本研究中,菲的暴露已经造成藻细胞密度的降低,可能是在实验所设置的暴露浓度中,菲对斜生栅藻的暴露浓度已经超过毒物刺激作用的浓度,对藻的生长产生了抑制作用.
有研究认为,水生生物在分解多环芳烃时会产生大量的自由基中间产物[17],这些中间产物可与核酸、蛋白质等共价联结,产生毒性作用,使细胞DNA受到损伤,引起畸变、死亡,近年来的许多研究结果支持这一观点.PAHs进入生物体,与芳烃接受体(AhR)和细胞色素P450结合,导致自由基的产生[18],这些自由基可以攻击细胞DNA、蛋白质和生物膜系统,可以使叶绿体膜断裂,基质外漏,造成代谢紊乱,导致细胞变异或机体死亡.EPR测定自由基的技术日趋成熟,研究表明,自由基的产生对污染物比较敏感,可作为潜在的生物标志物[19].本实验中EPR测得的自由基,根据其特征该g因子的自由基可能是半醌类自由基或者多环芳烃自由基[20],两者皆为多环芳烃代谢过程中的产物.这种EPR直接测得的自由基信号较直观地反映了藻类产生的主要自由基的量,随着暴露浓度的升高,自由基的量明显增加,进一步说明产生自由基是多环芳烃代谢并对藻产生毒性的过程.自由基产生会引起抗氧化系统的相应变化,通过酶促和非酶促保护系统使自由基的产生和消除维持动态平衡.SOD、POD和GST酶是生物体内重要的保护酶,能清除逆境胁迫所诱导产生的过多自由基,保护细胞免受伤害[21],其活性的应激性变化被广泛作为反映生物受逆境胁迫程度的重要指标.菲暴露导致生物体逆境胁迫,产生大量自由基,SOD、POD活性在菲暴露浓度范围内被诱导增强,对自由基清除发挥了较大的作用.
作为生物体内抗氧化系统的重要成分之一,GSH可以直接与生物体内的自由基及亲电化合物结合起解毒作用,在生物体内的解毒代谢中起着重要的作用.在氧化状态下,GSH一方面被氧化成GSSG,表现为相应GSH/GSSG的降低;另一方面,GSH与外源毒物及其代谢物发生结合反应,最终生成硫醇脲酸排出,此时仅为相应GSH下降,而GSSG变化可能并不大,或者因GSH消耗而GSSG也降低[6].在本实验中,GSH含量处于由于菲暴露而产生的适应性诱导反应,GSH含量升高的同时也诱导GST活性增强,并且在高浓度菲暴露时使得GSSG含量也升高.高含量的GSSG又可以通过还原反应生成GSH,更好地在生物体内起到自由基清除剂的作用.Oost等[22]经过大量调查研究证实生物体GSH、GSH/GSSG比值对污染相当敏感,可以考虑作为污染的生物检测指标.本实验中,GSH和GSH/GSSG比值在0.025 mg/L菲暴露时产生显著差异,并不比其他指标更敏感.
菲暴露下斜生栅藻产生自由基,在抗氧化系统酶和非酶类抗氧化剂的共同作用下,自由基得到一定的缓解清除,但是自由基含量过高或者生成速度大于清除速度时,就会对机体造成不同程度的伤害,膜脂过氧化也是伤害之一,MDA在细胞内的累积量通常被用来作为膜脂过氧化程度的指标,本实验中,随着暴露浓度的增加MDA含量随之增加,说明藻细胞受到氧化胁迫,同时MDA本身也会加剧藻细胞的伤害,使蛋白质的结构和催化功能发生变化并且抑制蛋白质的合成,使细胞遭受逆境伤害.
近年来大量的研究在探讨自由基及抗氧化系统指标是否可用作生物标志物,从而对污染物的暴露和毒性效应进行早期预警[23-24].研究发现抗氧化系统酶及非酶类抗氧化剂对环境中的污染物的确比较敏感,在低浓度即已表现出显著的诱导或抑制作用,与其他指标相比,GST酶更敏感,这与本研究类似,在低浓度菲暴露时(0.005 mg/L),GST酶即已显著诱导.但是,一般认为较为敏感的GSH等指标,在菲对斜生栅藻的暴露中并不比其他指标更敏感.尹颖等[25]在研究多环芳烃对沉水植物的损伤时发现GSH/GSSG指标不仅在低浓度暴露时显著抑制,而且随着暴露浓度的增加线性降低,但对藻类的影响并不如此.因此,在考虑将抗氧化系统指标作为敏感生物标志物时,应考虑生物种以及实际生态环境的差异.
综上所述,自由基和抗氧化系统指标虽然被认为在分子水平上反映生物体的胁迫效应,但是在斜生栅藻对菲暴露的生物应激反应中并不比生长指标更敏感,与其它水生生物不同,斜生栅藻的毒性损伤更直观地反映在细胞生长密度上.EPR直接检测自由基虽然不能像自旋捕获技术那样给自由基定性,但是它既能根据参数确定自由基的大概种类,又能反映藻细胞内自由基的总量,进一步推断藻细胞受损伤的程度.
[1]Agrawal SB,Agrawal M,Lee EH.Changes in polyamine and glutathione contents of a green algae,Chlorogonium elongatum(Dang)france exposed to mercury.Environmental and Experimental Botany,1992,92(2):145-151.
[2]王朝晖,谢 骏,姜 珊等.商品氯氰菊酯对斜生栅藻生长的影响及其生理生化效应.中国环境科学,2012,32(4):429-435.
[3]Wang Z,Yang Y,Yue W et al.The growth behavior of three marine phytoplankton species in the presence of commercial cyermethrin.Ecotoxicology and Environmental Safety,2010,73:1408-1414.
[4]Ko SC,Kim D,Jeon YJ.Protective effect of a novel antioxidative peptide purified from a marine Chlorella ellipsoidea protein against free radical-induced oxidative stress.Food and Chemical Toxicology,2012,50:2294-2302.
[5]Özyürek M,Bektaşogˇlu B,Güçlü K et al.Hydroxyl radical scavenging assay of phenolics and flavonoids with a modified cupric reducing antioxidant capacity(CUPRAC)method using catalase for hydrogen peroxide degradation.Analytica Chimica Acta,2008,616:196-206.
[6]Charlton A,To mlin AS,Routledge MN.The role of free radicals and polycyclic aromatic hydrocarbons in driving urban particulate matter genotoxicity.Mutagenesis,2012,27:122-122.
[7]Garnczarska M,Bednarski W.Effect of a short-term hypoxic treatment followed by re-aeration on free radicals level and antioxidative enzymes in lupine roots.Plant Physiology and Biochemistry,2004,42:233-240.
[8]Beauchamp C,Fridovich I.Superoxide dismutase:improved assay and assay applicable to acrylamidegels.Analytical Biochemistry,1971,44:276-287.
[9]Siesko MM,Fleming WJ,Grossfeld RM.Stress protein synthesis and peroxidase activity in a submersed aquatic macrophyte exposed to cadmium.Environmental Toxicity and Chemistry,1997,16(8):1755-1760.
[10]Habig WH,Pabst MJ,Jakoby WB.Glutathione-S-transferases:The first enzymatic step in mercapturic acid formation.Journal of Biologial Chemistry,1974,249:7130-7139.
[11]Hissin PJ,Hilif R.A fluorometric method for the direct determination of oxidized and reduced glutathione in tissues.Analytical Biochemistry,1976,74:214-226.
[12]Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Analytical Biochemistry,1976,72:248-254.
[13]Peever TL,Higgins VJ.Electrolyte leakage,lipoxygenase,and lipid peroxidation induced in tomato leaf tissue by specific and non specific elicitors from Cladosporium fluvum.Plant Physiology,1989,90:867-875.
[14]Stebbing ARD.Hormes is the stimulation of growth by low levels of inhibitions.Science of the Total Environment,1982,22:213-234.
[15]刘碧云,周培疆,李佳洁等.丙体六六六对斜生栅藻生长及光合色素和膜脂过氧化影响的研究.农业环境科学学报,2006,25(1):204-207.
[16]赵云英.PAHs在自然环境中的迁移转化和生态效应.海洋环境科学,1998,17(2):68-71.
[17]Tukaj Z,Aksmann A.Toxic effects of anthraquinone and phenanthrenequinone upon Scenedesmus strains(green algae)at low and elevated concentration of CO2.Chemsphere,2007,66:480-487.
[18]Giannapas M,Karnis L,Dailianis S.Generation of free radicals in haemocytes after mussels after exposure to low molecular weight PAH components:lmmune activation,oxidative and genotoxic effects.Comparative Biochemistry and Physiology C,2012,155:182-189.
[19]Luo Y,Su Y,Lin RZ et al.2-chlorophenol induced ROS generation in freshwater fish Carassius auratus based on the EPR method.Chemosphere,2006,65:1064-1073.
[20]赵保路.氧自由基和天然抗氧化剂(修订版).北京:科学出版社,1998:24-27.
[21]周长芳,吴国荣,施国新等.水花生抗氧化系统在抵御Cu2+胁迫中的作用.植物学报,2001,43(4):389-394.
[22]Oost RVD,Beyer J,Vermeulen NPE.Fish bioaccumulation and biomarkers in environmental risk assessment:a review.Environmental Toxicology Pharmacology,2003,13:57-149.
[23]王晓蓉,罗 义,施华宏等.分子生物标志物在污染环境早期诊断和生态风险评价中的应用.环境化学,2006,25(3):320-325.
[24]Fonseca VF,Franca S,Vasconcelos RP et al.Short-term variability of multiple biomarker response in fish from estuaries:Influence of environmental dynamics.Marine Environmental Research,2011,72:172-178.
[25]Yin Y,Wang XR,Yang LY et al.Bioaccumulation and ROS generation in Coontail Ceratophyllum denersum L.exposed to phenanthrene.Ecotoxicology,2010,19:1102-1110.

