碱金属单质还原能力与还原活性顺序差异的讨论
刘旭青 张树永
(山东大学化学与化工学院 山东济南 250100)
师生笔谈
碱金属单质还原能力与还原活性顺序差异的讨论
刘旭青 张树永
(山东大学化学与化工学院 山东济南 250100)
摘要对水溶液体系中影响碱金属还原能力和还原活性的因素进行了理论分析。结果表明,碱金属的电极电势主要由焓控制,而离子的溶剂化焓对其还原能力影响很大。碱金属的活性顺序主要受第一电离能和原子化焓影响。还原能力和活性决定因素的差异导致碱金属电极电势和活性顺序的差异。
关键词碱金属 电极电势 活性 热力学 动力学
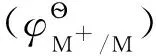

表1 碱金属的基本物理性质[1]
1 电极电势的热力学分析
(1)∗文献中的电极电势一般为还原电极电势,而本文中碱金属离子生成反应为氧化反应,自由能变符号正好相反,所以式(1)中不带负号。
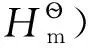
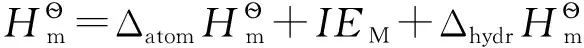
(2)
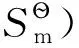
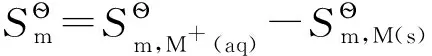
(3)

图1 水溶液中碱金属离子生成的Born-Haber循环
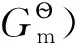
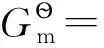
(4)
若考虑电子在整个过程中的变化e-(M)→e-(g),则要计算电子被电极固定的自由能变∑。
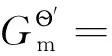
(5)
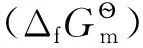
的自由能变为:

(6)
将式(6)代入式(1),整理得:
(7)
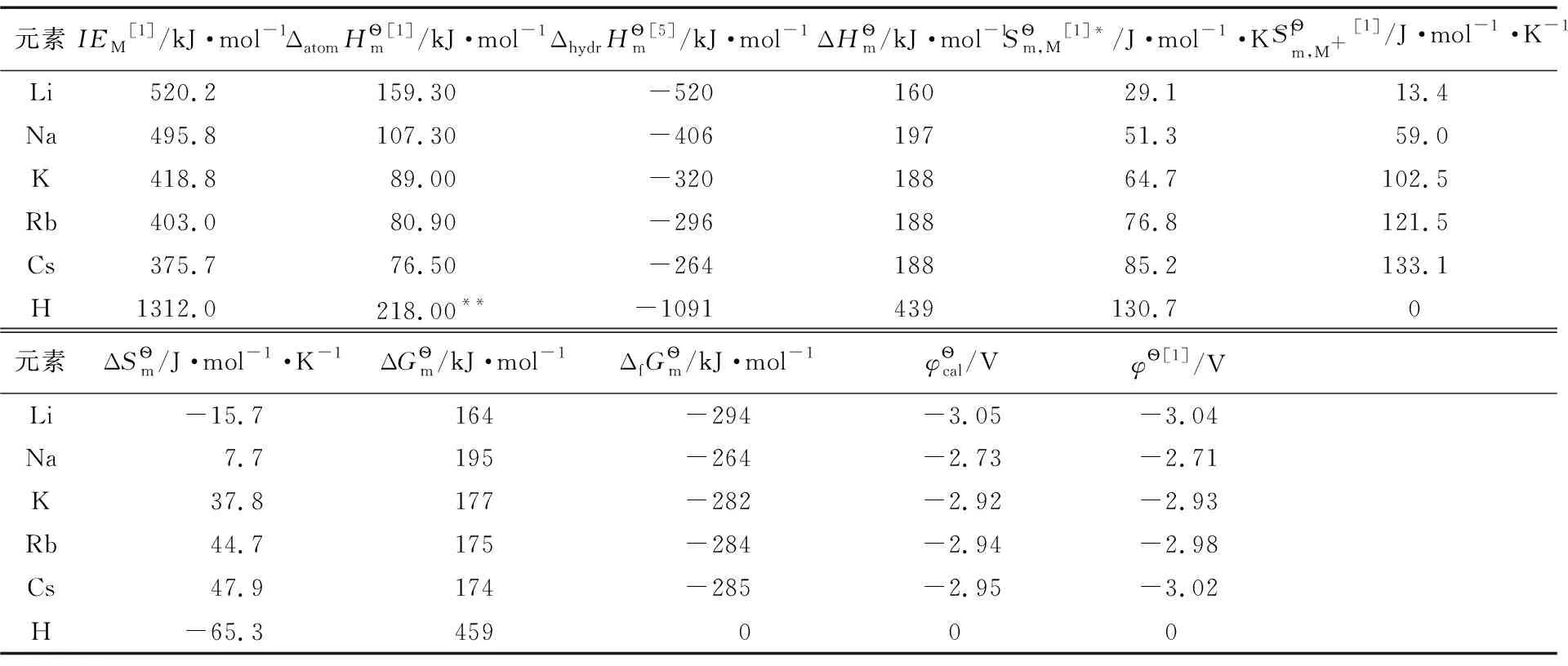
表2 热力学数据处理表
*单质的熵:对于碱金属,指其晶体在298.15K时的熵;对于H,指H2在298.15K时的熵。
**指H2(g)→H(g)过程的焓变。
表2显示,熵的影响并不明显,虽然电离能相差很大,但其影响基本上被水化焓的差异所抵消。这表明,碱金属电极电势不仅与单质自身性质有关,还受离子水化作用的显著影响。离子的水化作用是决定碱金属电极电势的重要因素。
碱金属离子是硬酸,其LUMO轨道能量较高;水分子是硬碱,其HOMO轨道能量较低,两者不满足能量相近原则,很难形成稳定化学配键,所以两者之间的相互作用主要为电性作用[6]。从Cs+到Li+,外层电子减少导致屏蔽作用下降,使有效核电荷数增加,加之离子半径减小(表1),两个因素共同导致离子的场强增加,使得金属与水分子之间的离子-偶极作用增强,水化焓增大。Li+的半径很小,只有1s轨道,屏蔽作用很小,故其水化焓远高于同族其他元素的离子,使Li在水溶液中的标准电极电势大为降低,成为电极电势最负、还原性最强的金属。
2 反应活性的动力学分析
要解释碱金属与水反应的现象需要考虑其反应机理。碱金属与水反应有两种不同机理,一是碱金属与水发生异相反应,可用腐蚀原电池模型描述;另一个是原子化的碱金属原子与气化的水分子反应并引发自由基链反应。两种机理构成平行反应。对于小块的金属Li和Na,反应停留在第一种机理主导的诱导反应阶段,不引发爆发式反应;更加活泼的碱金属,因诱导阶段反应更剧烈,且金属更易气化(见表1),可能引发第二种机理。
2.1 腐蚀原电池模型讨论
碱金属与水的反应可用析氢腐蚀原电池描述如下:
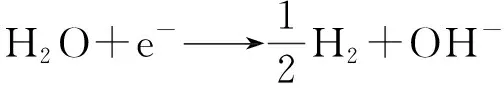
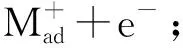

(8)
i0=nFr
(9)
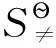
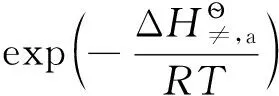
(10)[4]
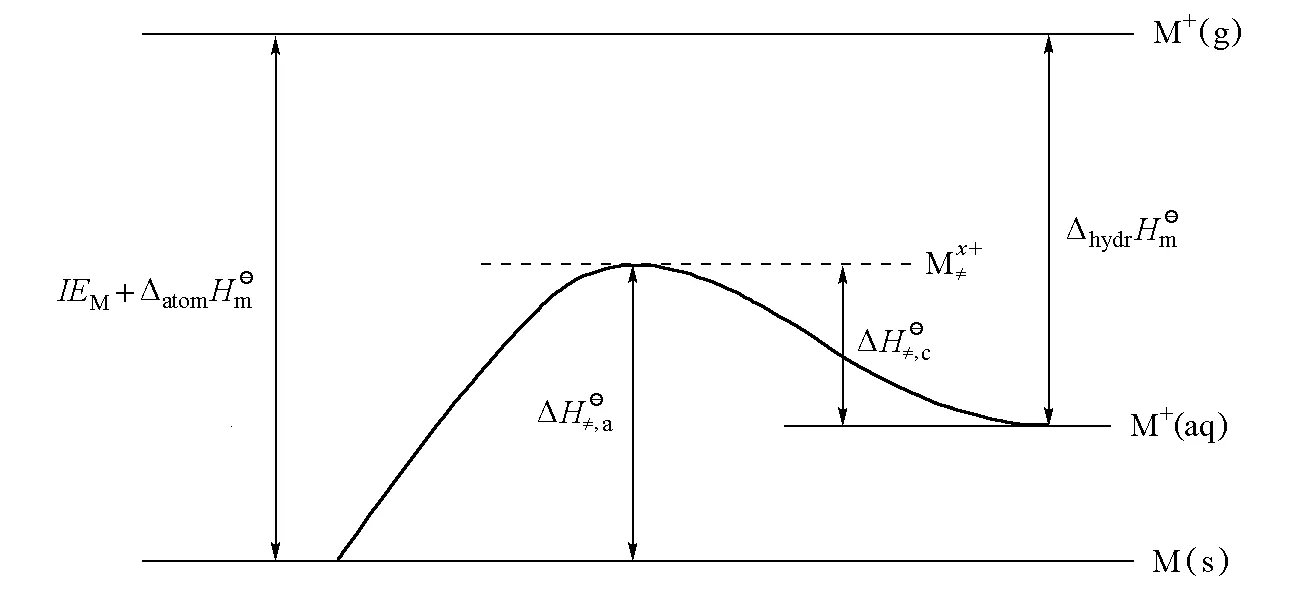
图2 阳极电化学过程过渡态示意图

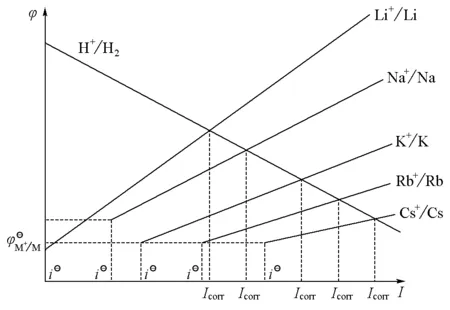
① 表观电荷(x)满足0 结合式(9)和式(10),可预测碱金属腐蚀反应中的交换电流密度大小顺序为: 当碱金属以不同速率与水反应时,会处于不同的极化状态。极化状态对反应活化能的影响如图3所示。 图3 超电势对过渡态影响示意图 (11) 表3 离子水化焓与电离能、原子气化焓之和的比值 假设析氢反应的Tafel公式斜率不随阳极改变而变化,则根据上述分析可得图4所示的腐蚀电势与腐蚀电流的关系。 图4 腐蚀电势与腐蚀电流关系示意图 碱金属与水的自由基反应,其链引发步骤为: H·可以进一步与水分子、MOH、M、O2生成·OH、O·等自由基,实现自由基的传递与支链增殖。如果链反应能够传递下去,则反应会越来越剧烈而致剧烈燃烧或发生爆炸。但是H·寿命极短,如果没有足够的浓度,无法引发链反应,这就要求气态反应物有足够的蒸气压。 有报道称[8],K在没有O2存在时,反应剧烈程度大大降低,而Li受影响很小,Rb和Cs遇水依然会发生爆炸。这是因为O2在自由基增殖过程中起重要作用: 故缺少O2会影响自由基反应的剧烈程度。Li与水的反应不是自由基链反应,故不受O2影响;Rb、Cs在无氧条件下,自由基反应仍足够剧烈,所以依然会发生爆炸。 碱金属的还原能力是热力学性质。碱金属离子的生成过程是焓控制过程,离子溶剂化焓对碱金属还原能力的影响很大,Li+的高水化焓使其成为水溶液体系中还原能力最强的金属。碱金属的还原活性是动力学性质,主要与第一电离能及原子化焓相关。其中,第一电离能及原子化焓与诱导过程中的腐蚀反应活化焓及过渡态结构有密切联系,决定腐蚀反应的交换电流密度和Tafel斜率;原子化焓与诱导反应热功率及气态反应物的蒸气压紧密相关,决定自由基反应的剧烈程度。由此可以看出,决定碱金属还原能力和还原活性的因素不同,这就造成了碱金属的还原能力和还原活性排序的差异。 参 考 文 献 [1] Haynes W M.CRC Handbook of Chemistry and Physics.91st ed.Boca Raton,Fla.:CRC Press/London:Taylor & Francis [distributor],2010 [2] Huston R,Butler J N.JPhysChem,1968,72(12):4263 [3] Giordano G M,Longhi P,Mussini T,etal.JChemThermodynamics,1977,9(10):997 [4] 傅献彩,沈文霞,姚天扬,等.物理化学.第5版.北京:高等教育出版社,2005 [5] Dasent W E.Inorganic Energetics.2nd ed.NY:Cambridge University Press,1982 [6] Minkin V I.JPureApplChem,1999,71(10):1919 [7] Zumdahl S S.Chemical Principles.4th ed.Boston:Houghton Mifflin Com,2002 [8] Quaino P M,de Chialvo M R G,Chialvo A C.ElectrochimActa,2007,52(25):7396 [9] 王朝远.化学教育,2000(Z1):85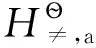

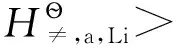


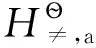
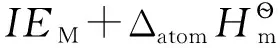

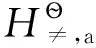
2.2 碱金属与水反应的自由基机理讨论



3 结论

