桃蚜体内酶活性对SO2胁迫的响应
姜文虎,刘军侠,赵俊红,李超丽
(河北农业大学林学院,河北保定071000)
自20世纪80年代以来,许多学者开始关注大气污染对昆虫种群和群落的影响[1-2],相继研究了SO2胁迫对植食性墨西哥豆瓢虫(Epilachna varivestis Mulsant)[3-4]、粘虫[Mythimna separata(Walker)][5]、靖远松叶蜂(Diprion jingyuanensis Xiao et.Zhang)[6]、蚜虫(Aphidinea)[7-8]、蚧虫(Coccoidae)[9]等的影响.结果表明,SO2能促进这些害虫的生长发育,增大其取食量和蛹质量,提高食物转化率和成虫生殖力等,从而增大害虫种群数量.SO2对不同昆虫种类的作用有所差异.以往研究表明,SO2胁迫能缩短桃蚜[Myzus persicae(Sulzer)]的龄期,对桃蚜的繁殖有一定促进作用,有利于桃蚜种群发生[10],并能影响其天敌异色瓢虫[Harmonia axyridis(Pallas)]的生长发育[11].但有关SO2对昆虫体内酶系活性影响的报道甚少.为此,本文研究SO2处理对桃蚜成虫体内保护酶、解毒酶以及蛋白酶活性的影响,以便进一步明确SO2对桃蚜的作用机制,为SO2胁迫下害虫的综合治理提供依据.
1 材料与方法
1.1 供试植物及蚜虫
供试植物:自河北省保定市农业科学研究所苗圃地购盆栽茄子(Solanum melongena L.)备用.待茄苗长至5-6叶时用于试验,适时浇水,试验期间不施用化肥和农药.
供试蚜虫:采河北农业大学苗圃地桃树的无翅桃蚜接种于盆栽茄子苗上,扩大种群以备用.
1.2 SO2熏气处理
熏气装置为自制木架,长×宽×高为70 cm×50 cm×120 cm,从上到下分3层,高分别为20、38、45 cm,外罩聚乙烯塑料布.气源为北京氦普北分气体有限公司生产的国家级标准SO2,气体浓度为1%,N2为平衡气,气体从钢瓶经减压阀、流量计等装置进入熏气室.参考大气中SO2浓度,并依据预实验SO2对茄苗和蚜虫的影响,设5 个 SO2熏气浓度:0(CK)、42.75、85.50、128.25 和 213.75 mg·m-3,按熏气室体积计算SO2充气浓度,同时用SO2检测仪即时检测气体浓度.每个熏气室为一个浓度处理,每天按时充气至设定浓度,直到试验结束.实验室温度为20-28℃,湿度为70% -85%.
1.3 桃蚜饲养方法
群体饲养:将初孵若蚜自然接种到不同处理的茄子叶片上(每片叶20头),每个处理3盆并选3片叶子标记,每日观察、标记叶片上蚜虫的蜕皮、各龄期数量及死亡情况.待出现成蚜(5 d)后,分别选取成蚜和茄苗叶片于-70℃冷冻备用.
1.4 酶活性测定
1.4.1 桃蚜酶源制备 称量冷冻桃蚜0.1 g,加入0.05 mol·L-1pH 7.0的磷酸缓冲液10 mL.冰浴下匀浆,4 ℃、10000 r·min-1离心 30 min,取上清液作为酶源.
1.4.2 酶活性测定 超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)、蛋白酶、乙酰胆碱酯酶(acetylcholinesterase,AChE)和羧酸酯酶(carboxylesterase,CarE)、谷胱甘肽-S-转移酶(glutathione-S-transferase,GSTs)活性的测定参考文献[12-15],均设置3次重复.
1.4.3 茄苗酶源制备 称取样品0.1 g,加入适量蒸馏水(约5 mL),充分研磨,3000 r·min-1离心5 min.将上清液移至小试管中,振荡混匀作为酶液.
1.4.4 茄苗可溶性蛋白质含量测定 利用考马斯亮蓝G-250法[16]测定茄苗可溶性蛋白质含量.设置3次重复.
1.5 数据统计
采用Microsoft Excel 2003软件处理数据,并用DPS软件进行统计分析,差异显著性比较使用Duncan's新复极差法.
2 结果与分析
2.1 SO2对桃蚜体内保护酶活性的影响
2.1.1 SO2对SOD活性的影响 图1表明,低浓度SO2处理可以显著促进桃蚜体内SOD活性;随着SO2浓度升高,SOD 活性逐渐降低.其中,42.75 mg·m-3SO2处理后桃蚜体内SOD活性最高,为对照的2.14倍,差异达极显著水平(P <0.01).这是由于在低浓度SO2处理下,桃蚜体内O2消耗量增大,导致虫体内HO-大量增多,并迅速做出免疫反应,表现为SOD活性明显上升,以清除体内的过量自由基;而随着SO2浓度的增大,SOD的合成能力受到抑制,其活性逐渐下降.
2.1.2 SO2对POD活性的影响 从图2可以看出,经不同浓度SO2处理后,桃蚜体内POD活性均有所提高.其中,42.75、85.50、213.75 mg·m-3SO2处理与对照相比差异达极显著水平(P <0.01),128.25 mg·m-3SO2处理与对照差异不显著(P>0.05).这表明SO2处理后,桃蚜体内产生有毒物质,启动免疫系统合成POD,以维持正常的生理功能.
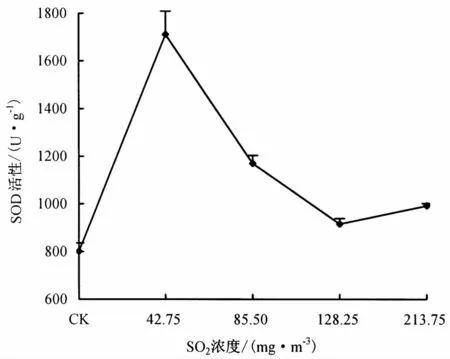
图1 SO2对桃蚜体内SOD活性的影响Fig.1 Effect of SO2on the SOD activity in M.persicae
2.1.3 SO2对CAT活性的影响 从图3可以看出,不同浓度SO2处理后的CAT活性均高于对照,其中仅85.50 mg·m-3SO2处理与对照差异显著(P <0.05),其他处理差异均不显著(P >0.05).
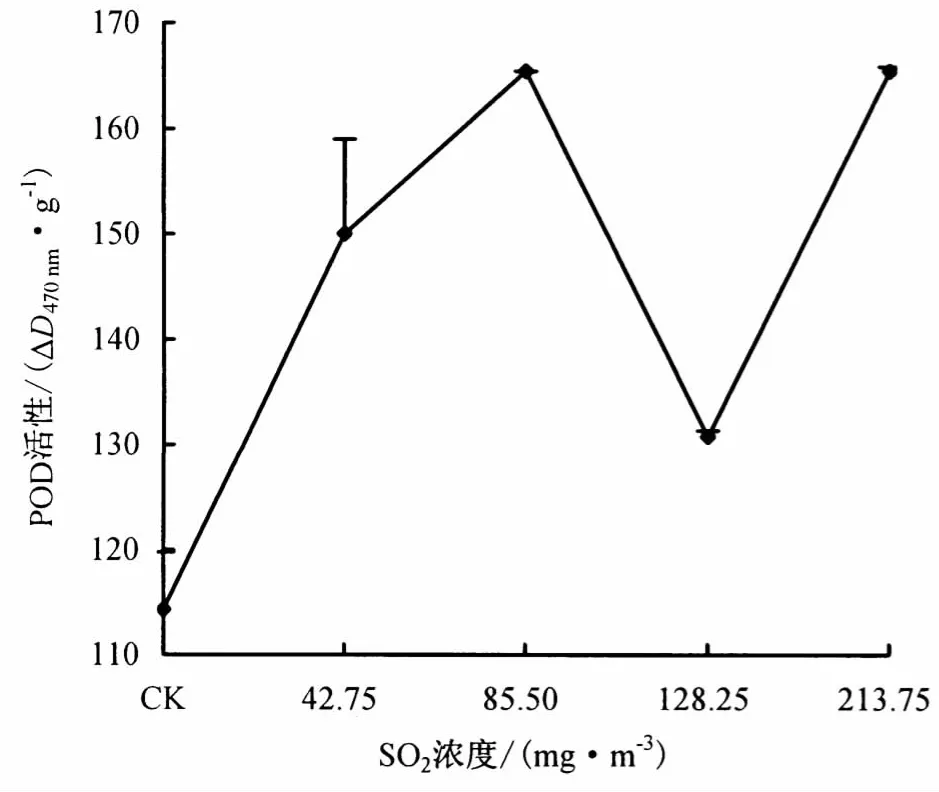
图2 SO2对桃蚜体内POD活性的影响Fig.2 Effect of SO2on the POD activity in M.persicae

图3 SO2对桃蚜体内CAT活性的影响Fig.3 Effect of SO2on the CAT activity in M.persicae
2.2 SO2对桃蚜体内CarE、GSTs及AChE活性的影响
由表1可见,42.75 mg·m-3SO2处理后桃蚜体内的CarE活性升高,与对照差异达显著水平(P<0.05);随着SO2浓度的增大,CarE活性呈下降趋势,85.50和128.25 mg·m-3SO2处理与对照无显著差异(P >0.05);213.75 mg·m-3SO2处理后的 CarE 活性极显著降低(P <0.01).
SO2处理后桃蚜体内GSTs活性变化较为明显.其中,42.75 mg·m-3SO2处理后的GSTs活性升高,且与对照差异显著(P<0.05);85.50 mg·m-3SO2处理后的GSTs活性下降,与对照差异不显著(P>0.05);128.25 mg·m-3SO2处理后的 GSTs活性又升高,且极显著高于对照(P <0.01);213.75 mg·m-3SO2处理后的GSTs活性又下降,且与对照差异不显著(表1).
不同浓度 SO2处理均能提高 AchE 活性,42.75、85.50、128.25 和 213.75 mg·m-3SO2处理后的 AchE活性分别是对照的 3.64、3.33、4.25 和 2.72 倍,但差异均未达到显著水平(表 1).
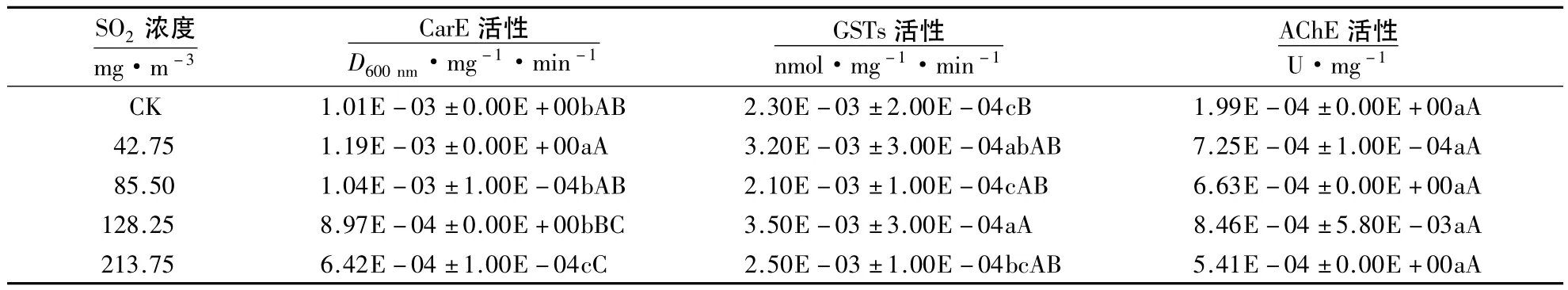
表1 SO2对桃蚜体内CarE、GSTs及AChE活性的影响1)Table 1 Effects of SO2on the activities of CarE,GSTs and AChE
2.3 SO2对茄苗蛋白质含量及桃蚜蛋白酶活性的影响
2.3.1 SO2对茄苗可溶性蛋白质含量的影响 从图4可见,茄苗可溶性蛋白质含量与SO2浓度呈极显著正相关关系(P<0.01),其随SO2浓度的增大而上升.蛋白质营养状况对生物转化过程的影响较为明显,特别是蛋白质营养不足时,各种催化酶类活性将有所降低,影响其代谢转化能力.
2.3.2 SO2对桃蚜蛋白酶活性的影响 如图5所示,不同浓度SO2处理均能增强桃蚜蛋白酶的活性.其中,42.75 mg·m-3SO2处理后的桃蚜蛋白酶活性最高,与对照差异达显著水平(P<0.05);随着SO2浓度的升高,桃蚜蛋白酶活性降低,与对照相比,差异均未达显著水平(P>0.05).这可能与茄苗蛋白质含量的增大有关.
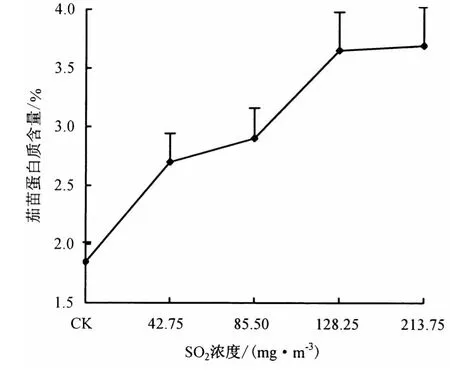
图4 SO2对茄苗可溶性蛋白质含量的影响Fig.4 Effect of SO2on the soluble protein content in eggplant seedlings

图5 SO2对桃蚜蛋白酶活性的影响Fig.5 Effect of SO2on the protease activity in M.persicae
3 结论与讨论
尽管国内外已研究了SO2变化对于植物、昆虫的影响,但SO2促进某些植食性昆虫生长的机制尚不明确.Bolsinger et al[17]和 Dohmen et al[18]报道,SO2污染会改变植物的代谢,使植物的游离氨基酸浓度或糖含量发生不同程度的变化.植物组织中的糖类是昆虫生命活动的主要能源底物,氨基酸和蛋白质是昆虫生长发育必不可少的物质,一般认为,SO2污染对某些植食性昆虫生长的促进作用,是通过影响寄主植物中这些成分的含量而间接发生的[19-20].本试验结果表明,SO2能增大茄苗可溶性蛋白质含量,这会增大细胞渗透浓度和功能蛋白的数量,有助于维持细胞正常代谢,很可能是植物抵抗SO2污染的一种解毒机制;42.75 mg·m-3SO2处理后的桃蚜蛋白酶活性显著升高,其他浓度也能促进桃蚜蛋白酶活性,但未达显著水平,表明随着寄主植物蛋白质含量的增大,以寄主为食的桃蚜体内的蛋白酶含量相应增多,但存在浓度效应.寄主植物营养成分的变化很复杂,可能影响以寄主为食的昆虫生长发育及其体内各种酶的变化,这些均有待深入研究.
昆虫与其他生物体一样,体内存在自由基,在逆境条件下,自由基会增多,对体内功能分子的破坏作用加大.而昆虫体内的保护酶有清除自由基的作用,使其保持在一个较低水平,从而防止自由基毒害;CarE、谷胱甘肽转移酶是害虫体内重要的解毒酶系,在对外源化合物的解毒代谢和杀虫剂的抗性机制中起着重要作用;AChE是抑制神经传导的水解酶,该酶系的变异,能导致害虫耐药能力和抗性水平增强.本试验表明,42.75 mg·m-3SO2能显著促进桃蚜体内SOD、POD、CarE和GSTs的活性,对CAT促进作用不显著;85.50 mg·m-3SO2对3种保护酶活性均有显著促进作用,对CarE、GSTs及AChE活性均无显著影响;128.25 和213.75 mg·m-3SO2处理后,桃蚜体内保护酶活性与对照差异不显著(除213.75 mg·m-3SO2可以显著促进 POD 活性外),同时,128.25 mg·m-3SO2可以极显著促进 GSTs活性,213.75 mg·m-3SO2可以极显著抑制CarE活性.由此可见,SO2可以促进桃蚜体内主要解毒酶和保护酶活性升高,但其存在浓度效应.此结论与赵俊红等[10]的研究结果吻合,说明桃蚜受到SO2胁迫后,其体内酶系自我调节能力迅速增强,以维持机体正常生理功能,但存在SO2阈值.
[1]VETELI T O,KUOKKANEN K,JULKUNEN-TIITTO R,et al.Effects of elevated CO2and temperature on plant growth and herbivore defensive chemistry[J].Global Change Biol,2002,8:1240 -1252.
[2]WATT A D,WHITTAKER J B,DOCHERTY M.The impact of elevated atmospheric CO2on insect herbivores[M]∥HARRINGTON R,STORK S E.Insects in A Changing Environment.London:Academic Press,1995:197 -217.
[3]吴亚,EDWARD H L,EDWARD M B.二氧化硫对墨西哥豆瓢虫的影响[J].生态学报,1989,9(4):336.
[4]HUGHES P R,CHIMENT J J,DICKIE A I,et al.Effect of pollutant dose on the response of Mexican bean beetle to SO2induced changes in soybean[J].Environ Entoml,1985,14(6):718 -721.
[5]吴坤君,龚佩瑜,李秀珍,等.SO2熏蒸小麦对粘虫生长的影响[J].环境科学学报,1990,10(1):78-83.
[6]张真,张云,王鸿斌,等.二氧化硫污染对靖远松叶蜂暴发的促进作用研究[J].林业科学,2002,38(6):66-73.
[7]李秀珍,吴坤君,龚佩瑜,等.SO2污染油菜对桃蚜实验种群生长的影响[J].生态学报,1992,12(2):135-139.
[8]GALECKA B.Phenological development of Frangula alnus Mill.in an industrial region and the number of Aphis frangulae Kalt[J].Polish Ecological Studies,1984,10:141 -155.
[9]谢映平,薛皎亮,刘红霞,等.低浓度城市污染物二氧化硫和铅在大球蚧及寄主国槐体内积累的研究[J].林业科学,1998,34(1):45 -49.
[10]赵俊红,刘军侠,姜文虎,等.SO2胁迫对桃蚜生长发育的影响[J].中国农学通报,2010,26(17):145-148.
[11]赵俊红,刘军侠,姜文虎,等.SO2胁迫对异色瓢虫的生长发育及保护酶的影响[J].河北农业大学学报:自然科学版,2011,34(1):87 -91.
[12]王峰.粘虫体内保护酶系统活力的研究[D].西安:陕西师范大学,2001.
[13]BRADFORD M M.A rapid and sensitive method for the quantiation of mierogram quantities of protein unitizing the principle of protein dye binding[J].Anal Bichem,1976,72:248 -254.
[14]Ellman G L,Courtney K D,Andress V,et al.A new and rapid colorimetric determination of acetylcholinesterase activity[J].Biochem Pharmacol,1961,7:88 -95.
[15]慕立义.植物化学保护研究方法[M].北京:农业出版社,1994:160-161.
[16]韩靖玲,庞保平,庞琢.南美斑潜蝇对不同茄子品种的选择性及其机理的研究[J].内蒙古农业大学学报:自然科学版,2005,26(3):29 -32.
[17]BOLSINGER M,FLUCKIGER W.Ambient air pollution induced changes in amino acid patter of phloem sap in host plants relevance to aphid infestation[J].Environ Pojjut,1989,56(3):209 - 216.
[18]DOHMEN G P,MCNEILL S,BELL N B.Air pollution increases Aphis fabae pest potential[J].Nature,1984,307:52 -53.
[19]吴坤君.空气污染对昆虫的影响[J].昆虫知识,1988,25(2):122 -127.
[20]ALSTAD D N.Effects of air pollution on insect populations[J].Ann Rev Ent,1982,27:369 -384.
