黄酮类化合物与α-羟乙基过氧自由基反应的脉冲辐解研究
张福根 周瀚洋 彭 静 吴季兰
(北京大学化学与分子工程学院应用化学系,北京100871)
1 引言
生物体新陈代谢过程中会产生大量的自由基,这些自由基可以与不饱和脂肪酸反应生成脂质过氧自由基,而脂质过氧化反应(LPO)是导致许多病理现象的主要原因.1研究发现,广泛存在于植物界、含有γ-吡喃酮母体结构的低分子量黄酮类化合物是有效的自由基清除剂和LPO抑制剂.2-5目前对于黄酮类化合物与过氧自由基反应的机理主要有以下两种观点:一种比较流行的观点是单电子氧化机理,6-9即过氧自由基与黄酮类化合物发生电子转移反应,并夺取酚羟基的氢,生成的酚氧自由基再失去电子,生成醌类化合物(如图1所示),同时过氧自由基由于得到了电子或氢原子而被还原.在这个过程中,黄酮类化合物结构中B环邻二羟基是必要的结构,而其它要素如A环羟基和C环双键不起作用或只起促进电子离域的作用,不直接参与反应.但这一机理不能解释B环无羟基的黄酮类化合物如黄岑甙也能有效地清除过氧自由基.10-13此外,也缺少符合物料平衡的终产物分析.
另一种观点14-18认为过氧自由基可与共轭双键或黄酮类化合物的C环双键发生加成反应,加成产物再通过分解或重排等后续反应生成最终产物(如图2所示).
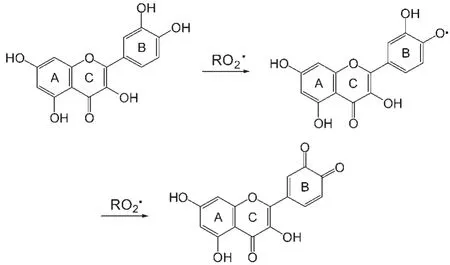
图1 黄酮类化合物与过氧自由基反应的单电子氧化机理Fig.1 One-electron oxidation between flavonoids and peroxyl radicals
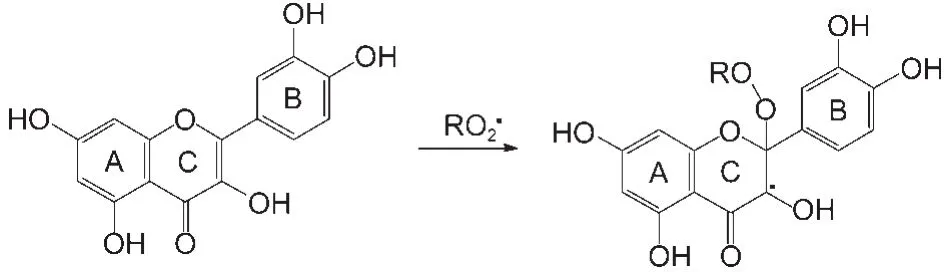
图2 黄酮类化合物与过氧自由基的双键加成反应Fig.2 Possible conjugate addition reaction between flavonoids and peroxyl radicals
究竟以上两种机理哪个更主要,目前还不清楚.因此研究不同结构的黄酮类化合物与有机过氧自由基的反应速率有助于阐明该反应的化学机理.由于许多黄酮类化合物在中性水溶液中的溶解度很低,若滴加碱使之溶解,则体系的pH远远偏离生理条件下的pH,因此我们选择乙醇作为溶剂来研究黄酮类化合物与有机过氧化自由基的反应.在空气或氧气饱和的乙醇中,经过电离辐射后会生成α-羟乙基过氧自由基,可作为有机过氧自由基的模拟物来研究黄酮类化合物与有机过氧自由基的反应.对于α-羟乙基过氧自由基的自身衰减以及它与黄酮类化合物的反应已有报道,19-24但反应多在乙醇的水溶液中进行,仍难以解决溶解度的问题,同时对于α-羟乙基过氧自由基在纯乙醇中的衰减只近似作为二级反应动力学处理,忽视了其实际蜕变过程为一级和二级反应混合类型.
用脉冲辐解的方法可以选择性地产生单一的自由基粒种,并检测其在很短时间内的变化,从而使自由基反应的动力学研究成为可能.25-27我们28已经报道过在乙醇溶液中用脉冲辐解的方法研究α-羟乙基过氧自由基的自身衰减动力学,并得到了其衰减的一级和二级动力学常数.本文继续在乙醇溶液中用脉冲辐解的方法详细研究了α-羟乙基过氧自由基与几种典型的黄酮类化合物以及模型化合物的反应动力学.
2 实验部分
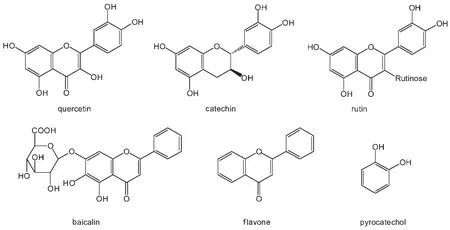
图3 实验中所用黄酮类化合物的结构Fig.3 Chemical structures of flavonoids used in this work
实验中所用的几种黄酮类化合物的化学结构列于图3.所用试剂为槲皮素(quercetin,生化试剂,纯度≥95%,Sigma公司产品),芦丁(rutin,生化试剂,上海试剂二厂,使用前用三次蒸馏水重结晶),黄岑甙(baicalin,化学对照品,中国药品生物制品检定所,使用前用乙醇重结晶),儿茶素(catechin,纯度≥99.0%,Sigma公司产品),黄酮体(flavone,ACROS公司产品),邻苯二酚(pyrocatechol,分析纯,中国军事医学科学院药材供应站)和乙醇(优级纯,北京化工厂).
脉冲辐解采用微秒级脉冲辐解装置(北京师范大学低能物理研究所).29每次辐照前用N2O饱和的硫氰化钾溶液测定脉冲剂量,取Gε480nm[(SCN)2-]=4.41×102eV-1·mol-1·dm3·cm-1(其中,G 为辐射化学G值,即物质每吸收100 eV所变化的分子数.ε480nm表示在480 nm处的摩尔吸光系数).用Igor一级和二级混合反应处理程序30对得到的脉冲辐解数据进行动力学处理.
3 结果与讨论
3.1 α-羟乙基过氧自由基与几种典型的黄酮类化合物的反应
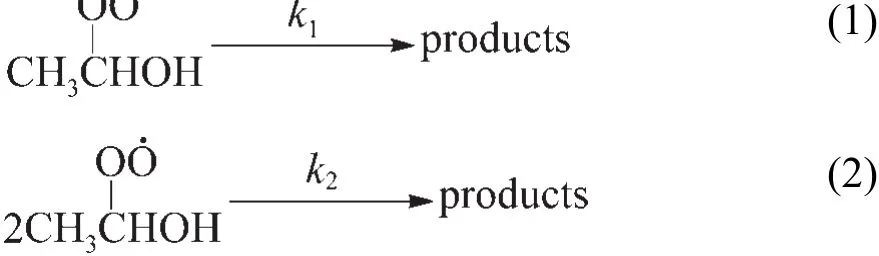
在受到电离辐射时,空气或氧气饱和的乙醇溶液中会产生α-羟乙基过氧自由基.30在脉冲辐解条件下,由于剂量率很大,α-羟乙基过氧自由基浓度较高,它主要通过单分子和双分子两种方式衰减,一级与二级衰减的速率常数分别为k1和k2.28
在260-300 nm范围内,α-羟乙基过氧自由基的最大吸收在270 nm处(图4内插图),但黄酮类化合物一般在285 nm处吸收最低,为了最大限度地降低黄酮类化合物对过氧自由基吸收的干扰,我们选择了285 nm作为检测波长,研究黄酮类化合物的乙醇溶液中有机过氧自由基的动力学行为.
不同浓度的槲皮素乙醇溶液中α-羟乙基过氧自由基的衰减拟合曲线如图4所示.由图4可见,随着槲皮素浓度增加,过氧自由基的衰减速度明显加快.
在黄酮类化合物的乙醇溶液中,经过电离辐照产生的α-羟乙基过氧自由基除了通过一级和二级两种方式衰减之外,还会与黄酮类化合物发生反应:
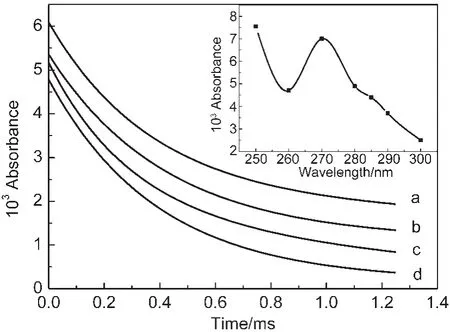
图4 槲皮素浓度对α-羟乙基过氧自由基在乙醇中衰减曲线的影响Fig.4 Effect of concentrations of quercetin on the decay of α-hydroxyl ethyl peroxyl radicals in ethanol

当槲皮素的浓度远远大于有机过氧自由基的浓度时,式(4)可简化为:
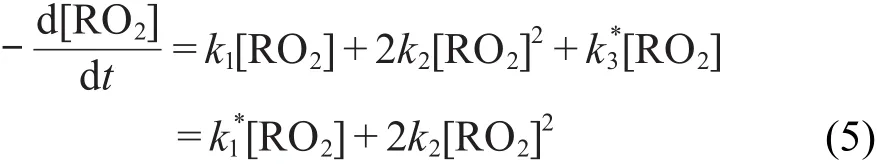
式中表观一级反应速率常数
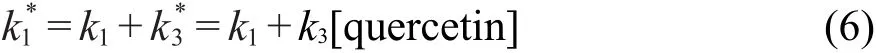
用Igor脉冲辐解数据处理程序对测得的数据进行处理,得到槲皮素不同浓度下的表观一级反应速率常数k*
1,对槲皮素浓度作图,得到一条直线(图5a),直线的斜率即为槲皮素与有机过氧自由基反应速率常数k3,直线的截距则为有机过氧自由基单分子衰减的速率常数k1.本文中其它几种黄酮类化合物与有机过氧自由基的反应也采用同样的方法处理,结果如图5所示.
从图5中得到4种黄酮类化合物与α-羟乙基过氧自由基反应的速率常数k3,列于表1中.
由表1可知,(1)槲皮素和芦丁与有机过氧自由基的反应非常快,同时,比较二者结构可知,C环C3-醣甙的存在与否对反应影响不大;(2)当A环含有C5羟基与C环C2=C3以及B环邻二羟基共存时可以明显提高反应速率;(3)不含有B环邻二羟基的黄岑甙与有机过氧自由基的反应速率常数接近于芦丁以及槲皮素的反应速率常数,而含有B环邻二羟基结构的儿茶素与有机过氧自由基的反应速率常数则要小近1个数量级.这表明在黄酮类化合物与有机过氧自由基的反应中,C环C2=C3双键或B-C环大π共轭键的抗脂质过氧化性好于B环的邻二羟基.
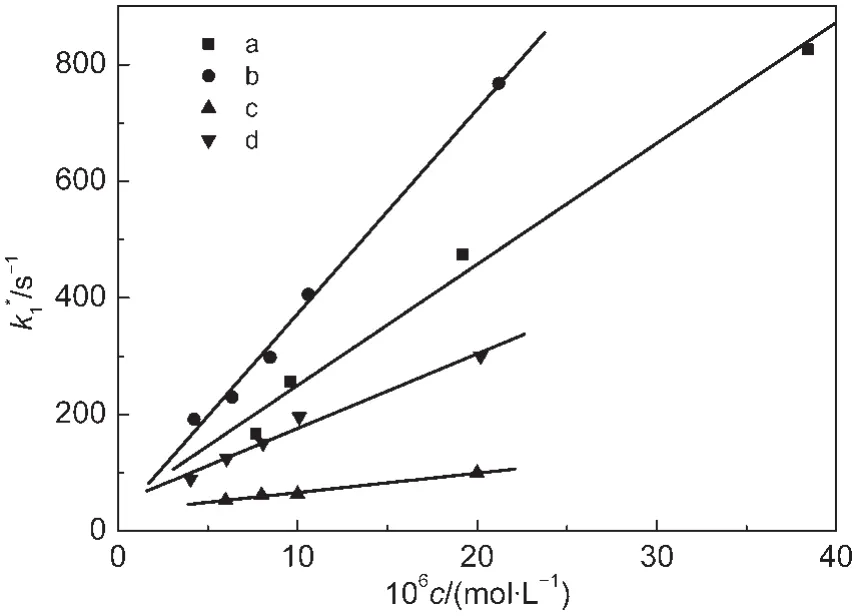
图5 α-羟乙基过氧自由基的表观反应速率常数与黄酮类化合物浓度关系Fig.5 Relationship between apparent decay rate of α-hydroxyl ethyl peroxyl radicals and concentration of flavonoids
3.2 α-羟乙基过氧自由基与模型化合物的反应
为了进一步阐明黄酮类化合物的结构官能团在与有机过氧自由基的反应中所起的作用,我们又选择了两种黄酮类化合物的模拟物:黄酮体以及邻苯二酚,测定了它们与α-羟乙基过氧自由基反应的速率常数,结果如图6所示.
从图6得到黄酮体和邻苯二酚与α-羟乙基过氧自由基反应的速率常数分别为(1.7±0.1)×106和(2.9±0.1)×105mol-1·dm3·s-1,见表1.作为2,3-双键模型化合物的黄酮体比作为邻二羟基模型化合物的邻苯二酚与有机过氧自由基的反应要快1个数量级.这进一步证明了在黄酮类化合物与有机过氧自由基的反应中,C环C2=C3或B-C环的大π共轭键的作用大于B环的邻二羟基.因此可以推断反应过程中,主要是C环C2=C3或B-C环的大π共轭键与过氧自由基发生双键加成反应,而A环C5位羟基在共轭体系中会给环提供电子,对其活性有一定的促进作用.该结果与我们前期对芦丁与α-羟乙基过氧自由基的反应产物的研究结果18相符合,我们通过分离分析得到芦丁与α-羟乙基过氧自由基的产物主要是来自于C、B环断开形成的2种产物,我们曾经推测是由于C环C2=C3或B-C环的大π共轭键比较活泼,与过氧自由基反应重排后形成.
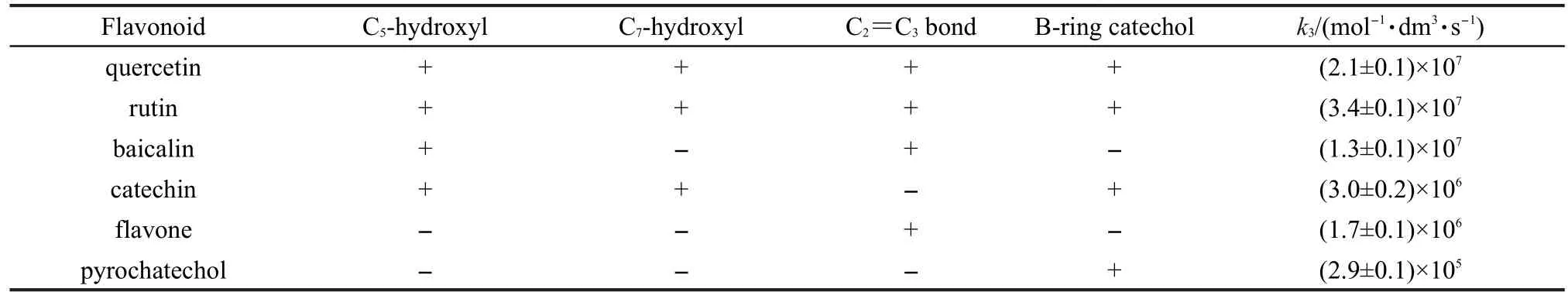
表1 黄酮类化合物与有机过氧自由基的反应速率常数Table 1 Rate constants of the reactions between flavonoids and α-hydroxyl ethyl peroxyl radicals
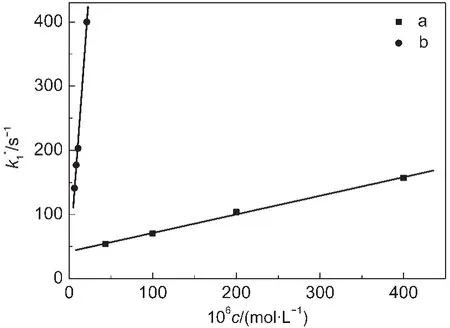
图6 α-羟乙基过氧自由基的表观反应速率常数与模型化合物浓度关系Fig.6 Relationship between apparent decay rate of α-hydroxyl ethyl peroxyl radicals and concentrations of model compounds
因此,由表1可知,清除α-羟乙基过氧自由基反应的活性顺序为:芦丁>槲皮素>黄岑甙>儿茶素>黄酮体>邻苯二酚.该顺序与其体外清除脂质过氧自由基的效果31,32基本一致.文献32报道,在乳化剂存在下,pH=7.8,37°C条件下得到的清除脂质过氧自由基的活性顺序为:芦丁>槲皮素>儿茶素>邻苯二酚.Lu等33利用老鼠心脏做体外实验,详细研究了黄酮类化合物的抗脂质氧化作用,发现在葡萄糖-葡萄糖氧化酶诱发的脂质氧化反应中,抗氧化剂的有效性是:槲皮素最好,芦丁、黄岑甙和儿茶素差不多.可见,实际生物体系比较复杂,但抑制LPO的大致规律与抗氧化剂的抗氧化活性基本一致.最近,Xiao等34研究了多种黄酮类化合物结构对其与α-淀粉酶亲和性的影响,发现C环C2=C3结构有利于提高化合物与α-淀粉酶的亲和性,主要是由于该结构连接B环和C环而形成对位共轭效应,有利于两环形成近平面结构,而该结构容易进入蛋白质中疏水性的囊腔内.所以,在脂质抗氧化过程中,黄岑甙的抗氧化活性好于儿茶素可能也与其亲和性好有关.
4 结论
通过脉冲辐解法测定了4种典型黄酮类化合物(槲皮素、芦丁、儿茶素以及黄岑甙)和2种模型化合物与α-羟乙基过氧自由基反应的速率常数,发现它们清除α-羟乙基过氧自由基反应的活性顺序为:芦丁>槲皮素>黄岑甙>儿茶素>黄酮体>邻苯二酚.研究表明,含有A环C5、C7羟基,C环C2=C3或B-C环的大π共轭键以及B环邻二羟基的黄酮类化合物可以快速地清除α-羟乙基过氧自由基.其中,A环C5羟基,B环邻二羟基,C环C2=C3或B-C环的大π共轭键结构共存的黄酮类化合物反应速率最快,而且C环C2=C3双键或B-C环的大π共轭键结构的作用大于B环邻二羟基结构,而C环是否含有C3-醣甙结构没有明显影响.因此我们认为在抑制LPO过程中,黄酮类化合物中的C环C2=C3结构起主要作用.
致谢: 本工作得到了北京师范大学的刘安东教授和李凤梅教授的帮助,在此表示感谢.
(1) Poli,G.;Albano,E.;Dianzani,M.U.Free Radicals:From Basic Science to Medicine;Birkhauser Verlag Basel:Switzerland,1993;pp 65-79.
(2) Farkas,L.;Gabor,M.;Kalley,F.Flavonoids and Bioflavonoids;Szeged:Hungary,1985;pp 423-436.
(3) Ratty,A.K.;Das,N.P.Biochemical Medicine and Metabolic Biology 1988,39,69.doi:10.1016/0885-4505(88)90060-6
(4) Butkovic,V.;Klasinc,L.;Bors,W.Journal of Agricultural and Food Chemistry 2004,52,2816.doi:10.1021/jf049880h
(5) Lu,X.X.Food Research and Development 2012,33,220.[鲁晓翔.食品研究与开发,2012,33,220.]
(6) Jovanovic,S.V.;Steenken,S.;Tosic,M.;Marjanovic,B.;Simic,M.G.J.Am.Chem.Soc.1994,116,4846.doi:10.1021/ja00090a032
(7) Jovanovic,S.V.;Hara,Y.;Steenken,S.;Simic,M.G.J.Am.Chem.Soc.1995,117,9881.doi:10.1021/ja00144a014
(8) Jovanovic,S.V.;Steenken,S.;Hara,Y.;Simic,M.G.Journal of the Chemical Society-Perkin Transactions 2 1996,2497.
(9) Lundberg,W.O.Autoxidation and Antioxidants;Interscience:London,1961;pp 133-169.
(10) Shieh,D.E.;Liu,L.T.;Lin,C.C.Anticancer Research 2000,20,2861.
(11)Waisundara,V.Y.;Hsu,A.N.;Tan,B.K.H.;Huang,D.J.Journal of Agricultural and Food Chemistry 2009,57,4096.doi:10.1021/jf8028539
(12)Min,W.;Lin,X.F.;Miao,X.;Wang,B.T.;Yang,Z.L.;Luo,D.American Journal of Chinese Medicine 2008,36,745.doi:10.1142/S0192415X0800620X
(13)Liu,L.Y.;Wei,E.Q.;Zhao,Y.M.;Chen,F.X.;Wang,M.L.;Zhang,W.P.;Chen,Z.Journal of Pharmacy and Pharmacology 2005,57,1019.doi:10.1211/0022357056622
(14) Jin,F.M.;Leitich,J.;von Sonntag,C.Journal of the Chemical Society-Perkin Transactions 2 1993,1583.
(15) Zhang,X.J.;Wu,J.L.;Cai,Z.L.;Yao,S.D.;Zuo,Z.H.;Lin,N.Y.Radiation Research 1995,142,227.doi:10.2307/3579033
(16) Cai,Z.L.;He,Y.K.;Wu,J.L.Radiat.Phys.Chem.1996,47,213.doi:10.1016/0969-806X(94)00182-J
(17)Cai,Z.L.;He,Y.K.;Wu,J.L.Radiat.Phys.Chem.1996,47,869.doi:10.1016/0969-806X(95)00179-2
(18)Deng,W.G.;He,Y.K.;Fang,X.W.;Wu,J.L.Radiat.Phys.Chem.1998,53,629.doi:10.1016/S0969-806X(97)00276-4
(19) Bothe,E.;Schuchmann,M.N.;Schultefrohlinde,D.;Vonsonntag,C.Zeitschrift für Naturforschung Section B-a Journal of Chemical Sciences 1983,38,212.
(20)Vonsonntag,C.;Dowideit,P.;Fang,X.W.;Mertens,R.;Pan,X.M.;Schuchmann,M.N.;Schuchmann,H.P.Water Science and Technology 1997,35,9.
(21) Bothe,E.;Schuchmann,M.N.;Schultefrohlinde,D.;Vonsonntag,C.Photochemistry and Photobiology 1978,28,639.doi:10.1111/php.1978.28.issue-4-5
(22)Taub,I.A.;Dorfman,L.M.J.Am.Chem.Soc.1962,84,4053.doi:10.1021/ja00880a016
(23)Dorfman,L.M.;Taub,I.A.J.Am.Chem.Soc.1963,85,2370.doi:10.1021/ja00899a006
(24)MacLachlan,A.J.Am.Chem.Soc.1965,87,960.doi:10.1021/ja01083a004
(25) Emerit,I.;Packer,L.;Auclair,C.Antioxidants in Therapy and Preventive Medicine,Advances in Experimental Medicine and Biology;Plenum Press:New York,1990;Vol.264,pp 165-170.
(26) Zhu,D.Z.;Sun,D.M.;Jiang,Z.L.;Wang,S.L.;Sun,X.Y.;Ni,Y.M.Acta Phys.-Chim.Sin.2008,24,2321.[朱大章,孙冬梅,蒋忠良,汪世龙,孙晓宇,倪亚明.物理化学学报,2008,24,2321.]doi:10.3866/PKU.WHXB20081229
(27)Tang,R.Z.;Zhang,P.;Li,H.X.;Liu,Y.C.;Wang,W.F.Acta Phys.-Chim.Sin.2011,27,1975.[唐睿智,张 鹏,李海霞,刘艳成,王文锋.物理化学学报,2011,27,1975.]doi:10.3866/PKU.WHXB20110825
(28)Zhang,F.G.;Wu,J.L.;Li,F.M.;Liu,A.D.Chem.J.Chin.Univ.2002,23,461.[张福根,吴季兰,李凤梅,刘安东.高等学校化学学报,2002,23,461.]
(29)Liu,A.D.;Zhao,Z.W.;Tong,Z.L.;Sun,Y.X.;Gu,H.C.;Shun,W.H.;Hu,H.D.;Hao,Z.H.;Zhou,R.Y.Radiat.Phys.Chem.1989,34,461.
(30)Adams,G.E.;Willson,R.L.Transactions of the Faraday Society 1969,65,2981.doi:10.1039/tf9696502981
(31) Lee,J.H.;Kim,G.H.Journal of Food Science 2010,75,H212.
(32) Roginsky,V.Archives of Biochemistry and Biophysics 2003,414,261.doi:10.1016/S0003-9861(03)00143-7
(33) Lu,N.;Zhang,Y.;Gao,Z.H.Toxicology in Vitro 2009,23,627.doi:10.1016/j.tiv.2009.02.013
(34)Xiao,J.B.;Kai,G.Y.;Ni,X.L.;Yang,F.;Chen,X.Q.Molecular Biosystems 2011,7,1883.doi:10.1039/c1mb05008g
——过氧碳酸钠

