浮游植物叶绿素a4种提取方法的比较
王曼
叶绿素a(chlorophyll a)存在于所有植物中, 是估算水体中浮游植物浓度的重要指标。近年来, 由于中国水体富营养化问题日益严重, 浮游植物叶绿素a的测定备受关注。浮游植物叶绿素的测定方法根据测定仪器可分为高效液相色谱法(HPLC法)、荧光光度计法和分光光度计法等, 但上述方法均不适用于快速、大量、野外样品的分析。目前国内浮游植物叶绿素a的常规测定方法存在测定结果偏低、耗时长、重复测定精密度差等特点, 且在研磨过程中操作人员和丙酮接触时间长, 不利于实验人员的健康。因此, 人们通过改变细胞破碎方式、延长提取时间、增高提取液温度、改变提取溶剂等方法, 对标准方法进行了优化改进。
本文选取丙酮研磨法、冻融法、丙酮加热法、混合溶剂提取法, 以实验室培养的水华水样为实验对象, 进行叶绿素a的测定研究。从叶绿素a的提取效果、重复操作精密度、操作的简便性和叶绿素a在提取溶剂中的稳定性等几个方面对这4种测定方法进行比较, 报告如下。
1 材料与方法
1. 1 水样准备 将实验室培养的藻种混合配置成实验水样,水样中含有硅藻属中的小环藻和菱形藻, 绿藻属中的小球藻、栅藻、新月藻。水样配好后立即加入碳酸镁, 每升样品加1%的碳酸镁1 m l, 以防止酸化引起的色素波长偏移。在抽滤器上装好乙酸纤维滤膜, 将水样摇匀后分成20份, 每份250 ml,分别抽滤浓缩, 抽完后继续抽1~2 min, 以减少滤膜上的水分。将滤膜对折后, 夹在滤纸内, 套上黑塑料套, 于-20℃条件下干燥过夜。
1. 2 叶绿素a的提取
1. 2. 1 丙酮研磨法 将冰冻过夜的滤膜取出剪碎放入研钵,加入少量碳酸镁粉末和90%丙酮10 m l充分研磨(6m l用于研磨 , 4 ml用于润洗 ), 将样品转移至 10 ml具塞离心管中 ,在 4℃冰箱中避光浸提 8~10 h。
1. 2. 2 丙酮加热法 将90%丙酮在控温水浴锅中预热(55℃)。将冰冻过夜的滤膜取出剪碎放入10m l具塞离心管中, 加入上述预热的丙酮 10 ml, 在 55℃条件下水浴 2 min, 于 4℃冰箱中避光浸提 2 h。
1. 2. 3 冻融法 将过夜的滤膜取出剪碎放入10 m l具塞离心管中 , 再放入 -20℃冰箱中冷冻 , 每隔 30 min 取出在室温中解冻 10 min, 反复冻融 3~5 次后 , 离心管中加 90% 丙酮10ml, 振摇 1~2 min 后放入 4℃冰箱避光浸提 , 每隔 30 min 取出振摇1次, 重复3次。在4℃冰箱中避光浸提20 h。
1. 2. 4 混合溶剂法 将过夜的滤膜取出剪碎放入10 m l具塞离心管中, 加入混合提取液10 ml(90%丙酮∶95%乙醇=2∶1;)在 4℃冰箱中避光浸提 8~10 h。
1. 3 比色测定 浸提后将样品 3 500 r/min 离心 15 min, 取上清液上分光光度计测定, 分别以提取溶剂作为空白, 用1 cm光程的比色皿 , 读取 750 nm、630 nm、663 nm 和 645 nm 下的吸光度。
叶绿素 a(mg/m3)=[11.64×(D663-D750)-2.16× (D645-D750)+ 0.10×(D630-D750)]V1/Vδ V为样品体积(L), D为吸光度, V1为提取液定容后的体积 (m l), δ为比色皿光程 (cm)。
2 结果
2. 1 4种方法叶绿素a提取效果的比较 见表1。
2. 2 叶绿素a在不同提取液中稳定性的比较见表2。丙酮研磨法、冻融法、丙酮加热法的提取液均为90%丙酮, 混合溶剂法的提取液为90%丙酮+95%乙醇。浸提液在4℃冰箱中避光放置0、3天后测定样品中叶绿素a含量, 用来检验叶绿素a在不同提取液中的稳定性。

表1 4种方法叶绿素a提取效果的比较
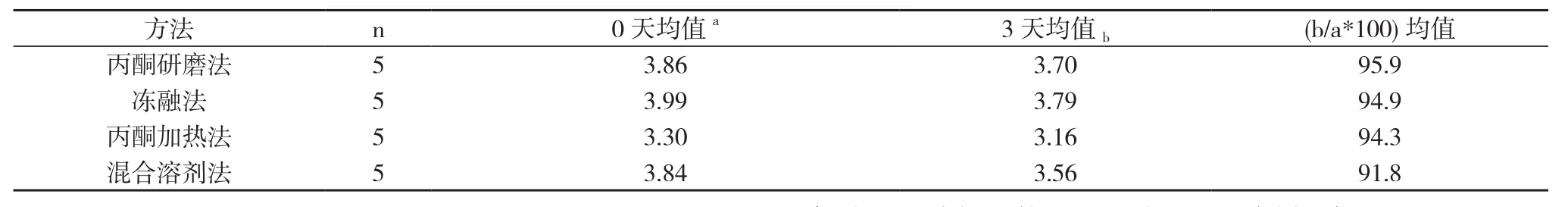
表2 叶绿素a在不同提取液中稳定性的比较
3 讨论
从提取效果和方法精密度来看:冻融法、丙酮加热法、混合溶剂法测定叶绿素a含量结果及重复测定精密度均高于丙酮研磨法,前3者测定叶绿素a含量结果及重复测定精密度间差异无统计学意义。冻融法的提取效率在四种提取方法中最高, 丙酮加热法的精密度较好。
从操作耗时来看, 丙酮加热法提取过程操作简单、耗时短, 平均仅需2.5h, 能够满足大量样品快速测定的要求。混和溶剂法和丙酮研磨法实验耗时相近, 均为9h左右。冻融法耗时太长, 需23h, 无法满足快速大量测定的要求。冻融法对藻类叶绿素的提取通过两方面来完成, 一是滤膜在-20 ℃下冰冻, 再在室温条件下融解, 利用细胞内冰粒的形成和细胞液浓度的增高引起溶涨[1], 使胞壁结构破碎引起叶绿素溶出;另一方面考虑到反复冻融对藻类细胞的破壁率受到细胞种类、同种藻类不同生长状况的影响[2], 因此需采用延长浸提时间来提高提取效率。
叶绿素a测定时要求A(750 nm)应小于0.005。上述4种提取方法的A(750 nm)均值均小于0.005, 但冻融法、丙酮加热法、混合溶剂和溶剂法的A(750 nm)均低于丙酮研磨法,且较稳定。从叶绿素a在提取液中稳定性来看, 叶绿素a在丙酮和混合溶剂中的稳定性无明显差异。
目前混和溶剂法较少应用于浮游植物叶绿素a的测定,但从上述分析比较 , 可以看出混和溶剂法提取 8~10 h, 对浮游植物叶绿素a的提取效果较好, 与文献报道一致[3]。
文献报道[4], 单独用丙酮或乙醇浸提液浸提, 效果都不如混合提取液效果好, 普遍测定值偏低, 这可能和丙酮与乙醇(甲醇)间存在协同萃取效应有关。考虑到提取溶剂对实验人员健康的影响和叶绿素a在混合溶剂中的稳定性, 目前常用丙酮加乙醇作为混合溶剂, 但两者的体积比和最优浓度还需进一步的研究确定。
综上所述, 依据叶绿素a的提取效果、重复操作精密度、操作简便性以及叶绿素在提取溶剂中的稳定性可知, 丙酮加热法和混合溶剂法可作为常用的叶绿素a测量方法, 2者尤其适用于大批量水环境样品的测定。
[1] 孙利芹,王长海,江涛.紫球藻细胞破碎方法研究.海洋通报,2004 23(4):31.
[2] 陈勇,刘洁声, 罗英,等. 不同生长期的塔玛亚历山大藻破壁条件和产毒的初步研究 . 环与健康杂志 , 2002, 19(3):175-178.
[3] 杨敏文.快速测定植物叶片中叶绿素含量方法的探讨.光谱实验室 , 2002, 19(4):478-481.
[4] 冯菁,李艳波,朱擎,等.浮游植物叶绿素a 测定方法比较.生态环境 , 2008, 17(2):524-527.

