脊尾白虾组织蛋白酶L基因的克隆及其表达分析
段亚飞,刘 萍,李吉涛,李 健,高保全,陈 萍
1. 中国水产科学研究院黄海水产研究所 青岛 266071;
2. 上海海洋大学 水产与生命学院, 上海 201306
脊尾白虾 (Exopalaemon carinicauda),是中国黄、渤海重要的底栖虾类 (Liu,1955)。因其繁殖能力强、生长速度快及环境适应性强等特点,养殖面积得到迅速扩大,成为我国近海重要的经济虾类。近年来,随着养殖规模的扩大及生态环境的不断恶化,虾类疾病频繁发生,造成了严重的经济损失(Li et al,2012a;Xu et al,2010)。脊尾白虾具有先天免疫防御功能,且其防御功能的发挥与免疫基因有关,因此发掘脊尾白虾免疫基因并加强免疫机制研究显得尤为重要。
组织蛋白酶L(cathepsin L,CatL)是半胱氨酸蛋白酶中木瓜蛋白酶C1家族的主要成员,广泛存在于各种生物有机体中(Liu et al,2006;Zeng et al,2005)。它不仅参与生物体内的各种蛋白水解,还参与抗原呈递、组织再生、肿瘤入侵和转移、骨质吸收及细胞凋亡等重要生命活动(Dohchin et al,2000;Furuyama & Fujisawa,2000;Kos et al,2000;Lindeman et al,2004)。目前已见水产动物的组织蛋白酶L基因相关报道。组织蛋白酶L在凡纳滨对虾(Litopenaeus vannamei)(Zhao et al,2007)、中国对虾(Fenneropenaeus chinensis)(Bu et al,2008)、中华绒螯蟹(Eriocheir sinensis)(Li et al,2010)及紫贻贝(Mytilus galloprovincialis)(Venier et al,2006)等水产动物免疫系统中均发挥重要作用,但其在脊尾白虾中的研究尚未见报道。为深入了解组织蛋白酶L在脊尾白虾中的免疫作用,本研究利用从本实验室构建的脊尾白虾血细胞全长cDNA文库中筛选得到的组织蛋白酶L基因EST序列,采用RACE技术,克隆得到该基因全长cDNA序列,并对其在鳗弧菌(Vibrio anguillarum)和白斑综合症病毒(white spot syndrome virus, WSSV)感染后的脊尾白虾组织中的表达特征进行了初步研究,以期为脊尾白虾组织蛋白酶L生物学功能研究及其对病原的抗病机理提供依据。
1 材料与方法
1.1 材料
健康脊尾白虾取自青岛胶州,体长(5.81±0.32)cm,体重(1.18±0.35) g。暂养于200 L的PVC桶中,每桶30尾,暂养一周。养殖水温24 ℃,盐度25,pH 8.2,持续充氧,每天换水1/3,投喂配合饲料。
TRIzol Reagent购自Invitrogen公司;SMARTTMRACE Amplification Kit和 Advantage 2 PCR Kit购自Clontech公司;DNA胶回收试剂盒购自上海生工公司;PMD18-T载体和大肠杆菌Top 10感受态细胞均购自 TaKaRa公司;其他试剂均为国产分析纯。
1.2 总RNA提取及cDNA的合成
Trizol试剂提取血细胞总RNA,按照Invitrogen说明书进行;紫外分光光度计与1.0%琼脂糖凝胶电泳检测RNA的质量及完整性。
1.3 全长cDNA的克隆及测序
根据本实验室已构建的脊尾白虾血细胞全长cDNA文库,通过随机测序获得组织蛋白酶L基因的 EST序列,利用 Primer Premier 5.0 软件设计3'RACE和 5'RACE特异性引物,所有引物均由上海生工合成。
3'和 5'末端扩增使用 SMARTTMRACE Amplification Kit和 Advantage 2 PCR Kit进行。3'RACE使用引物CatL-F1 (表1)和通用引物UPM配对,进行3'端扩增;5'RACE使用引物CatL-R1 (表1)和通用引物 UPM,进行 5'端扩增。反应程序:94 ℃ 3 min;94 ℃ 30 s,72 ℃ 3 min,5 个循环;94 ℃ 30 s,70 ℃ 30 s,72 ℃ 3 min,5 个循环;94 ℃30 s,68 ℃ 30 s,72 ℃ 3 min,25 个循环;72 ℃ 10 min。

表1 本研究所用引物序列Table 1 Sequence of study primers
3'和5'RACE扩增产物经1.5%琼脂糖凝胶电泳检测,用胶回收试剂盒回收目的片段,与PMD18-T载体连接,转化大肠杆菌Top 10感受态细胞,阳性克隆经菌落 PCR鉴定后,送往上海生工公司进行测序。
1.4 序列分析
利用DNAStar软件中的SeqMan程序对测序结果进行载体序列去除和序列拼接,然后用 EditSeq程序进行开放阅读框(ORF)的预测和氨基酸翻译。EcCatL基因的核苷酸序列和推导氨基酸序列使用BLAST(http://www.blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性比对。利用 Protparam 软件(http://www.expasy.org/tools/protparam.html)进行蛋白质理化性质预测。利用 Interpro Scan软件(http://www.ebi.ac.uk/Tool/InterProScan)进行蛋白质功能结构域分析。使用Clustal X软件对脊尾白虾与其他物种的 CatL氨基酸序列进行多序列比对,在此基础上采用 MEGA 4.0软件,以邻接法(neighbor-joining)构建系统进化树。
1.5 鳗弧菌和WSSV感染实验
实验用 WSSV粗提液为黄海水产研究所病研室所赠,方法见Li et al (2012b)。实验用鳗弧菌为黄海水产研究所杨爱国实验室所赠。实验用鳗弧菌于实验前一天进行菌种活化,经2611E液体培养基扩大培养后离心取沉淀,用无菌生理盐水稀释为2×108pfu/mL的菌悬液,4 ℃保存备用。
实验前随机挑取 10尾脊尾白虾,经白斑病毒综合征检测试剂盒检测证实无WSSV感染。随机选取暂养7 d的健康脊尾白虾分为对照组、鳗弧菌感染组和WSSV感染组,每组50尾。鳗弧菌感染组在每尾虾第二腹节部位注射鳗弧菌菌悬液20 μL,WSSV感染组在每尾虾第二腹节部位注射WSSV粗提液20 μL,对照组注射等体积生理盐水。各组分别于注射后0、3、6、12、24、48及72 h取血细胞和肝胰腺,用于RNA提取,每个时间点取6尾。此外,为检测脊尾白虾 EcCatL基因在不同组织中的表达水平,另取6尾健康脊尾白虾的血细胞、鳃、肝胰腺、肌肉、卵巢、肠、胃和眼柄组织,用于RNA提取。
1.6 EcCatL基因表达分析
TRIzol试剂提取不同实验组脊尾白虾血细胞和肝胰腺组织的总RNA,反转录合成cDNA,方法按Han et al (2011)进行。
根据已获得的脊尾白虾内参基因18S rRNA和EcCatL基因全长序列,分别设计一对正反引物(18S rRNA-F/R及CatL-F2/R2)(表1),利用Real-time PCR对不同时间鳗弧菌和 WSSV感染的脊尾白虾血细胞和肝胰腺中EcCatL基因的表达量进行检测。反应体系为 20 μL,包括 10 μL SYBR®Premix Ex TaqTMⅡ (×2),0.8 μL 10 μmol/L 引物 CatL-F2,0.8 μL 10μmol/L 引物 CatL-R2,0.4 μL ROX Reference Dye Ⅱ (×50)*3,2.0 μL cDNA,6.0 μL DEPC 水。反应程序为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。采用2-△△CT法计算EcCatL基因的表达量,用SPSS 11.0软件进行分析。
2 结果
2.1 EcCatL基因全长cDNA克隆
利用 Trizol试剂提取获得脊尾白虾血细胞总RNA,经紫外分光光度计检测,其 OD260/OD280为1.91,表明总RNA纯度较高;经1.0%琼脂糖凝胶电泳检测(图1),18S和28S rRNA条带清晰,完整性较好,符合实验要求。以特异性引物CatL-F1和CatL-R1分别与通用引物UPM配对,进行3'RACE和5'RACE扩增,获得~441和~500 bp的特异性条带各一 (图1)。

图1 总RNA 和3'RACE、5'RACE扩增产物的1.0%琼脂糖凝胶电泳分析Figure 1 Analysis of total RNA and amplification products of 3', 5'RACE by 1.0% agarose gel electrophoresis
2.2 EcCatL基因全长cDNA序列特征分析
3'RACE和 5'RACE扩增产物分别测序后与EST序列进行拼接,获得脊尾白虾CatL基因的全长cDNA序列,命名为EcCatL,GenBank登录号为JX508645。该基因全长1 136 bp,包括24 bp的5'端非编码区(UTR),152 bp的3'端非编码区和960 bp的开放阅读框。3'端含有多聚腺苷酸加尾信号AATAAA和PolyA尾 (图2)。

图2 脊尾白虾EcCatL基因的核苷酸序列及其推导的氨基酸序列Figure 2 Nucleotide sequence and deduced amino acid sequence of E. carinicauda EcCatL gene
氨基酸序列分析可知,EcCatL基因编码一个由319个氨基酸残基组成的蛋白质,结构域分析表明,其N端含有15个氨基酸组成的信号肽,成熟肽位于第15~319位氨基酸之间,分子量为35.30×103,理论等电点为5.27。结构域分析表明,EcCatL属于典型的组织蛋白酶中的半胱氨酸蛋白酶家族,第123~134位氨基酸残基、第264~274位氨基酸残基及第 281~300位氨基酸残基分别为半胱氨酸蛋白酶半胱氨酸、组氨酸及天冬氨酸活性位点。该蛋白存在组织蛋白酶 L所特有的保守基序 ERFNIN[E-X3-R-X2-(I/V)-F-X3-N-X3-I-X3-N]和 GCXGG。
2.3 EcCatL基因同源性分析
利用BLAST对脊尾白虾EcCatL基因进行同源性分析,发现脊尾白虾 EcCatL基因与变色小长臂虾(Palaemonetes varians)和北极甜虾(Pandalus borealis)的同源性最高,分别为92%和76%。与其它虾蟹类如挪威海螯虾(Nephrops norvegicus)、美洲螯龙虾(Homarus americanus)、刀额新对虾(Metapenaeus ensis)、凡纳滨对虾、中华绒螯蟹及阿拉斯加帝王蟹(Paralithodes camtschaticus)等的同源性分别为 57%、56%、53%、53%、51%和 48%;与其它无脊椎动物动物如赤拟谷盗(Tribolium castaneum)、黑腹果蝇(Drosophila melanogaster)、埃及伊蚊(Aedes aegypti)、长牡蛎(Crassostrea gigas)和紫海胆(Strongylocentrotus purpuratus)的同源性分别为 53%、52%、50%、51%和 50%;与脊椎动物非洲象(Loxodonta africana)的同源性为48%。利用MEGA 4.0软件进行系统进化分析表明,脊尾白虾组织蛋白酶 L EcCatL与变色小长臂虾紧密聚为一支,之后聚类顺序依次为北极甜虾、挪威海螯虾及美洲螯龙虾等 (图3)。
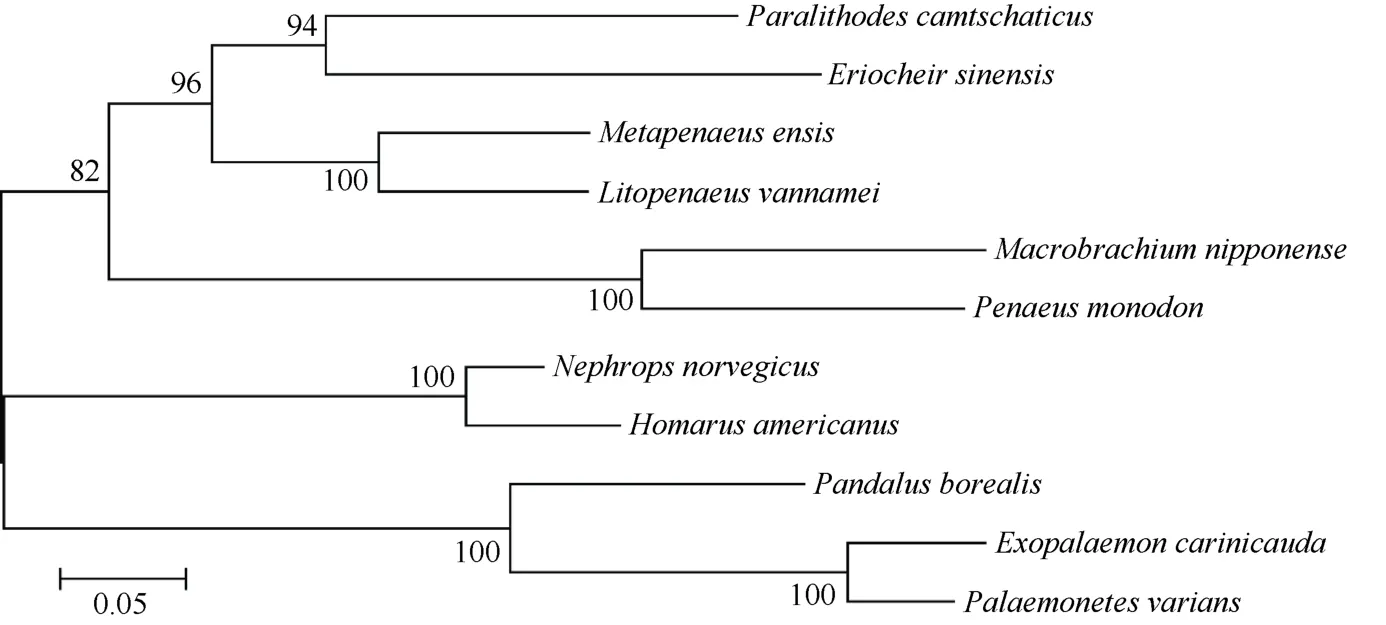
图3 利用MEGA 4.0软件构建的基于CatL氨基酸序列的NJ系统进化树Figure 3 NJ phylogenetic tree based on CatL amino acid sequences by MEGA 4.0
通过与北极甜虾、凡纳滨对虾、斑节对虾及中华绒螯蟹等甲壳动物的组织蛋白酶L的氨基酸序列进行比对发现,半胱氨酸蛋白酶半胱氨酸、组氨酸及天冬氨酸活性位点都高度保守,保守基序ERFNIN、GNFD和GCXGG在8种甲壳动物中都存在。
2.4 EcCatL基因组织表达分析
利用Real-time PCR分析了脊尾白虾EcCatL基因在不同组织中的表达水平,结果表明:EcCatL基因在血细胞、鳃、肝胰腺、肌肉、卵巢、肠、胃及眼柄中都有表达。其中,在肝胰腺中的表达量最高,其次为血细胞、鳃、胃、卵巢及肌肉,在肠和眼柄中的表达量最少(图5)。

图4 脊尾白虾EcCatL氨基酸序列与其他物种CatL氨基酸序列比对Figure 4 Amino acid sequences alignment of E. carinicauda EcCatL with other species’ CatL

图5 脊尾白虾组织蛋白酶L EcCatL基因在不同组织中的表达分布Figure 5 Distribution of EcCatL gene expression in different tissues of E. carinicauda
Real-time PCR检测脊尾白虾在注射鳗弧菌和WSSV后不同时间血细胞中EcCatL基因的表达情况(图6)。结果表明:鳗弧菌和WSSV刺激后,血细胞中 EcCatL基因的表达量都极显著高于对照组(P<0.01)。其中,鳗弧菌感染组和WSSV感染组血细胞中EcCatL基因表达量在注射早期(0~3 h)均出现下降,6~12 h开始不断上升,于12 h达到最高值;在24~48 h表达量开始下降,并于48 h极显著低于对照组(P<0.01);72 h后表达量逐渐上升至初始水平。血细胞中 EcCatL基因的表达量总体表现为下降、升高、再下降、再升高至初始水平的趋势。

图6 注射鳗弧菌和WSSV后脊尾白虾血细胞中EcCatL基因的表达情况Figure 6 Expression of EcCatL gene in E. carinicauda hemocytes after V. anguillarum and WSSV injection
脊尾白虾在注射感染鳗弧菌和WSSV后,肝胰腺中EcCatL基因的表达情况见图7。结果表明:与对照组相比,鳗弧菌和 WSSV刺激后,肝胰腺中EcCatL的表达量都极显著高于对照组(P<0.01)。其中,鳗弧菌感染组和WSSV感染组血细胞中EcCatL基因的表达量在注射早期(0~3 h)均出现下降,6~12 h开始不断上升,于12 h达到最高值,随后逐渐下降;在24~48 h表达量开始上升,并于48 h表达量极显著的高于对照组(P<0.01);72 h后血细胞中 EcCatL基因的表达量逐渐回落至初始水平。肝胰腺中 EcCatL基因的表达量总体表现为下降、升高、再下降、再升高、最后下降至初始水平的趋势。

图7 注射鳗弧菌和WSSV后脊尾白虾肝胰腺中EcCatL基因的表达情况Figure 7 Expression of EcCatL gene in E. carinicauda hepatopancreas after V. anguillarum and WSSV injection
3 讨论
本研究首次克隆得到脊尾白虾组织蛋白酶 L EcCatL基因序列,全长1 136 bp,包含960 bp的开放阅读框,编码一个319个氨基酸组成的多肽。序列分析发现,与其他甲壳动物的组织蛋白酶L一样,EcCatL基因编码的氨基酸序列含有半胱氨酸、组氨酸和天冬氨酸3个半胱氨酸蛋白酶活性位点以及半胱氨酸蛋白酶中高度保守的GNFD基序、重要结构基序GCXGG基序和组织蛋白酶L家族高度保守的ERFNIN [E-X3-R-X2-(I/V)-F-X3-N-X3-I-X3-N]基序。与其它动物氨基酸序列的比对发现该序列与已知甲壳动物的同源性较高,均>80%。系统进化分析表明脊尾白虾与变色小长臂虾首先聚为一支,且与北极甜虾、斑节对虾和中华绒螯蟹等虾蟹类的同源性>50%。以上结果表明该序列为脊尾白虾组蛋白酶L EcCatL基因。
研究报道表明,斑马鱼(Danio rerio)中发现 3种类型的组织蛋白酶L,合浦珠母贝(Pinctada fucata)中存在2种类型的组织蛋白酶L(Bai et al,2011)。本研究只发现脊尾白虾组织蛋白酶L的一种基因,是否存在其他类型,有待进一步研究。ERFNIN基序是组织蛋白酶L家族的高度保守基序(Bai et al,2011),其中4个氨基酸是最保守的,而苯丙氨酸F和异亮氨酸I在不同物种中有所变化,本研究脊尾白虾组织蛋白酶L的ERFNIN基序的异亮氨酸I被缬氨酸V所取代,该特征与北极甜虾一致 (图4);而中华绒螯蟹和阿拉斯加帝王蟹的苯丙氨酸F被酪氨酸Y所取代。GCXGG基序也是半胱氨酸蛋白酶非常重要的结构基序(Bai et al,2011;Karrer et al,1993),除中间的 X代表不同的氨基酸外,其它 4种氨基酸均保守,脊尾白虾组织蛋白酶 L的GCXGG基序中X为天冬氨酸N,而南美白对虾为甲硫氨酸M,中华绒螯蟹和阿拉斯加帝王蟹为甘氨酸G,刀额新对虾为半胱氨酸C。本研究脊尾白虾组织蛋白酶L重要基序的序列保守性和与其他物种相同的酶活性位点,表明脊尾白虾组织蛋白酶L与其他物种组织蛋白酶L具有相似的蛋白功能。
脊尾白虾EcCatL基因的表达具有组织特异性,Real time-PCR结果显示,脊尾白虾EcCatL基因在血细胞、鳃、肝胰腺、肌肉、卵巢、肠、胃及眼柄中均有表达(图5)。其中,在肝胰腺中的表达量最高,与中华绒螯蟹CatL基因组织表达情况一致(Li et al,2010),在肠和眼柄中的表达量最少,说明脊尾白虾肝胰腺是参与组织蛋白酶 L储存和释放的主要器官。
免疫系统主要包括固有免疫和获得性免疫两大类(Salminen et al,2008)。无脊椎动物缺乏抗体介导的获得性免疫,其机体免疫防御的发挥主要依靠其固有免疫系统,如血细胞的吞噬、包囊以及血淋巴中的一些酶和免疫因子的杀菌、抗菌作用,以此来识别和有效清除入侵的微生物和寄生虫等异物,保持体内外平衡(Roch,1999)。组织蛋白酶L作为一种溶酶体蛋白,近年来在无脊椎动物的先天免疫调控方面的研究取得了较大的进展。De Gregorio对黑腹果蝇的研究表明,组织蛋白酶L表达量在细菌刺激后显著上调,认为组织蛋白酶L是一种参与机体免疫反应的重要基因(Tisca & Mosca,2004)。在被WSSV感染后,组织蛋白酶L在凡纳滨对虾肝胰腺中的表达量显著上调,表明其参与了病毒防御过程(Zhao et al,2007);在被鳗弧菌感染后,中华绒螯蟹CatL在血细胞中的表达量发生显著性变化(Li et al,2010);在被溶藻弧菌(Vibrio alginolyticus)感染后,合浦珠母贝CatL1和CatL2的表达量出现急剧变化(Ma et al,2010a, b)。因此,组织蛋白酶L可能在细菌和病毒的防御过程中起着重要作用。
为了研究组织蛋白酶L在脊尾白虾非特异性免疫防御中的作用,本研究设计了细菌(鳗弧菌)和病毒(WSSV)感染实验,发现感染后的脊尾白虾血细胞和肝胰腺EcCatL表达量均有明显的时间差异性,变化趋势基本一致。注射鳗弧菌和WSSV后血细胞和肝胰腺中EcCatL的表达量均在12 h时达到最大值,与对照组相差异性极显著(P<0.01),表明EcCatL可能参与了免疫反应的应答。刺激后 12~24 h EcCatL表达量下降,可能意味着机体处于感染后的恢复期(Sun et al,2010)。类似的基因表达情况也见于鳗弧菌刺激后的中华绒螯蟹(Li et al,2010)。注射鳗弧菌和WSSV后,脊尾白虾血细胞EcCatL表达水平明显高于肝胰腺,可能由组织器官功能差异性所致(Li et al,2012b)。血细胞是虾类非特异免疫防御的首要组织,在病原体入侵后担当机体非特异免疫防御的重任,能够比其他组织更迅速地上调EcCatL基因表达。
本研究成功克隆了脊尾白虾 EcCatL基因全长cDNA序列,通过分析鳗弧菌和WSSV感染后脊尾白虾血细胞和肝胰腺中 EcCatL基因表达特征,可以进一步认定 EcCatL基因参与了脊尾白虾的免疫应答反应,在清除病原体的防御反应中起着重要作用,为深入研究脊尾白虾 EcCatL基因在病原体刺激下发挥免疫功能的途径和机理奠定了基础。
Bai ZY, Wang GL, Li JL. 2011. Cloning and characterization of cathepsin L gene and evolution analysis in Hyriopsis cumingii. Biotechnol Bull, (6):104-111. [白志毅, 汪桂玲, 李家乐. 2011. 三角帆蚌组织蛋白酶L基因的克隆和序列特征与进化分析. 生物技术通报, (6): 104-111.]
Bu XJ, Zhang XW, Sun YD, Zhao XF, Wang JX. 2008. Recombinant expression and tissue distribution of cathepsin L from Chinese shrimp Fenneropenaeus chinensis. J Fish Sci Chn, 15(6): 910-916. [卜兴江, 仉晓文, 孙允东, 赵小凡, 王金星. 2008. 中国明对虾组织蛋白酶L的原核重组表达及其组织分布. 中国水产科学, 15(6): 910-916.]
Dohchin A, Suzuki JI, Seki H, Masutani M, Shiroto H, Kawakami Y. 2000.Immunostained cathepsins B and L correlate with depth of invasion and different metastatic pathways in early stage gastric carcinoma. Cancer, 89(3):482-487.
Furuyama N, Fujisawa Y. 2000. Distinct roles of cathepsin K and cathepsin L in osteoclastic bone resorption. Endocr Res, 26(2): 189-204.
Han JY, Li J, Li JT, Chang ZQ, Chen P, Li H. 2011. Cloning and expression of heat shock protein 70 (HSP70) of Exopalaemon carinicauda. J Fisher Chn, 35(8): 1130-1138. [韩俊英, 李健, 李吉涛, 常志强, 陈萍, 李华.2011. 脊尾白虾热休克蛋白HSP70基因的克隆及其表达分析. 水产学报,35(8): 1130-1138.]
Karrer KM, Peiffer SL, Ditomas ME. 1993. Two distinct gene subfamilies within the family of cysteine protease genes. Proc Natl Acad Sci USA, 90(7):3063-3067.
Kos J, Werle B, Lah T, Brunner N. 2000. Cysteine proteinases and their inhibitors in extracellular fluids: markers for diagnosis and prognosis in cancer. Internat J Biolog Markers, 15(1): 84-89.
Li JT, Han JY, Chen P, Chang ZQ, He YY, Liu P, Wang QY, Li J. 2012a.Cloning of a heat shock protein 90 (HSP90) gene and expression analysis in the ridgetail white prawn Exopalaemon carinicauda. Fish Shellfish Immunol,32(6): 1191-1197.
Li MY, Li J, Liu P, Li JT. 2012b. Cloning and expression analysis of ferritin gene in Exopalaemon carinicauda. Oceanol Et Limnol Sin, 43(2): 306-312.[李美玉, 李健, 刘萍, 李吉涛. 2012. 脊尾白虾(Exopalaemon carinicauda) ferritin基因克隆及表达分析. 海洋与湖沼, 43(2): 306-312.]Li WW, Jin XK, He L, Jiang H, Gong YN, Xie YN, Wang Q. 2010.Molecular cloning, characterization, expression and activity analysis of cathepsin L in Chinese mitten crab, Eriocheir sinensis. Fish Shellfish Immunol, 29(6): 1010-1018.
Lindeman JH, Hanemaaijer R, Mulder A, Dijkstra PDS, Szuhai K, Bromme D, Verheijen JH, Hogendoorn PCW. 2004. Cathepsin K is the principal protease in giant cell tumor of bone. Amer J Pathol, 165(2): 593-600.
Liu LQ, Warner AH. 2006. Further characterization of the cathepsin L-associated protein and its gene in two species of the brine shrimp, Artemia.Comp Biochem Physiol A, 145(4): 458-467.
Liu RY. 1955. The Economic Shrimps in Northern of China. Beijing:Science Press. [刘瑞玉. 1955. 中国北部的经济虾类. 北京: 科学出版社.]Ma JJ, Zhang DC, Cui SG, Jiang JJ, Pu HL, Jiang SG. 2010a. Molecular characterization and expression analysis of cathepsin L2 cysteine protease from pearl oyster Pinctada fucata. J Fish Sci Chn, 17(4): 701-712. [麻建军,张殿昌, 崔淑歌, 姜晶晶, 蒲含林, 江世贵. 2010. 合浦珠母贝组织蛋白酶L2基因的特征与组织表达分析. 中国水产科学, 17(4): 701-712.]
Ma JJ, Zhang DC, Jiang JJ, Cui SG, Pu HL, Jiang SG. 2010b. Molecular characterization and expression analysis of cathepsin L1 cysteine protease from pearl oyster Pinctada fucata. Fish Shellfish Immunol, 29(3): 501-507.
Roch P. 1999. Defense mechanisms and disease prevention in farmed marine invertebrates. Aquaculture, 172(1-2): 125-145.
Salminen A, Huuskonen J, Ojala J, Kauppinen A, Kaarniranta K, Suuronen T. 2008. Activation of innate immunity system during aging: NF-kB signaling is the molecular culprit of inflamm-aging. Ageing Res Rev, 7(2):83-105.
Sun J, Wang BJ, Li XH, Sun SJ, Liu M, Jiang KY, Wang L. 2010. The full length cDNA cloning and expression profile of prophenoloxidase of Fenneropenaeus chinensis. J Fisher Chn, 34(1): 56-66. [孙杰, 王宝杰, 李晓华, 孙淑娟, 刘梅, 蒋克勇, 王雷. 2010. 中国明对虾酚氧化酶原基因cDNA的克隆与表达特征. 水产学报, 34(1): 56-66.]
Tisca PG, Mosca F. 2004. Defense mechanisms in farmed marine molluscs.Vet Res Commun, 28(1): 57-62.
Venier P, De Pittà C, Pallavicini A, Marsano F, Varotto L, Romualdi C,Dondero F, Viarengo A, Lanfranchi G. 2006. Development of mussel mRNA profiling: can gene expression trends reveal coastal water pollution. Mutat Res, 602(1-2): 121-134.
Xu WJ, Xie JJ, Shi H, Li CW. 2010. Hematodinium infections in cultured ridgetail white prawns, Exopalaemon carinicauda, in eastern China.Aquaculture, 300(1-4): 25-31.
Xu WJ, Xie JJ, Shi H, Zhang J, Zhang JS. 2010. Infection of Hematodinium sp. in farmed ridgetail white prawn Exopalaemon carinicauda. Oceanol Et Limnol Sin, 41(3): 396-402. [许文军, 谢建军, 施慧, 张静, 张家松. 2010.池塘养殖脊尾白虾(Exopalaemon carinicauda)感染血卵涡鞭虫的研究.海洋与湖沼, 41(3): 396-402.]
Zeng GZ, Tan NH, Jia RR, Pan XL. 2005. Cathepsins: Structures, Functions and Inhibitors. Acta Bot Yunnanica, 27(4): 337-354. [曾广智, 谭宁华, 贾锐锐, 潘蓄林. 2005. 组织蛋白酶及其抑制剂研究进展. 云南植物研究,27(4): 337-354.]
Zhao ZY, Yin ZX, Wang SP, Guan HJ, Li SD, Xing K, Chan SM, He JG.2007. Profiling of differentially expressed genes in hepatopancreas of white spot syndrome virus-resistant shrimp (Litopenaeus vannamei) by suppression subtractive hybridisation. Fish Shellfish Immunol, 22(5): 520-534.
- Zoological Research的其它文章
- 旅游干扰对非人灵长类动物的影响
- 2013年《动物学研究》主编新春寄语
- Zoological Research Call for papers

