6-BA和AgNO3对芥菜型油菜下胚轴芽再生的影响
袁玉辉,杨 柳,刘显军,陆 赢,刘忠松
(湖南农业大学油料作物研究所/国家油料作物改良中心,长沙410128)
遗传转化能将外源基因导入目的植物,而遗传转化的前提是高效转化系统。最常用的遗传转化系统是农杆菌介导的遗传转化系统,该系统有赖于受体的高效再生。油菜转基因常用受体之一是下胚轴,由下胚轴诱导产生再生苗一般要经历诱导愈伤组织形成、愈伤组织分化成芽、诱导生根等步骤,其中诱导愈伤组织分化成芽不仅受植物基因型的影响,而且取决于培养基中激素种类及配比。6-BA是细胞分裂素,主要作用是促进细胞分裂和芽的形成[1];AgNO3是乙烯抑制剂,Ag+使乙烯不能干扰多胺的合成。多胺合成有利于促进体细胞胚的形成及再生芽的发生[2],因此植物遗传转化诱导芽再生的过程中常用到6-BA和AgNO3。
本研究以芥菜型油菜品种Brown mustard的下胚轴为外植体,用农杆菌介导法进行遗传转化,通过比较含不同浓度6-BA和AgNO3的分化培养基中芽再生情况,旨在探讨不同浓度6-BA和AgNO3对芽再生的影响,以期为建立芥菜型油菜高频再生体系奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
试验所用的根癌农杆菌菌株是含双元载体pBI121质粒的GV3101。双元载体pBI121含卡那霉素抗性基因NPTII和GUS基因。
1.1.2 植物材料
试验所用的芥菜型油菜品种为Brown mustard,由甘肃农业大学孙万仓教授提供,并经多代自交纯化。
1.2 方法
1.2.1 无菌外植体的获取
挑选颗粒饱满、无霉变的Brown mustard种子,无菌条件下,用75%酒精浸泡30 s,然后用0.1%升汞浸泡12 min,无菌水冲洗3~4次,无菌滤纸吸干多余的水分,接种于1/2 MS发芽培养基(添加20 g/L蔗糖,0.8%琼脂,pH 5.8)中,暗培养 4 d,再光照培养2 d。所有外植体的培养温度都为22+2℃,光强为2 000 lx,光周期为16(光)/8(暗)h。
下胚轴为6日龄,作为外植体被切成5~10 mm切断,随机平放于预培养基(MS+30 g/L蔗糖+0.8%琼脂 +1 mg/L 2,4-D,pH 5.8)中预培养3 d,待下胚轴切口处刚开始膨大时用农杆菌浸染。
1.2.2 农杆菌的培养
在含50 mg/L Rif(利福平)和50 mg/L Kan(卡那霉素)的YEP液体培养基的无菌三角瓶中培养农杆菌的单克隆菌株,28℃,于180~200 rpm的摇床上振荡暗培养24 h左右,直到农杆菌菌液浓度(OD600)达到0.6左右时,离心弃上清收集菌体,用MS液重悬菌体,至菌液浓度(OD600)为0.3~0.6,添加100 mol/L AS(乙酰丁香酮)用于外植体的浸染。
1.2.3 外植体与农杆菌的共培养
在超净工作台上,将外植体浸渍在农杆菌菌液中5 min,并不断振荡,倒去菌液,外植体收集于铺有干燥无菌滤纸的培养皿中,用滤纸去掉多余菌液,再将外植体接入共培养基(MS+30 g/L蔗糖+0.8%琼脂 +1 mg/L 2,4 -D+1 mg/L AS,pH 5.8)中避光共培养2 d。
1.2.4 分化培养
用无菌水清洗共培养后的外植体3次,再用含500 mg/L羧苄青霉素(Cab)的MS液于摇床上轻微震荡洗涤外植体30 min,防止农杆菌过度生长,倒去液体,无菌滤纸吸干多余的水分,将外植体转入含有不同浓度6-BA和AgNO3的MS分化培养基上(含有30 g/L蔗糖+0.8%琼脂,pH 5.8)进行培养。
1.2.5 分化培养基中6-BA浓度处理
为了探究6-BA的浓度对芽再生的影响,将脱菌后的下胚轴转移到含 2.0、2.5、3.0、3.5、4.0、4.5和5.0 mg/L 7个浓度梯度的6-BA分化培养基中,每隔10 d继代到相同的分化培养基中。分化培养基以MS为基本培养基,含有30 g/L蔗糖、0.8%琼脂和500 mg/L Cab。每次处理20个下胚轴,重复3次。20 d后统计出芽率和芽丛数,取平均值(下同)。
1.2.6 分化培养基中硝酸银浓度处理
为了研究AgNO3对芽再生的影响,在6-BA浓度处理试验筛选出出芽率最高的浓度(3 mg/L)基础上,设置3、4、5、6 和7 mg/L 5 个 AgNO3浓度梯度进行试验。
1.2.7 6-BA和硝酸银浓度配比处理
用出芽率最高的AgNO3浓度(5 mg/L)与前述的7个6-BA浓度梯度配比,比较分化培养基中加硝酸银与不加硝酸银的差别。
1.3 数据统计与分析
每次处理20个下胚轴,重复3次。20 d后统计出芽率和芽丛数,取平均值。出芽率和芽丛数计算方法如下:出芽率(%)=(再生不定芽的外植体数/外植体总数)×100;芽丛数=(再生的不定芽总数/外植体总数)×100。
试验数据主要运用Microsoft Excel 2003和DPS进行处理,其中DPS中采用Duncan多重比较,取0.05显著水平和0.01极显著水平。
2 结果与分析
2.1 6-BA浓度对芽再生的影响
下胚轴在分化培养基中培养7 d左右后切口处开始膨大,长出黄绿色颗粒状的愈伤组织。随着愈伤组织的生长,10 d后绿色的不定芽(图1:A1~A3)开始形成并生长。

图1 芥菜型油菜品种Brown mustard下胚轴芽再生过程及再生芽芽丛形态Fig.1 The process and morphology of shoot regeneration from hypocotyls of Brown mustard(Brassica juncea L.)
分化培养基中6-BA浓度在3 mg/L以下时,外植体出芽率随着6-BA浓度的增加而增加;当6-BA的浓度为3 mg/L时出芽率最高,达41.67%,平均芽丛数为2.22。6-BA浓度达到3 mg/L以上时,外植体出芽率不仅不增加,反而随着6-BA浓度增加而下降(表1)。而芽丛数在6-BA浓度为2.5 mg/L时达到最高值(2.96),在2.0 mg/L时芽丛最少(1.71),其余浓度的芽丛数都在2.11到2.60之间,有显著差异,但随浓度的升高芽丛数变化不一致。

表1 不同浓度6-BA的分化培养基中芽再生情况Table 1 The shoot regeneration in differentiation medium of different concentration 6-BA
2.2 AgNO3浓度对芽再生的影响
结果表明,在含3 mg/L6-BA的分化培养基中再添加AgNO3可促进愈伤组织再生芽(表2)。当AgNO3浓度在5 mg/L以下时,出芽率随着AgNO3浓度的增加而增加;但AgNO3浓度在5 mg/L以上时,出芽率则随浓度增加而下降,且严重玻璃化;在AgNO3浓度为 5 mg/L时出芽率最高,达到58.33%,比不加AgNO3时提高了40.00%,但芽丛数减少到1.73个,因而认为分化培养基中以添加5 mg/L AgNO3效果最佳。
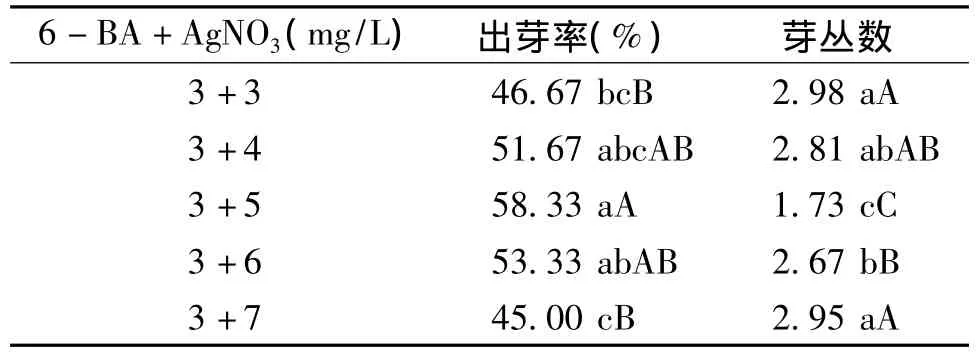
表2 不同浓度AgNO3的分化培养基中芽再生情况Table 2 The shoot regeneration in differentiation medium of different concentration AgNO3
2.3 6-BA和AgNO3配比对芽再生的影响
比较分化培养基中添加5 mg/L AgNO3和不加AgNO3出芽率和芽丛数的结果,发现3 mg/L 6-BA+5 mg/L AgNO3组合与其他组合差异显著,出芽率最高,达到58.33%,进一步表明分化培养基中添加3 mg/L 6-BA+5 mg/L AgNO3最有利于芽分化(表1)。
3 讨论
植物离体组织培养中,不定芽再生频率与植物基因型、外植体类型及生理状态、生长调节剂等因素有关[3]。本试验发现,低浓度6-BA对芥菜型油菜Brown mustard不定芽分化和生长有促进作用,但浓度过高却表现为抑制作用,与何小兰等对甘蓝型油菜的研究结果一致,可能与内外源激素达到特定平衡状态和激素受体存在饱和状态有关,即6-BA浓度过高会对不定芽产生一定的毒害性[4],其作用机理有待于进一步研究。
AgNO3的添加可明显提高芥菜型油菜Brown mustard下胚轴芽再生频率,使芽分化提早,这与唐桂香等[5]、Akasaka - Kennedy 等[6]、Khan 等[7]和李会珍等[8]对甘蓝型油菜和胥宇建等[9]对大白菜的研究结果一致。不同浓度的AgNO3对出芽率的影响有差异,当分化培养基中含有5 mg/L AgNO3时最有利于芥菜型油菜Brown mustard下胚轴的芽再生。实验中还发现在相同的激素配比下,随着Ag-NO3浓度的进一步升高,出芽率反而下降,表现出一定的副作用,这与胥宇建的报道一致[9]。
培养基中植物生长调节剂的组成和配比对不定芽的再生频率也有着重要的影响,不同基因型和外植体对生长调节剂的反应不同。本研究以含3 mg/L 6-BA+5 mg/L AgNO3的分化培养基最适合芥菜型油菜品种Brown mustard下胚轴的芽再生。Maheshwari等[10]的研究表明,培养基中含5 mg/L 6-BA+5 mg/L AgNO3利于甘蓝型油菜下胚轴的芽再生。而曹必好等[11]、Kong 等[12]对甘蓝型油菜和Xiang等[13]对大白菜的试验表明,添加适量的NAA更有利于不定芽的再生。但我们以前的研究表明,一旦添加NAA就伴随着大量根毛的生成,严重影响芽分化,这与汤敏等[14]的研究一致,这可能与植物基因型、外植体类型不同有关。
农杆菌介导的植物遗传转化效率受植物基因型、外植体种类、浸染浓度与时间、培养基等多重因素影响[16]。对于不同基因型、浸染浓度与时间、愈伤诱导和诱导生根等关键步骤中最适激素配比对芥菜型油菜转化的影响还有待进一步研究。
[1] 何雍琴,迟淑娟,杨正安,等.不同浓度6-BA和Ag-NO3对甘蓝叶片不定芽分化的影响[J].云南农业大学学报,2011,26:345 -347,363.
[2] 张 鹏,凌定厚.提高菜心离体植株再生频率的研究[J].植物学报,1995,37(11):902 -908.
[3] Khehra GS,Mathias RJ.The interaction of genotype,explant and media on the regeneration of shoots from complex explants of Brassica napus L[J].Journal of Experimental Botany,1992,43:1413 -1418.
[4] 何小兰,吴敬音,朱卫民.6-BA和AgNO3对甘蓝型油菜带柄子叶外植体不定芽再生的影响[J].江苏农业学报,2001,17(4):211 -214.
[5] 唐桂香,周伟军.AgNO3对甘蓝型油菜子叶外植体植株再生的影响[J].中国油料作物学报,2001,23(3):9-12.
[6] Yoko Akasaka - Kennedy,Hidefumi Yoshida,Yoshihito Takahata.Efficient plant regeneration from leaves of rapeseed(Brassica napus L.):the influence of AgNO3and genotype[J].Plant Cell Rep,2005,24:649 -654.
[7] Muhammad Ramzan Khan,Hamid Rashid,Muhammad Ansar.High frequency shoot regeneration and Agrobacterium-mediated DNA transfer in Canola(Brassica napus)[J].Plant Cell,Tissue and Organ Culture,2003,75:223-231.
[8] 李会珍,张志军,周伟军.基因型和AgNO3对甘蓝型油菜子叶外植体植株再生的影响[J].中国油料作物学报,2003,25:20–22.
[9] 胥宇建,孟 箭,张鲁刚,等.不同激素配比和AgNO3对两种基因型大白菜子叶离体再生的影响[J].植物生理学通讯,2010,46(6):564 -570.
[10] Maheshwari P,Selvaraj G,Kovalchuk I.Optimization of Brassica napus(canola)explant regeneration for genetic transformation[J].New Biotechnology,2011,29:144 -155.
[11] 曹必好,雷建军,宋洪元,等.芥菜农杆菌高效遗传转化体系初步建立[J].华南农业大学学报,2003,24(4):48-51.
[12] Kong F,Li J,Tan X,et al.A new time-saving transformation system for Brassica napus[J].Afr J Biotechnol,2009,8:2497 -2502.
[13] Xiang Y,Wong WKR,Ma MC,et al.Agrobacterium -mediated transformation of Brassica campestris ssp.Parachinensis with synthetic Bacillus thuringiensis cry1Ab and cry1Ac genes[J].Plant Cell Rep,2000,19:251-256.
[14] 汤 敏,官春云,刘忠松.油菜遗传转化体系研究进展[J].作物研究,2012,26(3):295 -298,313.
[15] 杨 柳,刘忠松.油菜农杆菌介导遗传转化体系研究进展[J].作物研究,2007,21(5):650 -653.
[16] Tsukazaki H,Kuginuki Y,Aida R,et al.Agrobacterium-mediated transformation of a doubled haploid line of cabbage[J].Plant Cell Rep,2002,21:257 -262.

