超声电化学快速制备近红外Cd Te量子点与细胞成像
石建军 王 圣 何婷婷 姜立萍
(1安徽理工大学化学工程学院,淮南 232001)
(2南京大学化学化工学院,南京 210093)
半导体量子点具有独特的光学[1-2]和电学[3]性质,已被广泛应用于生物成像[4-5],生物检测[6-8]和太阳能电池[9-10]等研究领域。然而,传统合成方法的复杂过程及其较低的量子产率,在一定程度上限制了量子点的发展和应用。因此,已经有大量的工作专注于提高量子点的量子产率和简化合成过程[11-13]。量子点的制备主要包括水相合成法[14-15]和有机金属法[16-18]。有机相合成的量子点一般具有较高的量子产率[16],但是量子点却不溶于水使其很难应用于生物环境[17-18]。虽然可以进一步将其转变成水溶性量子点,但是量子产率通常很低甚至完全猝灭[19]。与有机金属法相比较,水相合成的量子点具有较好的水溶性与生物相容性。但传统水相合成的量子点量子产率通常较低,仅为5%~10%,经过处理后可达40%[20]。在水相直接制备具有较好荧光性能的水溶性量子点已经成为研究的热点。经过合成方法的不断改进,水相合成量子点的量子产率逐渐提高,已经有报道将CdTe量子点量子产率提高到82%[21],但是其制备过程仍不够简便。
量子点前驱体的可控合成是采用水相法制备高质量量子点的关键。在已报道的CdTe前驱体合成过程中,均需要预先制备H2Te[20-22],NaHTe[21,23-24]等碲前体,而这些碲前体极其不稳定而容易被氧化,因而反应需要在严格的无氧条件下进行且需现配现用。此外,很难控制前驱体的尺寸和形貌,这使得进一步加热回流制备量子点时大大影响其荧光性质。超声电化学方法是一种将超声辐照与电化学方法相结合的一种制备纳米材料的方法[25-27]。目前,通过超声电化学方法已经合成了PbTe[28],Bi2Se3[29]等半导体纳米材料以及 Au[30],Al[31],BiSb 合金[32]等金属纳米材料,但尚无用于量子点合成方面的研究报道。
本文在无需N2保护的条件下,采用超声电化学方法快速合成了CdTe量子点前驱体;通过对反应温度、pH值、电流脉冲宽度等实验参数的调节,实现前驱体的可控制备,并研究了前驱体合成条件对加热回流得到的量子点荧光性质的影响;选用具有近红外发射波长的CdTe量子点用于细胞标记与成像观察。
1 实验部分
1.1 试剂与仪器
3-巯基丙酸(MPA)购于Sigma Aldrich。亚碲酸钠(Na2TeO3),氯化镉(CdCl2)和氢氧化钠(NaOH)购于中国上海试剂公司。子宫颈癌细胞(Hela)购于南京凯基生物科技发展有限公司。无水乙醇(C2H5OH),磷酸二氢钠(NaH2PO4)与磷酸氢二钠(Na2HPO4)购于南京化学试剂厂。罗丹明6G购自天津化学研究所 (天津,中国)。胎牛血清(FBS)、青链霉素、高葡萄糖培养基购自Hyclone公司。不同pH的PBS(0.01 mol·L-1)溶液通过混合NaH2PO4和Na2HPO4的储备液得到,通过 0.01 mol·L-1的 NaOH 和 H3PO4调节。本实验所用试剂均为分析纯,实验用水为去离子水。
采用与文献[25-32]报道的超声电化学装置合成量子点前驱体。以AVCX-750超声处理器(Ti探头,直径 1.13 cm,20 kHz,Sonics&Materials)为超声源;以铂片为对电极(1 cm×1 cm),以钛制超声探头为工作电极,交替施加电流脉冲和超声脉冲;利用CHI6301B电化学工作站和超声处理器控制电流大小、反应时间和脉冲宽度。反应在自制夹套式玻璃电解池中进行,通过循环恒温水浴控制超声电化学反应温度。
通过X射线粉末衍射仪(XRD,Shimadzu XD-3A)表征产物的晶体结构,采用Cu Kα射线(λ=0.154 18 nm),扫描速度为 2°·min-1。 样品形貌通过高分辨透射电子显微镜(HRTEM,JEOL-2100)表征,加速电压为200 kV。光学性质通过紫外-可见吸收光谱(UVVis,Shimadzu UV-3600) 和荧光光谱(PL,Shimadzu RF-5301PC)进行分析。细胞成像在共聚焦激光扫描显微镜(CLSM,Leica TCSSP5,德国)上进行,激发光波长为405 nm。
1.2 CdTe量子点的合成
首先通过超声电化学方法合成CdTe量子点前驱体,对不同条件下制得的前驱体加热回流,以期获得具有近红外发射波长的量子点。考察超声电化学参数和加热回流条件对量子点的荧光性质的影响。 典型的合成过程为:2 mL CdCl2(50 mmol·L-1),17.6 μL MPA 和 1 mL Na2TeO3(50 mmol·L-1)搅拌下依次加入到47 mL水中,用1 mol·L-1的NaOH调节 pH 至 11.0,Cd2+/MPA/TeO32-的物质的量比为 2∶4∶1。在电流为10 mA,电流脉冲宽度为0.5 s,反应温度为20℃的超声电化学条件下反应3 000 s,电解液由无色变为黄棕色。超声脉冲强度为20 W,持续时间0.3 s。将制得的黄棕色的CdTe量子点前驱体溶液置于95℃油浴中加热回流,控制加热时间为15 min到320 min,以制备不同尺寸的CdTe量子点。将回流150 min得到的CdTe量子点用过量的乙醇沉降,通过离心分离提纯后分散于去离子水中备用。
1.3 细胞成像
Hela细胞在一个圆形培养皿中培育,其播种密度为每孔10 000个细胞。培养基为含10%的胎牛血清,L-谷氨酸(2 mmol·L-1),盘尼西林(10 000 units·mL-1)和链霉素(100 mg·mL-1)的DMEM高葡萄糖培养基。经过24 h的培育后,取少量提纯后的CdTe量子点加入到培育基中,在37℃下孵育2 h,接着用10 mmol·L-1pH 7.4的PBS缓冲溶液洗涤,以除去游离的CdTe量子点。共聚焦显微成像在405 nm激发光的氩激光器下获得。对照实验在相同条件下进行。
1.4 荧光量子产率的测定
CdTe量子点的荧光量子产率(Quantum Yields,QYs)通过与罗丹明6G(QY为95%)的乙醇溶液作为参比测定。待测液与罗丹明6G稀释后分别用紫外可见分光光度计测量475 nm处的吸光度。然后用荧光仪在相同的条件下测量上述溶液的荧光发射光谱,计算出荧光发射的积分面积,根据文献[33]的方法计算量子点的荧光量子产率。
2 结果与讨论
2.1 CdTe量子点的表征
CdTe量子点前驱体和回流60 min后获得的CdTe量子点的紫外和荧光光谱如图1所示。在加热回流之前,CdTe纳米粒子尺寸较小,紫外吸收峰在430 nm左右;由于表面存在大量的缺陷,CdTe量子点前驱体没有荧光现象(图1b)。将该前驱体溶液置于95℃油浴加热回流60 min后,由于奥斯瓦尔德熟化作用,CdTe纳米粒子逐渐生长且表面的缺陷被修补[34],量子点紫外吸收峰红移至520 nm左右,并产生560 nm发射波长的荧光。按照文献[35]提出的公式计算得到回流60 min后的CdTe量子点尺寸约为3.4 nm。
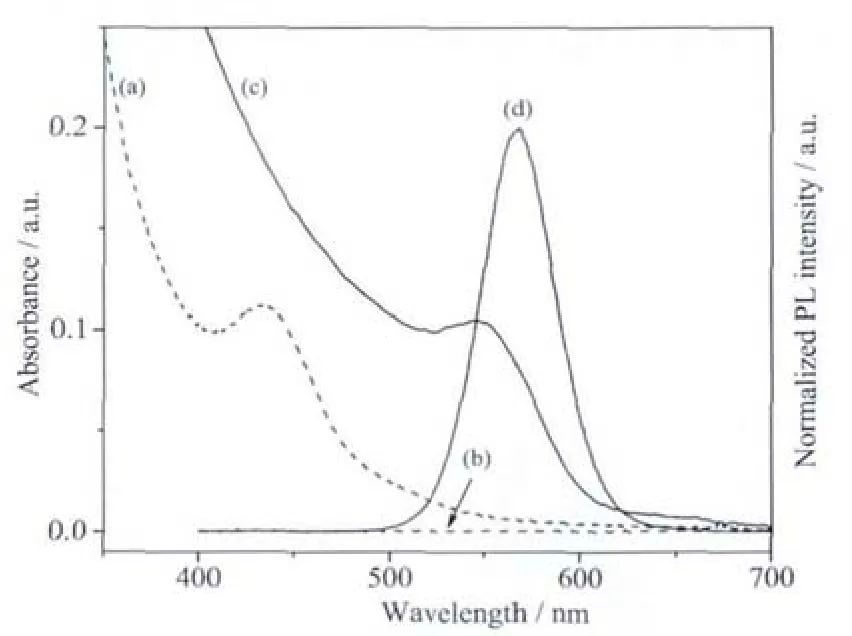
图1 CdTe量子点前驱体的紫外(a)和荧光光谱(b)以及回流60 min制备的CdTe量子点的紫外(c)和荧光光谱(d)Fig.1 UV-Vis absorption(a)and PL spectra(b)of CdTe QDs precursor,UV-Vis absorption(c)and PL spectra(d)of CdTe QDs obtained after refluxing 60 min
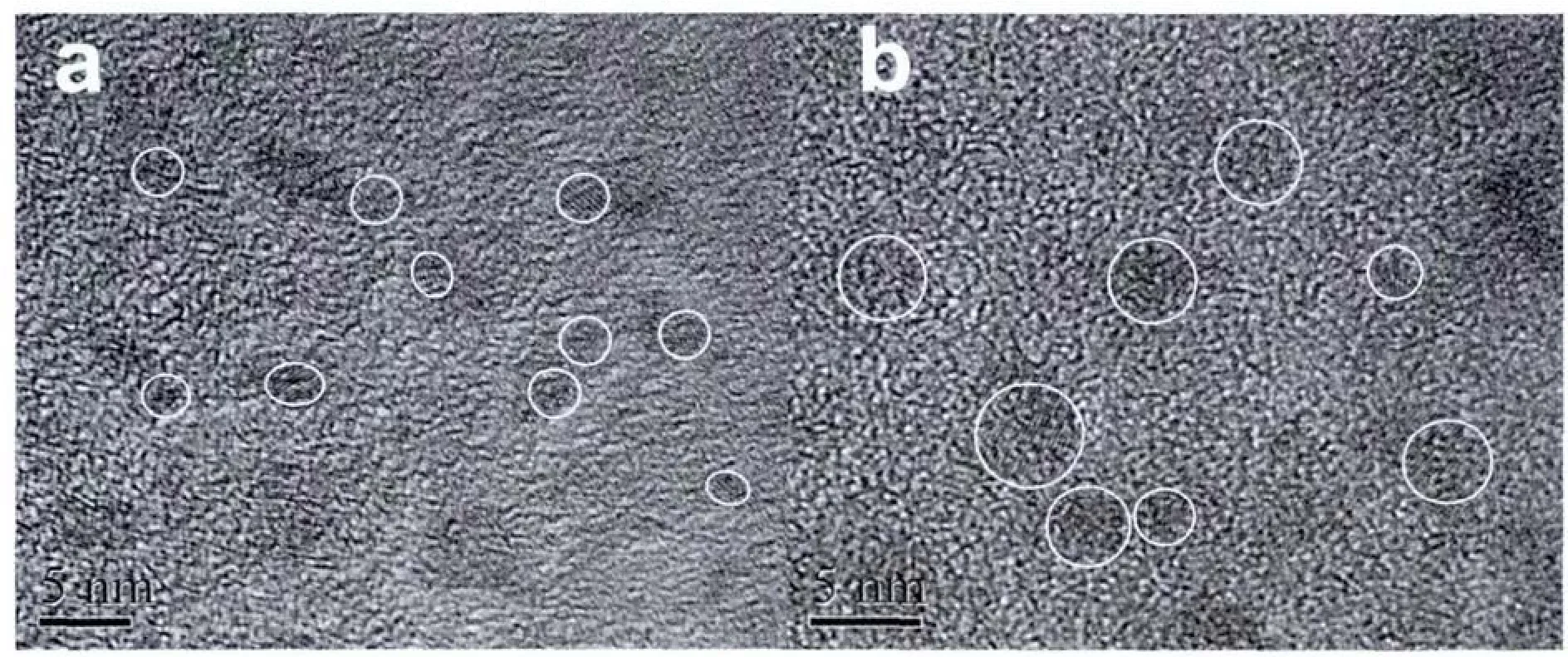
图2 CdTe量子点前驱体(a)和回流60 min制备CdTe量子点(b)的HRTEM图Fig.2 HRTEM of the CdTe QDs precursor(a)and the CdTe QDs after heating 60 min(b)
从图2a所示的CdTe量子点前驱体的HRTEM照片中可看出粒子尺寸约为2 nm。经过60 min的回流后CdTe量子点的HRTEM照片如图2b所示,CdTe纳米粒子在此过程中不断生长,平均尺寸约为3.5 nm,且形状为较为规则的球形。如图3a所示,CdTe量子点前驱体的XRD图显示了一个25°处的峰(111)和一个来自于(220)和(311)衍射峰相重叠的宽吸收带,与闪锌矿晶型的表征衍射图案基本一致 (JCPDS 15-0770)。而经过回流加热后获得的CdTe 量子点的 XRD 图(图 3b)在 25°、41°和 49°处具有3个更加明显的衍射峰,分别对应(111),(220)和(311)3个晶面,说明其具有较好闪锌矿晶型结构。值得注意的是,图3a和3b的衍射峰都向立方晶型的CdS(JCPDS 89-0440)的特征衍射峰偏移,其原因是部分MPA分子的巯基发生水解,释放出的少量S与Cd离子配位,从而使生成的CdTe量子点中含有少量CdS的成分,这种现象在巯基包覆的量子点中较为普遍[36]。

图3 CdTe量子点前驱体(a)和回流60 min制备CdTe量子点(b)的XRD图Fig.3 XRD patterns of CdTe QDs precursor(a)and CdTe QDs after heating 60 min(b);For comparison,the CdTe reflections(black solid dashed)and CdS reflections(red dashed dashed)are given as line-pattern below the recorded diffraction pattern
超声电化学合成CdTe量子点的反应原理如下:首先,Cd2+和TeO32-离子分散于超声电极表面周围;在电流脉冲的作用下,TeO32-被还原成Te2-,而溶液中Cd2+立刻与Te2-在电极表面结合生成CdTe纳米颗粒;接着通过超声脉冲将CdTe纳米颗粒从超声电极表面除去并分散于溶液中;通过上述过程的不断重复,获得了具有良好分散性的CdTe量子点前驱体溶液。将上述量子点前驱体溶液加热回流后,CdTe纳米颗粒快速生长。在生长过程中奥斯瓦尔德熟化作用起主要作用,CdTe纳米颗粒不断重结晶,使得尺寸逐渐增大、表面缺陷不断减少,从而生成了具有荧光性能的量子点溶液。
2.2 超声电化学反应时间的影响
为了考察超声电化学反应过程中CdTe纳米粒子的生长情况,在电流强度为0.01 A,电流脉冲为0.5 s,pH 为 10.0 的条件下反应不同时间,所得产物的紫外-可见吸收光谱如图4所示。反应1 000~3 000 s的紫外吸收峰位置非常接近,说明CdTe纳米粒子尺寸接近。而在3 000 s时,紫外吸收峰峰型较窄,说明此时具有更窄的尺寸分布。当反应时间延长到4 000~6 000 s时,产物的吸收峰逐渐变宽,且逐渐蓝移。这表明,随着反应时间的延长,产物粒径分布逐渐变宽且产物尺寸逐渐减小。其原因是,在反应初期反应物浓度较高,容易获得较大尺寸的纳米粒子。而随着反应的进行,反应物浓度逐渐降低,更易于获得较小尺寸的CdTe纳米粒子,从而导致尺寸分布不断变宽。将不同超声电化学反应时间制得的CdTe量子点前驱体置于95℃油浴中加热回流,获得的CdTe量子点的最大量子产率如图4b所示。随着反应时间的逐渐增加,溶液中CdTe纳米颗粒的数量不断增加,从而为CdTe纳米颗粒生长成为量子点提供了充足的原料,使得最大量子产率不断增大。当反应时间超过3 000 s时,由于溶液中粒径尺寸分布不断增大,导致了最大量子产率减小。为获得粒径均匀且量子产率较高的量子点,超声电化学反应时间控制为3 000 s。

图4 不同反应时间获得的CdTe量子点前驱体:(a)紫外-可见吸收光谱,(b)回流后制备的CdTe量子点的最大量子产率图Fig.4 CdTe QDs precursor obtained at different reaction times:(a)UV-Vis spectra;(b)Maximum PL QY of the QDs prepared from the as-prepared precursor after refluxing
2.3 超声电化学反应温度的影响
图5 a为在不同反应温度下制备获得的CdTe量子点前驱体的紫外光谱。图中可以看出,随着温度的升高,产物的紫外吸收峰逐渐红移,说明CdTe纳米粒子逐渐增大。CdTe纳米粒子在电流脉冲时成核,在超声脉冲停止时生长,在较低的温度下生长速度较慢,因而在较低温度时CdTe纳米粒子尺寸较小,其规律性与文献[26]报道的PbSe纳米粒子的研究结论一致。在5℃时,CdTe纳米粒子尺寸最小,但是此时CdTe纳米粒子的产率较低。因而,反应温度选择在20℃,此时CdTe纳米粒子尺寸较小,且产率较高。当反应温度达到60℃时,由于奥斯瓦尔德熟化作用的增强,产物具有较弱的绿色荧光。
上述不同温度下制备得到的CdTe量子点前驱体置于95℃油浴中加热回流。不同条件下获得最大量子产率如图5b所示,超声电化学反应温度为5℃时,量子产率高达63.2%,而20℃时,量子点的量子产率也高于60%。随着温度逐渐升高,量子产率也逐渐降低。这表明较小尺寸的前驱体更有利于制备得到具有较高量子产率的量子点。
2.4 pH值的影响
为了避免亚碲酸钠的水解,电解液的pH控制在9.0以上,通过紫外-可见吸收光谱表征pH值对CdTe纳米粒子的影响。如图6a所示,在较低的pH条件下,更易于制备获得较大尺寸的CdTe纳米粒子。相比于其他pH,当pH为11.0时,CdTe纳米粒子尺寸较小且粒径分布较窄。上述将不同pH值条件下制备获得CdTe量子点前驱体溶液置于95℃油浴中加热回流,各条件所得量子点最大量子产率如图6b所示。当pH为11.0时,量子产率达到最大值为63.2%,当pH继续增加后,量子产率则急剧下降。
2.5 电流脉冲宽度的影响
图7a为在不同电流脉冲宽度下获得的CdTe量子点前驱体的紫外-可见吸收光谱。从图中可以看出,电流脉冲宽度较小时,紫外吸收波长也较小,说明纳米粒子的尺寸较小。上述在将不同电流脉冲宽度下制备获得的量子点前驱体溶液置于95℃油浴中加热回流,所得量子点的最大量子产率如图7b所示。当电流脉冲时间为0.5 s时,量子产率最高,约为62.7%。当电流脉冲宽度增大至0.8 s以上时,由于CdTe量子点前驱体粒径尺寸的增大和粒径分布的变宽,导致量子产率降低。
2.6 回流时间的影响
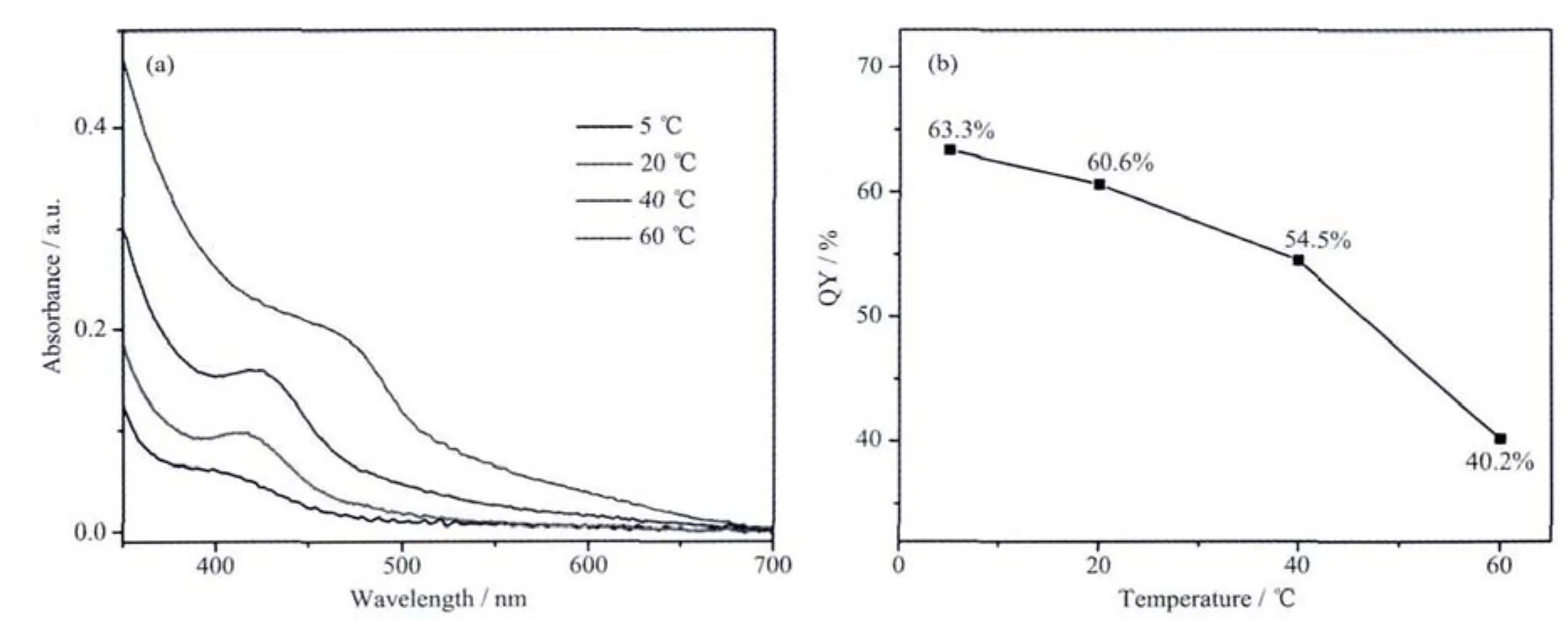
图5 (a)在不同温度下制备CdTe量子点前驱体紫外-可见吸收光谱;(b)不同量子点前驱体回流后制备的CdTe量子点的最大量子产率图Fig.5 (a)UV-Vis spectra of the CdTe QDs precursor synthesized at different temperature of 5℃,20℃,40℃and 60℃;(b)Maximum PL QY of the CdTe QDs prepared from the as-prepared precursor after refluxing
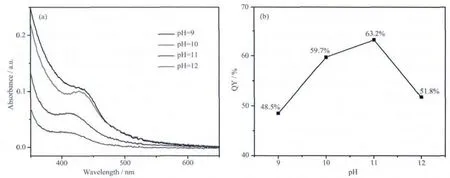
图6 (a)在不同pH下制备的CdTe量子点前驱体紫外-可见吸收光谱;(b)不同前驱体回流后制备CdTe量子点的最大量子产率Fig.6 (a)UV-Vis spectra of the CdTe QDs precursor synthesized at different pH of 9.0,10.0,11.0 and 12.0;(b)Maximum PL QY of the QDs prepared from the as-prepared precursor after refluxing

图7 (a)不同电流脉冲宽度下制备的CdTe量子点前驱体的紫外-可见吸收光谱;(b)不同前驱体回流后制备的CdTe量子点的最大量子产率Fig.7 (a)UV-Vis spectra of the CdTe QDs precursor synthesized at different current pulse widths of 0.2 s,0.5 s,0.8 s and 1.0 s;(b)Maximum PL QY of the QDs prepared from the as-prepared precursor after refluxing
根据上述制备CdTe量子点前驱体条件的讨论,将pH为11.0,电流脉冲宽度为0.5 s,在20℃下超声电化学反应3 000 s后制备的CdTe量子点前驱体置于95℃油浴中加热回流。通过控制回流时间,得到的不同发射波长的CdTe量子点。紫外-可见吸收光谱和荧光光谱如图8a和8b所示,回流仅15 min后便获得了发射波长为530 nm的绿色荧光量子点。随着回流时间的延长,紫外吸收峰和荧光发射峰产生了连续的红移,表明量子点在回流的过程中不断的生长。当回流330 min后,CdTe量子点荧光变为红色,其发射波长达到651 nm。未经提纯处理的CdTe量子点荧光量子产率如图8c所示,起初随着回流时间增加,荧光量子产率也逐渐增加,回流60 min后达到量子产率最大值为62.9%,其发射波长为561 nm。而进一步加热回流后,量子产率逐渐降低。其主要原因为,量子点在回流过程中的生长动力学一般分为两个阶段[34]:第一步是快速生长阶段,较小的晶体快速生长,促进了表面的有序化和重整,有效的消除了表面缺陷,因此量子产率逐渐升高。第二阶段为缓慢的奥斯瓦尔德熟化阶段,此时大晶体的生长主要靠小晶体的溶解来维持,因而导致粒径分布不断增大荧光发射峰半峰宽逐渐变宽,且表面积体积比减小,导致量子产率不断降低。另一方面,随着回流时间的延长,包覆在量子点表面的MPA逐渐分解脱离量子点,导致量子点发生团聚,产生更多表面缺陷,因而导致量子点量子产率降低。
2.7 细胞成像
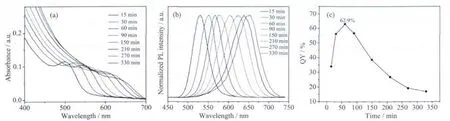
图8 不同回流时间CdTe量子点的(a)紫外-可见吸收光谱,(b)荧光光谱,(c)最大量子产率Fig.8 (a)UV-Vis spectra,(b)PL spectra,(c)Maximum PL QY of CdTe QDs synthesized at different refluxing time
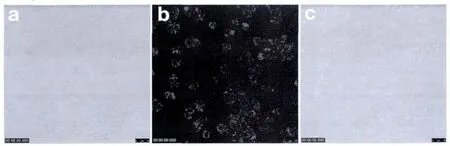
图9 CdTe量子点与Hela细胞孵育后的共聚焦显微镜图:(a)明场图,(b)荧光图,(c)明场与荧光叠加图Fig.9 CLSM of Hela cells after incubation with CdTe QDs(a)bright-field images,(b)fluorescent images,(c)merged images of bright-field images and fluorescent images
由于600 nm以上的红光波段在生物介质中具有较大的渗透深度,且生物体自身的吸收较小,因此选用发射波长为602 nm的CdTe量子点进行细胞成像实验。量子点与Hela细胞的通过共聚焦显微镜成像表征如图9所示,Hela细胞与CdTe量子点孵育后,在荧光下具有强烈的荧光,且能够较清晰的看出Hela细胞的形貌,表明CdTe量子点通过细胞的内吞作用进入细胞。这说明所合成的CdTe量子点具有较好的稳定性和生物相容性,在肿瘤细胞成像方面具有潜在的应用价值。
3 结 论
综上所述,在无N2保护的条件下,采用简便的超声电化学方法快速合成了CdTe量子点前驱体;并对不同条件下制得的前驱体加热回流,得到水溶性、高质量的近红外CdTe量子点。通过控制电流脉冲宽度、反应时间、反应温度等参数,实现了CdTe量子点前驱体的可控制备;通过调节加热回流条件得到不同荧光发射波长的CdTe量子点;选用602 nm发射波长CdTe量子点成功地用于Hela细胞成像。和传统的量子点合成方法相比,这种方法具有合成简单快速、条件温和可控的特点,拓展了超声电化学在纳米材料制备领域的应用,为高品质量子点的快速制备提供了新的思路,可以推广用于其他半导体量子点的制备,并在生物分析领域具有潜在的应用前景。
[1]Yong K T,Law W C,Roy I,et al.J.Biophotonics,2011,4(1-2):9-20
[2]Gui M F,Bao L J,Xia Y S,et al.Biosen.Bioelectron.,2011,30(1):324-327
[3]Scholes G D.Adv.Funct.Mater.,2008,18(8):1157-1172
[4]Chen L N,Wang J,Li W T,et al.Chem.Commun.,2012,48:4971-4973
[5]QIU Yue-Qin(邱月琴),CAI Ji-Ye(蔡继业).Mater.Rev.A(Cailiao Daobao A),2012,26(1):16-19
[6]Chen Z Z,Ren X L,Meng X W,et al.Anal.Chem.,2012,84(9):4077-4082
[7]Shen H P,Lin H,Liu Y Z,et al.J.Phys.Chem.C,2012,116(29):15185-15191
[8]XIE Hai-Yan(谢海燕),PANG Dai-Wen(庞代文).Chin.J.Anal.Chem.(Fenxi Huaxue),2004,32(8):1099-1103
[9]CHEN Zheng(陈征),DENGZhen-Bo(邓振波),ZHOU Mao-Yang(周茂杨).Spectrosc Spect Anal(Guangpuxue Yu Guangpu Fenxi),2012,32(8):2214-2217
[10]Ruland A,Schulz-Drost C,Sgobba V,et al.Adv.Mater.,2011,23(39):4573-4577
[11]Zhou D,Lin M,Chen Z L,et al.Chem.Mater.,2011,23(21):4857-4862
[12]Menezes F D,Galembeck A,Alves Junior S.Ultrason.Sonochem.,2011,18(5):1008-1011
[13]Luo X T,Han J S,Ning Y,et al.J.Mater.Chem.,2011,21(18):6569-6575
[14]Samanta A,Deng Z T,Liu Y.Langmuir.,2012,28(21):8205-8215
[15]WANGShan-Shan(王珊珊),WANGXue-Ting(王雪婷),GUO Ming-Ming(郭明明),et al.Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),2012,33(9):1195-1204
[16]Pickett N L,Lawson S,Thomas W G,et al.J.Mater.Chem.,1998,8(12):2769-2776
[17]Qu L H,Peng X G,J.Am.Chem.Soc.,2002,124(9):2049-2055
[18]Peng Z A,Peng X G.J.Am.Chem.Soc.,2001,123(1):183-184
[19]Talapin D V,Rogach A L,Mekis I,et al.Colloids Surf.,A,2002,202(2/3):145-154
[20]Gaponik N,Talapin D V,Rogach A L,et al.J.Phys.Chem.B,2002,106(29):7177-7185
[21]He Y,Sai L M,Lu H T,et al.Chem.Mater.,2007,19(3):359-365
[22]SUI Chao-Xia(睢 超霞),ZHANG Wen-Hao(张 文 豪).Chem.Res.Appl.(Huaxue Yanjiu Yu Yingyong),2011,23(11):1435-1440
[23]MAO Bing-Xue(毛炳雪),JIANG Hong-Ji(姜鸿基).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2012,28(9):1817-1826
[24]WANG Yi-Lin(王 益 林),WAN Xin(万 鑫),LIU Sheng-Yan(刘声艳),etal.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2012,28(1):97-102
[25]JIANGLi-Ping(姜立萍),ZHANGJian-Rong(张剑荣),WANG Jun(王骏),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2002,18(11):1161-1164
[26]Zhu JJ,Aruna ST,Koltypin Y,et al.Chem.Mater.,2000,12(1):143-147
[27]SHEN Qing-Ming(沈清明),MIN Qian-Hao(闵乾昊),SHI Jian-Jun(石建军),et al.Acta Chim.Sin.(Huaxue Xuebao),2010,68(13):1319-1324
[28]Qiu X F,Lou Y B,Samia Anna C S,et al.Angew.Chem.Int.Ed.,2005,44(36):5855-5857
[29]Qiu X F,Austin L N,Muscarella P A,et al.Angew.Chem.Int.Ed.,2006,45(34):5656-5659
[30]Shen Q M,Min Q H,Shi J J,et al.Ultrason.Sonochem.,2011,18(1):231-237
[31]Mahendiran C,Ganesan R,Gedanken A.Eur.J.Inorg.Chem.,2009(14):2050-2053
[32]Shi JJ,Wang Y J,Ma Y,et al.Ultrason.Sonochem.,2012,19(5):1039-1043
[33]LU Xia(鹿霞),ZHONG Wen-Ying(钟文英),YU Jun-Sheng(于俊生).Chinese J.Anal.Lab(Fenxi Shiyanshi),2009,28(1):36-40
[34]Peng X G,Wickham J,Alivisatos A P.J.Am.Chem.Soc.,1998,120(21):5343-5344
[35]Yu W W,Qu L H,Guo W Z,et al.Chem.Mater.,2003,15(14):2854-2860
[36]Ge C W,Xu M,Liu J,et al.Chem.Commun.,2008(4):450-452

