纳米材料固定化酶的研究进展
高启禹 徐光翠 陈红丽 周晨妍
酶的固定化方法和技术研究是酶工程研究的重点之一,其核心是如何将游离的酶通过一定的方式与水不溶性的载体相结合,同时保持酶的催化活性和催化特性。固定化酶的概念自1953年由德国科学家Gubhofen[1]提出以来,先后经过了实验室研发到工业化生产的重大转折,并建立了传统的固定化酶的基本方法,如包埋法、交联法、吸附法和共价结合法[2]。近年来,随着结构生物学、蛋白质工程及材料科学的不断发展,在酶的固定中出现了一些新型载体和新型技术,从而使酶在负载能力、酶活力和稳定性等方面获得了极大提高,且降低了酶在工农业应用中的催化成本。这些载体和技术包括交联酶聚集体、“点击”化学技术、多孔支持物和最近的以纳米粒子为基础的酶的固定化[3]。纳米材料作为酶固定化的新型载体,能够体现良好的生物相容性、较大的比表面积、较小的颗粒直径、较小的扩散限制、有效提高载酶量及在溶液中能稳定存在等优点[4]。固定化的微粒状态根据纳米材料物理形态的差异性可分为纳米粒(包括纳米球、纳米囊)、纳米纤维(包括纳米管、纳米线)、纳米膜及纳米块等。目前,用于酶固定化的纳米形态以纳米粒(Nanoparticles,Nps)最为常见,纳米粒通常指粒子尺寸在1-1000nm范围内的球状或囊状结构的粒子。而用于酶固定的纳米载体材料有磁性纳米载体、非磁性纳米载体等[5]。但是,在进行相关固定化设计时,仍然需严格遵循固定化酶的主要任务,即一方面要满足应用上的催化要求;另一方面又要满足在调节控制及分离上的非催化要求。
1 用于酶固定化的磁性纳米载体
作为磁性纳米材料由于其良好的活性功能基团(如-OH、-COOH、-CHO、-NH和-SH等)可结合各种功能分子,因而在酶的固定化领域已获得了一定的应用(表1),同时磁性材料在生物医学(临床诊断、靶向药物和酶标)、细胞学(细胞标记和细胞分离等)和生物工程(酶的固定化)及分离工程等方面发展迅速[6]。这种应用与纳米材料的结构特性紧密相关,如表面较平滑、单分散性好、结构疏松等。除此之外,磁场能提供一种有效的酶回收的方法,可通过一定的磁力作用对具有磁性的纳米载体进行回收,从而提高了产物的纯度,避免了最终产品的酶污染。

表1 磁性纳米载体在生物技术上的应用
采用磁性纳米载体进行酶的固定对酶的酶活力和稳定性、酶结构和功能、酶特异性等酶学性质有一定的提高,但在生物催化过程中需充分考虑生物催化剂的回收利用、经济效益及副产物的处置等,以达到最优的固定化设计。Wang等[15]通过共沉淀法对Fe3O4纳米粒子进行了表面不同链长度的烷基硅烷的修饰,获得了改性的Fe3O4粒子,通过对脂肪酶的固定发现,固定化酶的活性及稳定性与增加烷基链的长度有关。Sachin等[16]用新型磁性交联的CLEAs颗粒固定了α-淀粉酶,研究发现α-淀粉酶被固定化后,其对底物的亲和力得到增强,同时也提高了酶的热稳定性和贮存稳定性,即使在贮存42d后仍能保持近100%的酶活。Zhang等[17]成功地将腺苷脱氨酶固定在金纳米(AuNP)微粒上,并用标记检测证实了二者的连接。动力学研究表明,AuNP固定的腺苷脱氨酶仍具有较好的稳定性和催化活性。Natalia等[18]探讨了利用聚合有聚乙二醇的Fe3O4磁性纳米粒子固定α-半乳糖苷酶的固定化效果。研究发现,酶与载体进行了有效的偶联,但偶联效率受纳米粒子直径大小等理化性质的影响,同时在酶的热稳定性上得到了提高。Gardimalla等[19]研究了固定在Fe2O3磁性纳米微粒上的假丝酵母脂肪酶在稳定性方面的改变,结果发现,采用Fe2O3磁性纳米微粒固定脂肪酶可以获得比游离酶更长的可重复利用时间。Hong等[20]发现在空间位阻和静电的共同作用下,结合在表面修饰的纳米金颗粒表面的α-胰凝乳蛋白酶对携带正电荷的底物表现出很强的亲和性,同时具有较高的催化活力,而对携带负电荷的底物仅表现很低的亲和力和催化活力,对中性底物的亲和力和催化能力居中。
2 非磁性纳米载体上酶的固定化
非磁性纳米载体通常由天然高分子材料和人工合成高分子材料制备,目前最常用的方法是利用反胶团进行聚合反应从而制备纳米级高分子载体,然后再通过共价交联或吸附的方法对酶进行固定化[21]。根据高分子材料的性质可将其分为无机纳米载体、有机纳米载体和复合物纳米载体等[22]。非磁性材料的磁电阻效应一般都比较低,因此在特殊的环境中能为酶的应用提供相对容易的调控,而且作为纳米级的生物催化体系,在表面积/体积比上具有独一无二的天然优势。目前,采用非磁性纳米载体进行酶的固定已取得了系列研究成果(表2),同时随着材料科学的进一步发展,必将有更多的新材料被应用于酶的固定化。
使用非磁性纳米载体进行酶的固定前需用傅利叶变换红外光谱、电镜扫描、核磁共振、电感耦合技术及X射线光电子能谱等对纳米微球体作性质测定。同时为提高非磁性纳米载体的固定化效果,通常需对载体表面进行相关的分子修饰(图1),特别在以壳聚糖修饰的纳米载体方面研究较为深入[32]。黄赋等[33]用静电纺丝法制备了丙烯腈/丙烯酸共聚物(PANCAA)纳米纤维膜,以1-乙基-3-(N,N-二甲基氨基丙基)碳二亚胺/Ⅳ-羟基丁二酰亚胺(EDC/NHS)为偶联剂,在纤维膜表面引入壳聚糖修饰层,通过戊二醛将过氧化氢酶固定到壳聚糖修饰的PANCAA纳米纤维膜上,研究结果表明,在壳聚糖浓度为25mg/mL及戊二醛质量分数为5%条件下,壳聚糖修饰膜的固定化酶活性比空白膜提高了41.7%,稳定性也得到了不同程度的提高。Eldin等[34]采用沉淀聚合法将乙二胺与聚丙烯腈-共-甲基丙烯酸纳米微粒共价联接,制备了聚丙烯腈-共-甲基丙烯酸甲酯(PAN-co-MMA)微球,通过对β-半乳糖苷酶的固定化发现,其催化活性、反应稳定性、热稳定性、贮藏稳定性都有所提高。Liu等[35]报道了NAD(H)与SiO2纳米微粒的共价联接,并发现连接了NAD(H)的SiO2纳米微粒可进行多酶共固,如将谷氨酸盐脱氢酶、乳酸脱氢酶和NAD(H)固定后通过耦合反应用来催化生成α-酮戊二酸和乳酸,各种被固定的酶仍具有较好的活性和催化特性。Neri等[36]报道了用固定在聚硅氧烷-聚乙烯醇(POS-PVA)上的β-半乳糖苷酶来合成低聚半乳糖,研究发现,在pH4.5,温度为40℃条件下,低聚半乳糖的合成浓度较高,而且固定化酶可重复利用10次,并保留有原酶活性的84%。

表2 非磁性纳米载体对酶的固定及应用
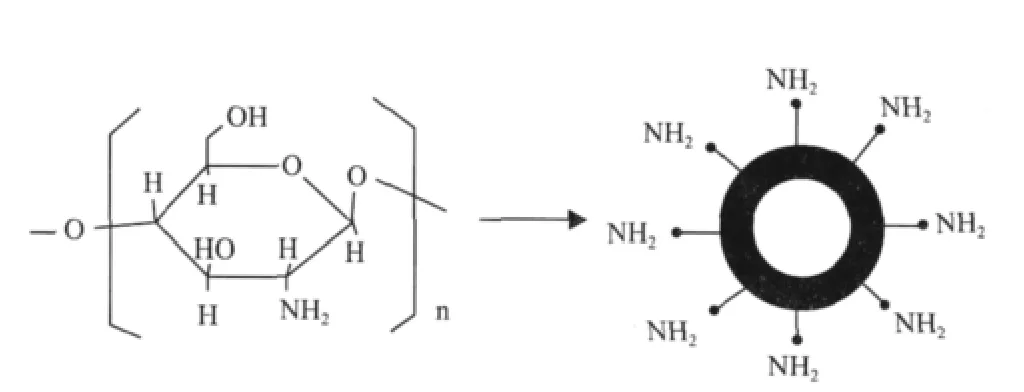
图1 壳聚糖结构及壳聚糖修饰的纳米粒模式图
3 纳米颗粒对核酶的固定化
脱氧核糖核酸(DNA)作为生命体的生物大分子,在生物体内发挥着储存、复制及传递遗传信息的重要功能,其碱基序列的变异与人类许多遗传疾病相关,基于DNA 探针的基因传感器、基因芯片的研究正成为其中的一个研究热点。特别自1989年,诺贝尔化学奖授予Thomas R.Cech及S.Altman以来,核酸分子的自我剪切或自我剪接的分子机制得到了进一步的研究和阐述,可对于核酶的固定化目前仍处于起始阶段,但相对于其它固定化载体而言,由于通过表面修饰的纳米颗粒与DNA具有良好的生物相容性,从而增加了DNA的固定量,增强了固定化DNA的稳定性和定向性。目前DNA常用的固定化方法包括吸附法(直接吸附法、恒电位吸附法、静电吸附法、LB 膜技术)、自组装膜(self-assembly SA)法及亲和素-生物素反应系统固定法[37]。常用到的纳米颗粒有纳米金、碳纳米管、纳米SiO2及ZrO2等[38]。孔德领等[39]以球形纤维素为载体,经环氧氯丙烷活化后共价偶联小牛胸腺DNA,制备DNA 免疫吸附剂,利用抗体抗原特异结合原理,通过血液净化,可有效地清除患者体内DNA 抗体及抗体复合物,达到治疗目的。Li等[40]则利用嵌在SiO2基质中垂直分布的碳纳米管端口的羧基共价固定DNA。刘盛辉等[41]用了氨基乙硫醇在金电极表面形成自组装单分子膜,然后用水溶性的碳化二亚胺作为偶联活化剂,ssDNA 的5'端磷酸基与电极表面自组装膜上的氨基以磷酸氨基酯键的形式共价结合,从而在金电极表面形成ssDNA 单分子层,从而有效地对DNA进行了固定。Cai等[42]把多壁碳纳米管羧基化,从而在玻碳电极的表面形成了均匀的薄膜,使电极的有效面积得到了增加,再以吡咯为介质在电极表面通过电聚合包埋法固定DNA,利用杂交前后电极阻抗的变化实现了DNA 的无指示剂杂交检测。
4 结语
随着纳米新材料的不断出现,特别是对复合纳米材料性质及特性的研究,为纳米材料在酶固定化领域取得更加丰硕的成果成为可能。作为纳米载体固定的酶,在酶与底物及产物的分离、酶的生物相容性、免疫活性和稳定性等方面具有独特的优势,而且由于引入的表面修饰剂的功能基团易于测定和掌握,因而为酶的定向固定提供了极佳的设计思路,同时也使多酶共固变得更加实际。但由于纳米载体的设计相对比较困难,而且作为固定化材料在生产成本及能源消耗等方面还存在一定的劣势,因而在后期采用纳米材料进行酶的固定过程中,应改进现有纳米材料制备的方法,同时,进一步优化纳米材料的比表面积及力学特性,增强其亲和力和生物活性,从而为改善酶的性能及提高酶的应用奠定坚实的基础。
[1] Grubhofer N, Schleith L.Modified ionexchanger resins as specific adsorbent[J].J Naturwissenschaften, 1953, 40:508-508.
[2] Tosa T, Mori T, Fuse N, et al.Studies on continuous enzyme reactions Part V kinetic and industrial application of aminoacylase column for continuous optical resolution of acyl-dl-amino acids[J].J Biotechnol Bioeng, 1967, 9:603-615.
[3] Shakeel AA, Qayyum H.Potential applications of enzymes immobilized on/in nanomaterials:A review[J].J Biotechnology Advances, 2011, 9(5):1016-1028.
[4] 尹艳丽, 王爱玲, 曹健, 等.纳米载体固定化酶的研究[J].现代化工, 2007, 27(9):67-70.
[5] Zuo P, Yu SM, Yang JR, et al.Research progress in supportmaterial for immobilization ofhorseradish peroxidase[J].J Materials Review, 2007, 21(11):46-49.
[6] 张珊, 游长江, 陶潜, 等.磁性高分子微球的制备及其应用[J].广州化学, 2004, 29(2):45-56.
[7] 刘宇, 郭晨, 王锋, 等.磁性SiO2纳米粒子的制备及其用于漆酶固定化[J].过程工程学报, 2008, 8(3):583-588.
[8] Kouassi GK, Irudayaraj J, McCarty G.Examination of cholesterol oxidase attachment tomagnetic nanoparticles[J].J Nanobiotechnol, 2005, 3:1-9.
[9] Huang SH, Liao MH, Chen DH.Direct binding and characterization of lipase ontomagnetic nanoparticles[J].J Biotechnol Prog, 2003,19:1095-1100.
[10] 李咏兰, 吕桂芬, 弓剑, 等.纳米磁性微粒固定化纤维素酶及水解秸秆的研究[J].江西师范大学学报:自然科学版,2011, 35(6):574-578.
[11] Leslie D, Knecht, Nur Ali, et al.Nanoparticle-mediated remote control of enzymatic activity[J].J Acs Nano, 2012, 9:1021-1029.
[12] 潘利华, 罗建平, 王贵娟, 等.磁性纳米氮化铝颗粒固定化β-葡萄糖苷酶的性质[J].催化学报, 2008, 29(10):1021-1026.
[13] Ansari SA, Husain Q.Immobilization of Kluyveromyces lactis β-galactosidase on concanavalin A layered aluminum oxide nanoparticles- its future aspects in biosensor applications[J].J Molecular Catalysis B:Enzyme, 2011, 70:119-126.
[14] Zhou HC, Li W, Shou QH, et al.Immobilization of penicillin g acylase onmagnetic nanoparticlesmodified by ionic liquids[J].J Chinese Journal of Chemical Engineering, 2012, 20(1):146-151.
[15] Wang JQ, Meng G, Tao K, et al.Immobilization of lipases on alkyl silanemodifiedmagnetic nanoparticles:effect of alkyl chain length on enzyme activity[J].Plos One, 2012, 8(7):1-8.
[16] Talekar S, Ghodake V, Ghotage T, et al.Novelmagnetic cross-linked enzyme aggregates(magnetic CLEAs)of alpha amylase[J].Bioresour Technol, 2012, 13(7):542-547.
[17] Zhang LL, Zhao JJ, Jiang JH, et al.Enzyme-regulated unmodified gold nanoparticle aggregation:a label free colorimetric assay for rapid and sensitive detection of adenosine deaminase activity and inhibition[J].Chem Commun, 2012, 48:10996-10998.
[18] Klyachko NL, Sokolsky-Papkov M, Pothayee N, et al.Changing the enzyme reaction rate inmagnetic nanosuspensions by a non-heatingmagnetic field[J].Angewandte Chemie, 2012, 51:1-5.
[19] Gardimalla HM, Mandal D, Stevens PD, et al.Superparamagnetic nanoparticle supported enzymatic resolution of racemic carboxylates[J].J Chem Commun, 2005, 37:4432-4434.
[20] Hong R, Emrick T, Rotello VM.Monolayer-controlled substrate selectivity using noneovalent enzyme-nanoparticle conjugates[J].J Am Chem Soc, 2004, 126(42):13572-13573.
[21] 刘仁霖, 罗晖, 常雁红.纳米级酶固定化技术的发展[J].科学技术与工程, 2007, 7(7):1411-1415.
[22] Zhang X, Guan RF, Wu DQ, et al.Enzyme immobilization on aminofuctionalizedmesostructrued cellular foam surfaces, characterization and catalytic properties[J].J Molecular Catalysis B :Enzymatic, 2005, 38:33-43.
[23] 陈金日, 冉旭, 王利.壳聚糖纳米胶囊固定化α-淀粉酶及其特性的研究[J].中国酿造, 2009, 7(208):81-83.
[24] Neri DFM, Balcão VM, Costa RS, et al.Galactooligosaccharides production during lactosehydrolysis by free Aspergillus oryzae β-galactosidase and immobilized onmagnetic polysilox anepolyvinyl alcohol[J].J Food Chem, 2009, 115:92-99.
[25] 黄磊, 程振民.纳米-微米复合泡沫陶瓷固定化脂肪酶[J].催化学报, 2008, 29(1):57-62.
[26] Jia H, Zhu G, Wang P.Catalytic behaviors of enzymes attached to nanoparticles:the effect of particlemobility[J].J Biotechnol Bioeng, 2003, 84:406-414.
[27] Pandey P, Singh SP, Arya SK, et al.Application of thiolated gold nanoparticles for enhancement of glucose oxidase activity[J].J Langmuir, 2007, 23:3333-3337.
[28] 郭刚军, 马林, 毛学圃, 等.新型芳香胺-邻醌聚合物的合成及其作为纳米固定化酶载体的研究[J].化学学报, 2002, 60(3):499-503.
[29] 王安明, 薛建跃, 万新军, 等.Ag/P(St-MMA)纳米复合高分子微球固定化青霉素酰化酶的研究[J].化工科技, 2007, 15(1):9-12.
[30] 赵炳超, 肖宁, 马润宇.纳米材料MCM-41的制备及其固定化酶的研究[J].北京化工大学学报, 2006, 33(1):8-11.
[31] Miletic N, Abetz V, Ebert K, et al.Immobilization of Candida antarctica lipase B on polystyrene nanoparticles[J].J Macromol Rapid Commun, 2010, 1:71-74.
[32] Chen HL, Yang WZ, Chen H, et al.Surfacemodification ofmitoxantrone-loaded PLGA nanospheres with chitosan[J].Colloids and Surfaces B:Biointerfaees, 2009, 73:212-218.
[33] 黄赋, 王振刚, 万灵书, 等.壳聚糖修饰纳米纤维膜表面对氧化还原酶行为的影响[J].高等学校化学学报, 2010, 31(5):1060-1064.
[34] Eldin MMS, Zatahry AAE, Al-Sabah MB, et al.Immobilization of β-galactosidase onto copolymers nanoparticles of poly(acrylonitrile-co-methylmethacrylate):characterization and application to wheyhydrolysis[J].Nanotechnol Conf USA, 2010.
[35] Liu W, Zhang S, Wang P.Nanoparticle-supportedmulti-enzyme biocatalysis with in situ cofactor regeneration[J].J Biotechnol,2009, 139:102-107.
[36] Neri DFM, Balcao VM, Carneiro-da-Cunha MG, et al.Immobilization of β-galactosidase from Kluyveromyces lactis onto a polysiloxane-polyvinyl alcoholmagnetic(mPOS-PVA)composite for lactosehydrolysis[J].J Catal Commun, 2008, 9:2334-2339.
[37] 蔡宏, 徐颖, 何品刚, 等.脱氧核糖核酸在电极表面的固定化研究进展[J].化学学报, 2004, 32(6):815-820.
[38] 徐桂云, 范金石, 焦奎.纳米颗粒在DNA固定化中的应用进展[J].传感器与微系统, 2008, 27(3):5-8.
[39] 孔德领, 代军, 陈长治, 等.球形纤维素固定化DNA 制备免疫吸附剂[J].高等学校化学学报, 2000, 21(12):1848-1851.
[40] Li J, Hou Ng, Cassell A, et al.Carbon nanotube nanoelectrode array for urltrasensitive DNA detection[J] .Nano Letter, 2003, 3(5):597-602.
[41] 刘盛辉, 陈帆, 奠卫民, 等.单链膜DNA在氨基乙硫醇单分子金电极上固定化的研究[J].高等学校化学学报, 1999, 27(1):38-42.
[42] Cai H, Xu Y, He PG, et al.Indicator free DNAhybridization detection by impedancemeasurement based on the DNA-doped conducting polymer film formed on the carbon nanotube modified electrode[J] .J Electro Analysis, 2003, 15(23-24):1864-1870.

