汽爆玉米秸秆糖化及发酵丁醇工艺的优化研究
刘利平,申利英,常 春
(郑州大学化工与能源学院,河南郑州450001)
0 引言
能源短缺与环境污染,使新型生物能源的开发势在必行.丁醇因其具有能量密度高、易与汽油混合等特点,而成为替代石油的重要选择[1].秸秆是地球上最丰富廉价的资源,以秸秆为原料制备生物丁醇在解决粮食、能源、环境污染等问题中具有重要的作用.
微生物无法直接利用秸秆为底物进行丁醇发酵,需将其水解产生葡萄糖、木糖等单糖后再用于丁醇发酵[2].而水解后还原糖含量直接影响到丁醇的产量.但目前,对经蒸汽爆破预处理的玉米秸秆为原料,进行糖化和丁醇发酵工艺研究的报道较少.李冬敏等[3]用汽爆玉米秸秆进行丁醇发酵,丁醇浓度达到了6.52 g/L.其丁醇含量较低,难以满足规模化应用的条件.因此,本研究尝试首先通过对汽爆玉米秸秆的糖化工艺进行考察,筛选出较佳的糖化工艺,并在此基础上,分别对温度、pH值、底物浓度、纤维素酶用量、菌种种龄及接种量、培养基的组成和发酵时间8个方面进行丁醇发酵工艺条件的试验研究,得出汽爆玉米秸秆发酵丁醇的优化工艺,为进一步的放大试验研究提供参考依据.
1 材料与方法
1.1 试验材料
丙酮丁醇梭菌(Clostridium acetbutylicum ZZU-01):郑州大学生化中心保藏;种子培养基:5%玉米醪;种子液活化:取一玉米醪储存的试管菌种,沸水浴中处理90 s.然后在厌氧操作台上(YQX-Ⅱ厌氧培养箱,上海跃进医疗器械厂)接种于5%玉米醪培养基,活化至对数期;纤维素酶:滤纸酶活力110 IU/mL;汽爆玉米秸秆:将玉米秸秆切至3~4 cm长,于1.5 MPa,205℃条件下汽爆处理8 min,汽爆处理后秸秆经水洗脱毒并于80℃干燥恒重后,保藏待用;酶解液的制备:取一定量烘干的秸秆于锥形瓶中,加自来水,使底物质量分数为15%.然后按照糖化工艺设计的条件加入纤维素酶(30 IU/g),木聚糖酶(200 IU/g),Tween-20(质量分数为0.15%),调pH为4.8,于50℃,150 r/min下反应一定时间后,离心取上清液.
1.2 糖化工艺设计
以蒸汽爆破预处理的玉米秸秆为原料,共进行了6种不同的秸秆糖化发酵丁醇工艺研究(称为糖化工艺Ⅰ~Ⅵ).分别对比了汽爆玉米秸秆经6种糖化工艺后的丁醇发酵结果.不同糖化方法的具体工艺为
糖化工艺Ⅰ:将纤维素酶一次性加入,糖化48 h;
糖化工艺Ⅱ:首先加入纤维素酶量的1/2,反应24 h后再加入1/2纤维素酶,共糖化48 h;
糖化工艺Ⅲ:将纤维素酶分成3等份,首先加入纤维素酶量的1/3,每隔6 h加一次纤维素酶,共糖化24 h;
糖化工艺Ⅳ:纤维素酶加入法与糖化工艺Ⅲ相同,但糖化时间延至48 h;
糖化工艺Ⅴ:首先加入纤维素酶量的1/3,反应24 h后,再加入1/3纤维素酶,剩下的纤维素酶再隔12 h加入,共糖化48 h;
糖化工艺Ⅵ:初始底物体质量分数为15%,加入相应量的纤维素酶,反应24 h,每隔12 h,补一次原料,并且加入相应量的纤维素酶,共糖化48 h.
1.3 发酵培养基与培养方法
发酵培养基:秸秆酶解上清液1 L,酵母抽提物 1 g,KH2PO40.5 g,MgSO4·7H2O 0.3 g,(NH4)2SO45 g,FeSO4·7H2O 0.01 g,尿素 2 g,CaCO35 g[3-4].pH7.0,121 ℃,灭菌 20 min.除了考察培养基的影响因素外,其他试验中的发酵培养基均采用以上基础培养基.
发酵方法:将活化24 h的种子液,按体积分数为5%接种量进行接种,首先采用35℃,厌氧发酵72 h的条件,考察不同糖化工艺对丁醇发酵的影响.在此基础上,对丁醇发酵的温度、底物浓度、纤维素酶的用量、接种量和发酵时间进行了单因素试验;对培养基酵母抽提物,KH2PO4,MgSO4·7H2O,(NH4)2SO4,FeSO4·7H2O,尿素和CaCO3进行了L32(74)正交试验.在优化的基础上,对发酵后的丁醇产量进行了考察.
1.4 分析方法
(1)秸秆成分测定:采用质量减重法[5].
测得汽爆玉米秸秆主要成分为:纤维素的质量分数为33.68%;半纤维素的质量分数为7.29%;木质素的质量分数为22.31%.
(2)还原糖的测定:DNS 法[6].
(3)溶剂的测定:气相色谱法[7].
2 试验结果与分析
2.1 糖化工艺对丁醇发酵的影响
根据1.2节的试验设计,以还原糖含量和发酵丁醇浓度为考察目标,试验结果如表1所示.
表1结果表明,糖化工艺Ⅵ的还原糖含量最高,为48.77 g/L,但丁醇含量仅有4.01 g/L,这可能是因为分批补料糖化使底物浓度增加的同时,也增加了抑制剂的浓度,严重抑制了丁醇发酵.糖化工艺Ⅰ与Ⅱ相比较,可知分步酶解要比一步酶解得到的还原糖含量高,还原糖含量的增加,也使得后续的丁醇发酵的浓度升高.以上结果表明,多步糖化和适当的糖化时间能够更充分地酶解纤维素,提高还原糖的含量,从而提高后续的丁醇发酵浓度.糖化工艺Ⅴ的丁醇产量达到了7.44 g/L,高于其它5种糖化发酵的丁醇产量,因此糖化工艺Ⅴ是汽爆玉米秸秆糖化发酵丁醇工艺中较优的工艺路线.下面在糖化工艺Ⅴ的基础上,进一步优化丁醇发酵的工艺条件.

表1 不同糖化发酵试验结果Tab.1 Fermentative results of different saccharification
2.2 丁醇发酵工艺条件的优化
2.2.1 温度对发酵的影响
本研究以得到最高的丁醇浓度为考察目标,首先对温度的影响进行考察.试验条件为:底物浓度15%(质量分数),纤维素酶用量30 IU/g,接种量7%,基础培养基,发酵时间72 h.不同温度对丁醇发酵的影响如图1所示.由图可知,本试验中发酵温度为37℃时,丁醇产量最高.
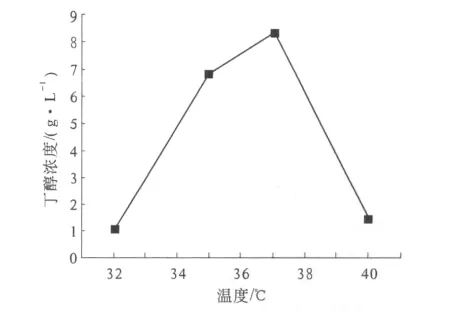
图1 温度对发酵的影响Fig.1 Effect of temperature on fermentation
2.2.2 底物浓度对发酵的影响
通常采用增加底物的方法,获得较高的丁醇产量,提高丁醇生产的经济性.但随着底物的增加,会造成有害抑制物的积累等一系列问题[8].因此寻找适宜的底物浓度显得尤为必要.试验对底物浓度研究条件如下:温度37℃,纤维素酶用量30 IU/g,接种量7%,基础培养基,发酵时间72 h.考察不同底物浓度对发酵的影响,结果如图2所示.由图可知,当底物质量分数为15%时,丁醇浓度最高.

图2 底物浓度对发酵的影响Fig.2 Effect of substrate concentration on fermentiaon
2.2.3 纤维素酶用量对发酵的影响
在丁醇发酵过程中,酶的水解对丁醇的生成有决定性的作用.在温度37℃,底物浓度15%,接种量7%,基础培养基,发酵时间72 h的试验条件下,不同纤维素酶用量对发酵的影响如图3所示.图中结果表明,在纤维素酶用量25~40 IU/g的范围内,丁醇浓度随酶用量的增加而增加.较低的纤维素酶用量,不能有效的将秸秆酶解转化为还原糖,不利于后续的发酵;而较高的纤维素酶用量会增加生产成本.因此,选用30 IU/g为较优的纤维素酶用量.

图3 纤维素酶用量对发酵的影响Fig.3 Effect of loading of cellulose on fermentation
2.2.4 菌种接种量对发酵的影响
在发酵过程中,接种量与菌种的生长速度和丁醇的产量密切相关.因此,在温度37℃、底物浓度15%、纤维素酶用量30 IU/g、基础培养基、发酵时间72 h的试验条件下,进一步考察接种量对发酵的影响,结果见图4.接种量为7%时,丁醇产量最高.而接种量过高或过低,都会造成丁醇浓度明显下降.所以确定7%为最佳接种量.
2.2.5 培养基组成对发酵的影响
发酵培养基的组成对菌体的生长代谢和溶剂的生成有重要的影响.因此笔者重点考察了酵母抽提物(A),KH2PO4(B),MgSO4·7H2O(C),(NH4)2SO4(D),FeSO4·7H2O(E),尿素(F)和CaCO3(G)7种营养物组成对丁醇浓度的影响.试验条件为:温度37℃、底物浓度15%、纤维素酶用量30 IU/g、接种量7%、发酵时间72 h.试验采用L32(74)正交试验进行培养基的优化,优化试验及结果见表2.
由表2的数据可以得到,优化培养基组成为:KH2PO40.8 g/L,MgSO4· 7H2O 0.1 g/L,FeSO4·7H2O 0.01 g/L,尿素3 g/L,CaCO38 g/L.
进一步和丁醇浓度最高的28号试验进行验证试验,结果如表3所示.
由表2和表3的结果,可得到较优的培养基组合为:酵母抽提物 1 g/L,KH2PO40.8 g/L,MgSO4·7H2O 0.1 g/L,(NH4)2SO42 g/L,FeSO4·7H2O 0.03 g/L,尿素2 g/L.在此条件下,发酵的丁醇浓度为9.37 g/L.

图4 接种量对发酵的影响Fig.4 Effect of inoculums on fermentation
2.2.6 发酵时间对发酵的影响
发酵时间直接影响丁醇生产的效率.在温度37℃,底物浓度15%,纤维素酶用量30 IU/g,接种量7%,优化的培养基的条件下,不同发酵时间对发酵的影响结果见图5.
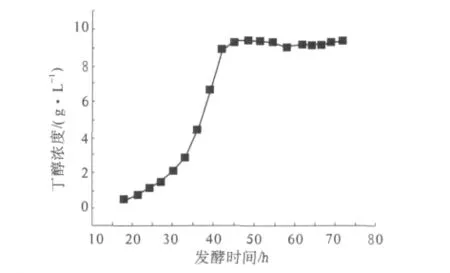
图5 发酵时间对发酵的影响Fig.5 Effect of fermentation time on fermentation

表2 培养优化的正交试验表Tab.2 Results of orthogonal experiment
试验结果表明,当发酵时间达到48 h时,丁醇浓度已基本趋于平稳.因此,可以选择48 h为较优的发酵时间,此时的丁醇含量为9.42 g/L.

表3 两种培养基对发酵的影响Tab.3 Effects of two kinds of medium on fermentation
3 结论
(1)笔者通过对不同糖化发酵丁醇试验结果的比较,得到糖化工艺Ⅴ,即首先加入纤维素酶量的1/3,反应24 h后,再加入1/3纤维素酶,剩下的纤维素酶再隔12 h加入,共糖化48 h是一条较佳的工艺路线.
(2)在糖化工艺Ⅴ的基础上,通过对丁醇发酵工艺中8个影响因素的考察研究,得到了在温度37℃,底物浓度15%,纤维素酶用量30 IU/g,接种量7%,优化的培养基组成:酵母抽提物1 g/L、KH2PO40.8 g/L,MgSO4·7H2O 0.1 g/L,(NH4)2SO42 g/L,FeSO4·7H2O 0.03 g/L,尿素2 g/L,发酵周期为48h的条件下,丁醇浓度达到9.42 g/L.
(3)试验表明汽爆玉米秸秆糖化发酵丁醇,取得了较好的发酵效果,为进一步的放大试验提供参考.
[1]WU M,WANG M,LIU J,et al.Assessment of potential life-cycle energy and greenhouse gas emission effects from using corn-based butanol as a transportation fuel[J].Biotechnology Progress,2008,24(6):1204-1214.
[2]QURESHI N,SAHA B C,DIEN B,et al.Production of butanol(a biofuel)from agricultural residues:Part I-Use of barley straw hydrolysate[J].Biomass and Bioenergy,2010,34(4):559-565.
[3]李冬敏,陈洪章.汽爆秸秆膜循环酶解耦合丙酮丁醇发酵[J].过程工程学报,2007,7(6):1212-1216.
[4]陈守文,马昕,汪履绥,等.稻草酶法水解液的丙酮丁醇发酵[J].工业微生物,1998,28(4):30-34.
[5]常春.生物质制备新型平台化合物乙酰丙酸的研究[D].杭州:浙江大学材料与化学工程学院,2006.
[6]中国食品发酵工业研究院,北京宁馨儿生物科技开发有限公司,诺维信(中国)生物技术有限公司,等.QB 2583—2003附录A(规范性附录)滤纸酶活力(FPA)的测定方法[S].北京:中国轻工业出版社,2003.
[7]刘广慧,朱文众,胡铁功.毛细管气相色谱法分析丙酮和丁醇发酵产物[J].食品与发酵工业,2007,33(11):115-117.
[8]EZEJI T,QURESHI N,BLASCHEK H P.Butanol production from agricultural residues:Impact of degradation products on Clostridium beijerinckii growth and butanol fermentation[J].Biotechnology and Bioengineering,2007,97(6):1460-1469.

