热休克蛋白70-2 和肿瘤坏死因子α 基因多态性与儿童过敏性紫癜相关性研究
管皖珍 杨小凤 袁杨刚 苏 敏 丁桂霞 黄松明 张爱华
人类HSP70 基因与TNF-α 基因均定位于6p21.3 区人类白细胞抗原( HLA) -Ⅲ类分子内。研究表明HLA Ⅰ、Ⅱ类基因与过敏性紫癜( HSP) 发生发展存在相关性。目前研究发现HLA-Ⅲ类C4 基因的C4B* Q0 及C4A* Q0 基因频率的增加与儿童HSP 患病风险有关[1]。HSP70 基因主要包括HSP70-1、HSP70-2 和HSP-hom,其中HSP70-1 结构性低水平表达,可以被热诱导,HSP70-2 基因仅在诱导时表达,而HSP70-hom 基因呈结构性表达,HSP70-2 基因1267位点表现为G-A 多态性[2]。已有研究显示HSP70-2 基因多态性与免疫性疾病发生发展密切相关,如强直性脊柱炎[3]、SLE[4]和糖尿病[5]等,但对于HSP 目前无相关研究。同时,TNF-α 启动子区多态性也被证明与白塞氏病、SLE 等免疫性血管炎存在一定的相关性[6~8]。TNF-α -308 是目前研究的热点位点,但其基因多态性在儿童HSP 的分布以及是否与肾脏受累有关尚无相关报道。本文观察HSP70-2基因1267 位点及TNF-α 基因-308 位点多态性在HSP 患儿的分布,探讨其与肾损害的关系。
1 方法
1.1 HSP 和紫癜性肾炎( HSPN) 诊断标准 依据中华医学会儿科学分会肾脏病学组制定的HSPN 诊断与治疗( 草案)[9]: 有确切的皮肤HSP 病史,伴或不伴腹部及关节症状;尿常规检查正常;排除特发性血小板减少性紫癜、血栓性血小板减少性紫癜及其他血管炎疾病即可诊断HSP; 在HSP 病程中( 多数在6 个月内) ,出现血尿和( 或) 蛋白尿即可确诊HSPN。
1.2 HSP 组纳入标准 同时满足以下条件者被纳入: ①2008 年9 月至2009 年5 月在南京医科大学附属南京儿童医院( 我院) 肾脏科住院治疗的HSP 患儿; ②初发病例: 发病1 个月前无HSP 病史,发病1 个月内因再次出现HSP 典型临床表现收住我院者仍定义为初发;③完成6 个月的随访,明确HSPN 情况,进一步分为肾损害亚组和非肾损害亚组。
1.3 HSP 组排除标准 具有以下任意一项者予以排除:①入院前已有明确肾脏受累或者非急性期的HSP 患儿;②患有其他肾脏疾病,如IgA 肾病、肾病综合征、急慢性肾小球肾炎、遗传学肾炎、肾脏肿瘤、肾脏外伤和肾脏畸形等;③患有其他免疫系统疾病,如SLE、自身免疫性肝炎、强直性脊柱炎、类风湿性关节炎和风湿病等; ④除外其他可能为HSP70-2 或TNF-α 基因缺陷易感疾病,如慢性鼻窦炎、哮喘、慢性支气管炎、纤维化性肺泡炎、糖尿病、慢性淋巴细胞白血病和神经胶质母细胞瘤等疾病[10];⑤发病前3 个月有应用肾损害药物史者;⑥不能提供明确病史或临床资料者。
1.4 对照组 选取我院健康查体儿童( 无现症感染,既往无HSP 病史、免疫性疾病史和家族史,体检、尿常规、血生化及乙肝抗原均未见异常) ,或外科择期手术患儿( 手术疾病与肾脏疾病和免疫性疾病无关) ,病例间无血缘关系。
1.4 随访 由专人对HSP 组患儿进行电话随访,随访时间为6 个月,期间至少进行3 次电话随访。随访内容为询问HSP 症状是否反复和尿液检查结果。
1.5 HSP70-2 和TNF-α 基因多态性检测
1.5.1 DNA 抽提 采集受试者静脉血5 mL,应用美国Promega 公司的试剂盒提取DNA,贮存于-20℃冻存备用。
1.5.2 引物设计 PCR 扩增包含有HSP70-2 基因1267 位点G/A 和TNF-α 基因-308 位点G/A。应用Primer 5.0 软件进行引物设计,扩增HSP70-2 基因的上游引物为5'-AAGGTGCAGAAGCTGCTGCA-3', 下 游 引 物 为 5'-GGACTTGTCCCCCAT-3'; 扩 增TNF-α 基因 的 上 游 引 物 为5'-AGGCAATAGGTTTTGAGGGCCAT-3',下游引物为5'-TCCTCCCTGCTCCGATTCCG-3'。引物由上海英维捷基生物技术有限公司合成。
1.5.3 PCR 反应 20 μL PCR 反应体系加入DNA 模板2 μL 。2 ×Tap PCR MasterMix 购自北京百泰克公司,反应条件为94℃5 min,94℃40 s,59.0℃40 s,72℃40 s,72℃10 min,38 个循环。
1.5.4 酶切产物的检测 20 μL 酶切体系包括15 μL PCR产物和10 U 限制性内切酶NCO Ⅰ( 日本TAKARA 公司) ,37℃酶切16 h 过夜。酶切产物经2.5%琼脂糖凝胶电泳,溴化乙锭( EB) 染色,凝胶成像系统下拍照。
1.6 统计学方法 采用SPSS 13.0 软件进行统计分析,HSP 组和对照组HSP70-2 基因型与Hardy-Weinberg 平衡的符合程度,各组间人群的基因型及等位基因频率的比较采用χ2检验。P <0.05 为差异有统计学意义。
2 结果
2.1 一般情况 共纳入HSP 患儿205 例,男121 例,女84例,年龄2 岁1 个月至14 岁7 个月,平均(8.2 ±2.7) 岁;其中非肾损害亚组121 例,男67 例,女54 例,肾损害亚组84例,男54 例,女30 例。对照组53 例,男33 例,女20 例,平均(8.0 ±2.5) 岁。HSP 组与对照组在性别、年龄差异无统计学意义( P >0.05) 。
2.2 HSP 组与对照组HSP70-2、TNF-α 基因型和等位基因频率比较 基因多态性PCR 检测结果如图1 所示。表1显示,HSP70-2 基因1267 位点GG 基因型频率HSP 组显著高于对照组,差异有统计学意义( P <0. 05) ; TNF-α 基因-308位点AA 基因型HSP 组显著高于对照组( P <0.05) 。HSP 组和对照组HSP70-2 1267 位点A,G 等位基因频率差异无统计学意义( P >0.05) ;TNF-α 基因-308 位点A 等位基因频率HSP 组高于对照组( P <0.05) 。
2.3 非肾脏损害亚组和肾脏损害亚组HSP70-2、TNF-α 基因型和等位基因频率比较 表1 显示,两亚组HSP70-2 基因1267 位点AA、AG、GG 基因型频率和TNF-α 基因-308位点GG、GA、AA 基因型频率差异均无统计学意义( P 均>0.05) ;两亚组HSP70-2 基因A,G 等位基因频率和TNF-α基因G,A 等位基因频率差异均无统计学意义( P 均>0.05) 。
图1 HSP70-2( +1267A/G) 、TNF-α( -308G/A) 基因PCR 结果Fig 1 PCR results of HSP70-2( +1267A/G) and TNF-α( -308G/A) genes
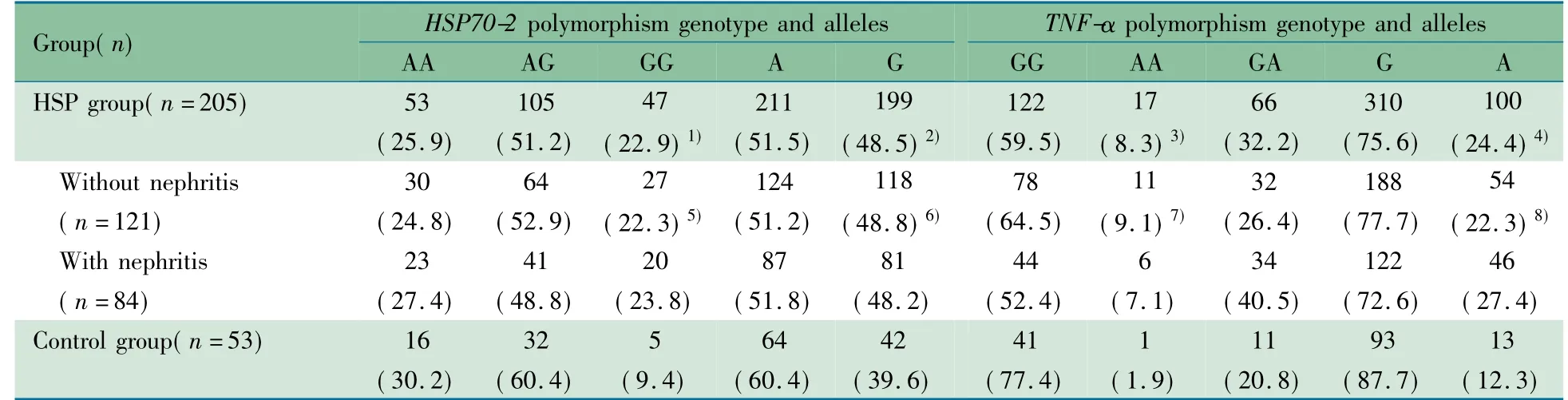
表1 HSP 组与对照组基因型和等位基因频率比较[n( %) ]Tab 1 Comparison of frequency of genotypes between HSP group and control group[n( %) ]
3 讨论
HSP70 家族是HSP 中最保守和最主要的一类,既往文献研究表明,HSP70-2 基因多态性与免疫性疾病发生发展密切相关,其1267 位点A/G 位于编码区,不影响蛋白质中氨基酸顺序,但影响HSP70 mRNA 的表达,GG 纯合基因型较AA 及AG 型HSP70 mRNA 的表达低,从而影响HSP70的表达[11]。本研究发现GG 纯合基因型频率HSP 组高于对照组,差异有统计学意义,提示GG 纯合基因型可能是HSP 发病的遗传学易感因素。而非肾脏损害亚组和肾脏损害亚组其基因型频率差异不显著。HSP70-2 影响免疫性疾病的机制不明,目前有两种观点:①与HSP70-2 基因多态性有关的免疫性疾病可能是由于HSP-HLA( 如HLA-DR3) 连锁效应参与发病,HSP70-2 基因多态性并非是单独影响因素[12];②可能存在HSP70-2 多态性致HSP mRNA 的表达不同,而与参与自身免疫反应时的作用效应有关[13]。此外,HSP70-2 的功能研究也需加强,以探索其在HSP 微血管病变过程中的作用。HSPN 为HSP 的严重并发症。本研究肾损害亚组HSP70-2( +1267A/G) 基因型频率与非肾损害亚组无明显差异,提示该多态性并不增加HSPN 的易感性。SLE 与HSP 同为免疫性血管炎,有研究表明[13,14]HSP70 是美国黑人、白种人SLE 易感因素,HSP70-2 频率增高是否增加HSPN 的易患性,仍有待更多不同种族、大样本的研究以明确。由此也提示是否有其他遗传因素或者环境因素、感染因素等促使部分免疫性疾病患者病变累及肾脏。
本研究结果显示,HSP 组TNF-α -308 位点AA 基因型及A 等位基因频率高于对照组,差异有统计学意义( P <0.05) ,提示TNF-α -308 位点基因多态性与HSP 易感性有相关性。2004 年Yang 等[15]对29 例HSP 患儿和36 名健康儿童的TNF-α-308 位点基因多态性对比研究,未发现TNF-α-308 位点基因多态性与HSP 之间有相关性。与本研究结果不符,考虑可能是因为其样本量较小。本研究同时显示,非肾脏损害亚组和肾损害亚组其基因型频率及等位基因频率差异无统计学意义,提示与肾损害发展无明显相关性。欧洲有报道TNF-α-308 位点基因型和等位基因与ERSD、IgAN 等肾脏疾病相关[16~19],本研究结果与上述研究结果不符的原因可能有: ①HSPN 与终末期肾病、IgA肾病等肾脏疾病有不同的易感基因型,目前研究多集中在TNF-α-308 位点基因多态性对终末期肾病等易感性的影响。②从遗传角度看,机体对HSPN 易感性受多个基因共同影响;和其他易感基因相比,TNF-α -308 位点基因多态性可能对其影响的权重较小。③可能有人种以及地理位置的差异。
[1]Stefansson TV, Kolka R, Sigurdardottir SL, et al. Increased frequency of C4B* Q0 alleles in patients with Henoch-Schonlein purpura. Scand J Immunol,2005,61(3):274-278
[2]Milner CM, Campbell RD. Polymorphic analysis of the three MHC-linked HSP70 genes. Immunogenetics,1992,36(6):357-362
[3]Vargas-Alarcon G, Londono JD, Hernandez-Pacheco G, et al.Heat shock protein 70 gene polymorphisms in Mexican patients with spondyloarthropathies. Ann Rheum Dis,2002,61(1):48-51
[4]Pablos JL, Carreira PE, Martin-Villa JM, et al. Polymorphism of the heat-shock protein gene HSP70-2 in systemic lupus erythematosus. Br J Rheumatol,1995,34(8):721-723
[5]Chuang LM, Jou TS, Wu HP, et al. A rapid method to study heat shock protein 70-2 gene polymorphism in insulindependent diabetes mellitus. Pancreas,1996,13(3):268-272
[6]Arayssi TK, Hamdan AR, Touma Z, et al. TNF polymorphisms in Lebanese patients with Behcet's disease.Clin Exp Rheumatol,2008,26(4 S50):130-131
[7]Farid TM, Abd El Baky AM, Khalefa ES, et al. Association of tumor necrosis factor-alpha gene polymorphisms with juvenile systemic lupus erythematosus nephritis in a cohort of egyptian patients. Iran J Kidney Dis,2011,5(6):392-397
[8]Lin YJ, Chen RH, Wan L, et al. Association of TNF-alpha gene polymorphisms with systemic lupus erythematosus in Taiwanese patients. Lupus,2009,18(11):974-979
[9]Dedeoglu F, Sundel RP. Vasculitis in children. Pediatr Clin North Am,2005,52(2):547-575
[10]Soylemezoglu O, Peru H, Gonen S, et al. HLA-DRB1 alleles and Henoch-Schonlein purpura: susceptibility and severity of disease. J Rheumatol,2008,35(6):1165-1168
[11]Pociot F, Ronningen KS, Nerup J. Polymorphic analysis of the human MHC-linked heat shock protein 70 (HSP70-2) and HSP70-Hom genes in insulin-dependent diabetes mellitus(IDDM). Scand J Immunol,1993,38(5):491-495
[12]Vargas-Alarcon G, Granados J, Martinez-Laso J, et al. Lack of association between the polymorphism at the heat-shock protein (HSP70-2) gene and systemic lupus erythematosus(SLE) in the Mexican mestizo population. Genes Immun,2000,1(6):367-370
[13]Jarjour W, Reed AM, Gauthier J, et al. The 8.5-kb PstI allele of the stress protein gene, Hsp70-2: an independent risk factor for systemic lupus erythematosus in African Americans?Hum Immunol,1996,45(1):59-63
[14]Furnrohr BG, Wach S, Kelly JA, et al. Polymorphisms in the Hsp70 gene locus are genetically associated with systemic lupus erythematosus. Ann Rheum Dis,2010,69(11):1983-1989
[15]Yang YH, Lai HJ, Kao CK, et al. The association between transforming growth factor-beta gene promoter C-509T polymorphism and Chinese children with Henoch-Schonlein purpura. Pediatr Nephrol,2004,19(9):972-975
[16]Manchanda PK, Kumar A, Kaul A, et al. Correlation between a gene polymorphism of tumor necrosis factor-alpha (G/A) and end-stage renal disease: a pilot study from north India. Clin Chim Acta,2006,370(1-2):152-157
[17]Nikolova PN, Ivanova MI, Mihailova SM, et al. Cytokine gene polymorphism in kidney transplantation-impact of TGF-beta 1,TNF-alpha and IL-6 on graft outcome. Transpl Immunol,2008,18(4):344-348
[18]Basturk B, Yavascaoglu I, Vuruskan H, et al. Cytokine gene polymorphisms as potential risk and protective factors in renal cell carcinoma. Cytokine,2005,30(1):41-45
[19]Coppo R, Amore A, Chiesa M, et al. Serological and genetic factors in early recurrence of IgA nephropathy after renal transplantation. Clin Transplant,2007,21(6):728-737

