氦氧混合气吸入联合经鼻间歇正压通气治疗新生儿呼吸窘迫综合征的随机对照研究
李 雪 沈 洁 赵锦林 唐仕芳 胡章雪 史 源
早产儿因肺泡表面活性物质缺乏易患新生儿呼吸窘迫综合征( NRDS) ,呼吸机辅助通气在NRDS 的治疗中占据着十分重要的地位[1]。经鼻间歇正压通气( NIPPV) 可降低早产儿拔管后再插管比率,有助于治疗早产儿呼吸暂停,可作为其呼吸支持的初始模式[2,3]。氦氧混合气( helium-oxygen mixture,heliox) 具有降低气道阻力、减轻呼吸肌疲劳和促进氧合等优点[4,5],目前已被引入新生儿[6]及婴幼儿[7]呼吸系统疾病的治疗,展现了显著疗效。除此之外,氦气还被发现可对心脏、肺脏、大脑和免疫系统等发挥细胞保护作用[8]。目前国内外尚无heliox 吸入联合NIPPV 应用于新生儿的报道,本研究旨在评价NIPPV 联合应用heliox 对NRDS 的疗效及其对炎症因子和心肌损伤标志物的影响。
1 方法
1.1 注册 本研究在美国国立卫生研究院网站( www.clinicaltrials.gov) 注册( ID:NCT01759316) 。
1.2 伦理和知情同意 本研究经第三军医大学大坪医院( 我院) 伦理委员会批准,所有受试早产儿的监护人均在试验前签署书面知情同意书。
1.3 诊断标准 NRDS 的诊断标准参考《实用新生儿学》第4 版:①病史: 生后6 ~12 h 内出现进行性呼吸困难; ②临床表现:生后不久出现呼吸急促,呼吸频率>60·min-1,呼气性呻吟,吸气时三凹征,继而出现呼吸不规则、呼吸暂停、青紫和呼吸衰竭;③体征:双肺呼吸音减低;④X 线胸片提示有毛玻璃样改变及支气管充气征。
1.4 纳入标准 同时满足以下条件者:①我院NICU 收治的胎龄<37 周,出生体重>1 000 g 的早产儿; ②符合NRDS 的诊断;③患儿生后1 h 内需吸氧( 浓度≥30%) 以维持PaO2>50 mmHg 及经皮氧饱和度≥88%( 亦即我院新生儿科NIPPV 上机常规要求) 。
1.5 排除标准 具备以下任一项者:①合并肺炎、新生儿湿肺和胎粪吸入综合征者;②确诊为先天性疾病或遗传性疾病;③严重呼吸衰竭或呼吸暂停需气管插管;④拒绝参与临床试验者。
1.6 分组方法 符合入组条件的早产儿在取得书面知情同意书后,按随机数字表法分为试验组和对照组,分组序列号装入密闭信封,在试验前由不产生随机序列的试验人员抽取确定分组。
1.7 干预和上撤机标准
1.7.1 干预 使用瑞士菲萍新生儿呼吸机进行呼吸支持。试验组吸入储存在40 L 气瓶中的heliox( 氦∶氧为70∶30) ,气瓶通过改装后的设备与呼吸机连接进行供氧,3 h 后更换气源为医院中心设备提供的30%空氧混合气( air-oxygen mixture,airox) 直至患儿撤除NIPPV。对照组同样使用airox 直至撤除NIPPV。两组气体吸入前均由呼吸机配套设备加温加湿。吸气峰压初始设置均为20 ~25 cmH2O,呼气末正压5 cmH2O,吸气时间0.4 ~0.5 s,呼吸次数20 ~30·min-1,研究过程中各参数恒定不变。
1.7.2 上机和撤机标准 同一名主管医师根据新生儿情况决定上机或撤机。NIPPV 上机标准:同本文纳入标准③;撤机标准:患儿吸入室内空气氧可使氧饱和度维持在88%以上,无呻吟、发绀、呼吸困难及三凹征( 亦即我院新生儿科撤机常规要求) 。
1.7.3 气管插管指征 pH <7.2,吸氧浓度>50%时PaO2<50 mmHg,PaCO2>60 mmHg 或呼吸暂停频繁,每h 4 次或每次>20 s( 亦即我院新生儿科气管插管常规要求) 。
1.8 退出标准 ①研究过程中( 未成功撤除NIPPV 前) 因呼吸衰竭需行气管插管;②因社会经济因素主动退出研究;③研究过程中( 3 h 内) 吸入30%浓度氧经皮氧饱和度<85%。
1.9 观察指标
1.9.1 基线资料 患儿胎龄、孕次、产次、生产方式、出生体重、Apgar 评分、产前激素使用情况和母妊娠期合并症。
1.9.2 主要观察指标 以患儿使用NIPPV 时间和成功撤除NIPPV 再次气管插管率为主要结局指标。
1.9.3 次要观察指标 ①研究开始前(0 h) 和开始后1、2和3 h 测定患儿的经皮氧分压( TcPO2) 和二氧化碳分压( TcPCO2) ( 丹麦雷度TCM 经皮血氧监护仪) ;②研究开始前(0 h) 和开始后3 h 留取血标本由医院检验科测定IL-6、肌酸激酶( CK) 和肌酸激酶同工酶-MB( CK-MB) 水平,研究开始后3 h 时点留取血标本由武汉康圣达医学检验所使用ELISA 试剂盒测定肺炎症因子,包括丙二醛( MDA) ,髓过氧化物酶( MPO) ,TNF-α 和诱导型一氧化氮合酶( iNOS) 水平。
1.9.4 并发症 新生儿入组至出院期间出现的早产儿视网膜病,新生儿坏死性小肠结肠炎,支气管肺发育不良,心室内出血,脑白质软化症。
1.9.5 安全性指标 氦气具有良好的生物安全性,目前仅有报道[9]可引起低体温症( 体温降至35℃以下) ,故研究期间密切监测患儿体温。
1.10 统计学方法 采用SPSS 17.0 软件进行统计分析。由不参与试验设计和实施的人员进行数据的统计分析。正态分布的计量资料用x±s表示。两样本均数比较采用t 检验,计数资料采用χ2检验,重复测量数据采用单因素方差分析进行统计。统计分析遵循意向性治疗( ITT) 分析原则。P <0.05 为差异有统计学意义。
2 结果
2.1 一般情况 2012 年12 月至2013 年5 月NICU 共收治303 例早产儿,64 例被诊断为NRDS,其中36 例( 试验组19 例,对照组17 例) 符合纳入标准进入研究,均完成研究,无退出病例( 图1) 。
36 例患儿中4 例为极低出生体重早产儿( 对照组和试验组各2 例) ,无超低出生体重早产儿。表1 显示,试验组和对照组在胎龄、性别、孕次、产次、出生体重、出生方式、产前激素使用状况、Apgar 评分、母妊娠期合并症等基线资料方面差异均无统计学意义( P >0.05) 。

图1 研究对象纳入和排除流程图Fig 1 Flow chart of including and excluding procedure for the premature infants with respiratory distress syndrome

表1 两组患儿的基线资料[x±s,n( %) ]Tab 1 Baseline characteristics of infants in two groups[x±s,n( %) ]
2.2 两组NIPPV 使用时间和再次气管插管率 试验组NIPPV 使用时间显著低于对照组,( 39.3 ± 15.1) h vs(57.8 ±25.0) h,P=0.02。对照组有3 例(17.7%) 成功撤除NIPPV 后24 h 内因呼吸衰竭再行气管插管,试验组患儿全部成功撤除NIPPV,均未再行气管插管,两组差异无统计学意义( P=0.10) 。
2.3 两组血气指标比较 图2 显示,研究开始后3 h 时点,两组TcPO2和TcPCO2较吸入前均明显改善( P <0.001) 。试验组TcPO2高于对照组,但不同时间点两组差异均无统计学意义( P >0.05) 。吸入heliox 后TcPCO2均值从42.83 mmHg 降至32.44 mmHg,而对照组TcPCO2从45.12 mmHg 降至39.12mmHg。试验组CO2清除率优于对照组(10.39 mmHg vs 6.0mmHg) ,差异有统计学意义( P =0.03) 。
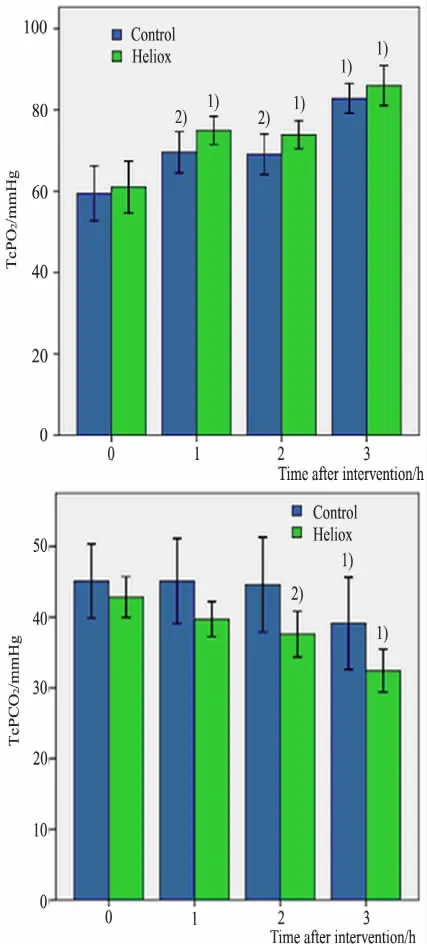
图2 研究开始后3 h 内TcPO2及TcPCO2的变化Fig 2 Changes of TcPO2 and TcPCO2 during the first 3 hours after administration
2.4 两组炎症因子及心肌损伤标志物比较 表2 显示,研究开始后3 h 时点,试验组IL-6 水平略低于对照组,两组差异无统计学意义( P >0.05) 。两组MDA、MPO、TNF-α 及iNOS 水平差异均无统计学意义( P >0.05) 。对照组CK、CK-MB 水平略高于试验组,但差异无统计学意义( P >0.05) 。
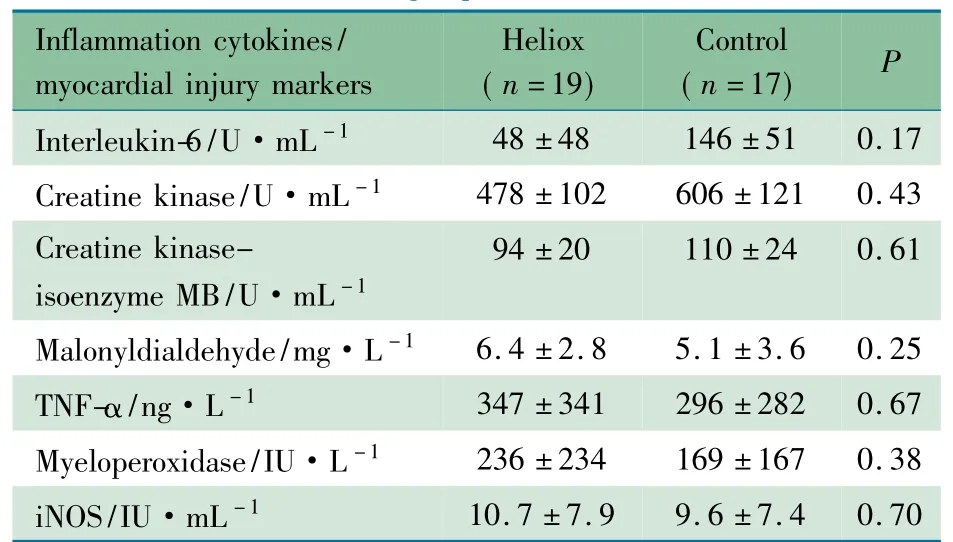
表2 两组炎症因子和心肌损伤标志物水平比较( x±s)Tab 2 Comparison of inflammation cytokines and myocar-dial injury markers between two groups( x±s)
2.5 NIPPV 使用时间和IL-6 水平相关性 试验组和对照组NIPPV 使用时间和基线IL-6 水平均无显著相关性( r =0.362,P=0.128; r =0.452,P =0.069) ,两组合并显示NIPPV 使用时间与基线IL-6 水平呈正相关( r=0.474,P=0.006) 。
2.6 并发症发生情况 研究期间试验组动脉导管未闭9例(36.8%) ,对照组5 例( 29.4%) ; 新生儿坏死性小肠结肠炎试验组3 例(15.8%) ,对照组1 例(5.9%) ,差异均无统计学意义( P 均>0.05) 。两组均未观察到早产儿视网膜病、支气管肺发育不良、心室内出血和脑室周白质软化的发生。
2.7 安全性指标 试验组在研究期间未观察到低体温事件。
3 讨论
新生儿特别是早产儿因肺泡表面活性物质缺乏易患NRDS,以顽固性低氧血症、呼吸窘迫、肺顺应性下降和弥散性渗出为主要特征。NRDS 是新生儿病房的常见急危重症,病死率高,其救治仍是医生关注的热点问题。Heliox 具有改善肺通气及肺换气的作用,其在NICU[10,11]和PICU[12]的应用越来越受到关注。呼吸机辅助通气联合应用heliox在婴幼儿喉炎、哮喘、毛细支气管炎和NRDS 等疾病中均取得了良好疗效[4,13,14]。Heliox 联合应用持续正压通气( CPAP) 可缩短毛细支气管炎患儿的吸氧时间[15],Elleau等[16]发现heliox 可缩短NRDS 患儿气管插管的时间。然而,目前国内外尚未见heliox 联合应用无创辅助通气缩短新生儿上机时间的报道。与CPAP 相比较,NIPPV 可降低早产儿拔管后再插管的风险,对早产儿呼吸暂停更为有效[2,3]。
无创辅助通气较机械通气而言有诸多优势,但可能需要较长的呼吸支持时间或更高的参数来实现相同程度的氧合。本研究发现,NIPPV 联合应用heliox 可明显缩短患儿的上机时间,提示heliox 吸入可能为此提供新的解决方案。Colnaghi 等[11]使用CPAP 对早产儿进行呼吸支持时发现,heliox 组与对照组的机械通气时间差异并无统计学意义。而在一项大样本多中心随机双盲研究中发现,heliox 的吸入方式对其最终疗效十分重要[15]。本研究采用NIPPV 对早产儿进行呼吸支持,可能与NIPPV 提高了heliox 吸入治疗的效率有关。本研究发现,heliox 吸入结束后,试验组CO2清除率明显高于对照组,与Dani 等[17]和Martinon等[10]的研究结果一致,这可能与CO2在heliox 中扩散速率更快有关[5,18]。NRDS 患儿呼吸道因炎症反应和水肿变得狭窄[19],而heliox 特殊的物理特性使其可明显改善患儿呼吸道梗阻症状,为其应用于临床提供了可能。
动物研究显示氦气可在缺血再灌注过程中介导心脏保护作用[20~23],但目前并无临床试验证实此结论。NRDS 新生儿常合并心肌损伤,实验室检查可发现心肌酶谱数倍升高。心肌损伤可引起心肌细胞收缩乏力,增加早产儿心力衰竭的风险。本研究试验组心肌损伤程度指标CK 和CKMB 有低于对照组的趋向,但差异有统计学意义,可能与样本量较小和heliox 吸入时间较短等因素有关。
ARDS 的动物实验发现,heliox 可明显减少小鼠肺泡水肿、出血、中性粒细胞浸润和肺透明膜形成,显著降低iNOS活性[24]。Nawab 等[25]在乳猪肺损伤模型中发现,heliox 可减轻其损伤过程中的肺部炎症反应和结构重构。此外,吸入氦气还被发现可在人体缺血再灌注过程中发挥中度抗炎作用[26]。然而本研究发现,两组患儿TNF-α,MDA,MPO和iNOS 在治疗后并无显著差异,这可能与样本量较小和heliox 吸入时间较短有关。氦气在控制IL-6 释放方面有一定作用,但两组数据并未显示出统计学差异。高流量和高氧是呼吸机辅助通气过程中导致肺部炎症和结构重构的主要因素,heliox 可能通过减轻机械和氧气压力发挥抗炎作用,但这仍需大样本的研究进一步证实。
NRDS 患儿因肺泡表面活性物质缺乏导致肺泡不易扩张并趋于萎缩,继而出现中性粒细胞浸润和肺透明膜形成等病理改变,加重急性期NRDS 患儿缺氧、高碳酸血症和代谢性酸中毒。本研究发现NRDS 新生儿的NIPPV 使用时间与基线IL-6 水平呈正相关,NRDS 急性期的炎症反应可能对新生儿的NIPPV 使用时间有所影响,这提示应早期采取措施控制炎症反应以减轻肺损伤程度。试验组患儿NIPPV 使用时间明显缩短,提示在NRDS 急性期吸入heliox可能有助于减轻早产儿肺部炎症反应。
4 结论
NIPPV 联合应用heliox 可提高NRDS 患儿CO2清除率,缩短其NIPPV 使用时间。Heliox 对炎症介质和心肌损伤有无保护作用,仍需进一步研究。大样本的RCT 研究对进一步评估Heliox 在临床的应用价值具有重要意义。
[1]Lista G, Castoldi F, Bianchi S, et al.Surfactant and mechanical ventilation.Acta Biomed,2012,83(S1):21-23
[2]Davis PG, Morley CJ, Owen LS. Non-invasive respiratory support of preterm neonates with respiratory distress:continuous positive airway pressure and nasal intermittent positive pressure ventilation.Semin Fetal Neonatal Med,2009,14(1):14-20
[3]Khalaf MN, Brodsky N, Hurley J, et al.A prospective randomized, controlled trial comparing synchronized nasal intermittent positive pressure ventilation versus nasal continuous positive airway pressure as modes of extubation.Pediatrics,2001,108(1):13-17
[4]Frazier MD, Cheifetz IM.The role of heliox in paediatric respiratory disease.Paediatr Respir Rev,2010,11(1):46-53
[5]Gupta VK, Cheifetz IM.Heliox administration in the pediatric intensive care unit: an evidence-based review.Pediatr Crit Care Med,2005,6(2):204-211
[6]Szczapa T, Gadzinowski J.Use of heliox in the management of neonates with meconium aspiration syndrome.Neonatology,2011,100(3):265-270
[7]Bigham MT, Jacobs BR, Monaco MA, et al.Helium/oxygendriven albuterol nebulization in the management of children with status asthmaticus: a randomized, placebo-controlled trial.Pediatr Crit Care Med,2010,11(3):356-361
[8]Oei GT, Weber NC, Hollmann MW, et al.Cellular effects of helium in different organs.Anesthesiology,2010,112(6):1503-1510
[9]Martinón-Torres F, Rodríguez-Núñez A, Martinón-Sánchez JM.Heliox therapy in infants with acute bronchiolitis. Pediatrics,2002,109(1):68-73
[10]Migliori C, Gancia P, Garzoli E, et al. The Effects of helium/oxygen mixture (heliox) before and after extubation in longterm mechanically ventilated very low birth weight infants.Pediatrics,2009,123(6): 1524-1528
[11]Colnaghi M, Pierro M, Migliori C, et al. Nasal continuous positive airway pressure with heliox in preterm infants with respiratory distress syndrome. Pediatrics,2012,129(2): 333-338
[12]Martinón-Torres F, Rodríguez-Núnez A, Martinón-Sánchez JM.Nasal continuous positive airway pressure with heliox versus air oxygen in infants with acute bronchiolitis: a crossover study.Pediatrics,2008,121(5):1190-1195
[13]Martinón-Torres F.Noninvasive ventilation with helium-oxygen in children. J Crit Care,2012,27(2): 1-9
[14]Myers TR. Therapeutic gases for neonatal and pediatric respiratory care. Respir Care,2003,48(4): 399-425
[15]Chowdhury MM, McKenzie SA, Pearson CC, et al. Heliox therapy in bronchiolitis: phase III multicenter double-blind randomized controlled trial. Pediatrics,2013,131(4): 661-669
[16]Elleau C, Galperine RI, Guenard H,et al. Helium-oxygen mixture in respiratory distress syndrome: a double-blind study.J Pediatr,1993,122(1): 132-136
[17]Dani C, Fontanelli G, Lori I,et al. Heliox non-invasive ventilation for preventing extubation failure in preterm infants.J Matern Fetal Neonatal Med,2013,26(6):603-607
[18]Abd-Allah SA, Rogers MS, Terry M,et al. Helium-oxygen therapy for pediatric acute severe asthma requiring mechanical ventilation. Pediatr Crit Care Med,2003,4(3): 353-357
[19]Wheeler AP, Bernard GR. Acute lung injury and the acute respiratory distress syndrome: a clinical review. Lancet,2007,369(9572): 1553-1564
[20]Pagel PS, Krolikowski JG, Pratt PF Jr, et al. Inhibition of glycogen synthase kinase or the apoptotic protein p53 lowers the threshold of helium cardioprotection in vivo: the role of mitochondrial permeability transition. Anesth Analg,2008,107(3):769-775
[21]Pagel PS, Krolikowski JG, Amour J, et al. Morphine reduces the threshold of helium preconditioning against myocardial infarction: the role of opioid receptors in rabbits. J Cardiothorac Vasc Anesth,2009,23(5): 619-624
[22]Heinen A, Huhn R, Smeele KM, et al. Helium-induced preconditioning in young and old rat heart: impact of mitochondrial Ca2 +-sensitive potassium channel activation.Anesthesiology,2008,109(5): 830-836
[23]Huhn R, Heinen A, Weber NC, et al. Helium-induced late preconditioning in the rat heart in vivo? Br J Anaesth,2009,102(5): 614-619
[24]Yilmaz S, Daglioglu K, Yildizdas D, et al. The effectiveness of heliox in acute respiratory distress syndrome. Ann Thorac Med,2013,8(1):46-52
[25]Nawab US, Touch SM, Irwin-Sherman T,et al. Heliox attenuates lung inflammation and structural alterations in acute lung injury. Pediatr Pulmonol,2005,40(6): 524-532
[26]Lucchinetti E, Wacker J, Maurer C,et al. Helium breathing provides modest antiinflammatory, but no endothelial protection against ischemia-reperfusion injury in humans in vivo. Anesth Analg,2009,109(1): 101-108

