检测肺癌患者血清Cathepsin X及Cystatin C的临床意义
张学德 侯彦丽 牛泽群 李维 孟夏 张娜 杨拴盈
组织蛋白酶(Cathepsins, Cats)属于溶酶体半胱氨酸蛋白酶,最初发现涉及到溶酶体内蛋白转换,近年来研究[1,2]表明,还参与肿瘤的发生、发展、转移,有希望成为新的肿瘤诊断和预后判断标记物。Cat B、Cat L等在肺癌、乳腺癌、头颈癌及结肠癌等肿瘤中表达明显增高,且高表达的患者预后更差,对预测肿瘤的复发和预后有潜在价值[3]。Cat X是最近发现的一种Cats家族成员,它的结构和功能特点明显不同于其它Cats,有一个区别于其它Cats的非常短的原区(pro-region)和一个独特的迷你环(mini-loop),Cat X不像其它Cats作为肽链内切酶发挥生物学作用,而靠水解羧基端氨基酸起作用。Cat X表达主要局限于各类免疫细胞中,如单核、巨噬细胞及树突状细胞[4]。它涉及到细胞间信号传导、细胞粘附、增生以及迁移等作用[5-7]。研究表明Cat X表达上调与幽门螺旋杆菌感染[8]、多发创伤[9]、肺结核[10]有关,也有报道发现Cat X在前列腺癌[11]、胃癌[8]、恶性黑色素瘤[12]中表达明显增高。此外,已经在多种肿瘤中发现染色体20q13中编码Cat X基因明显扩增[13,14]。
Cystatin C是半胱氨酸蛋白酶抑制剂蛋白质中的一种,在所有的有核细胞内以恒定速度持续转录与表达,无组织特异性,并存在于各种体液之中,不受年龄、性别、体重、炎症等因素影响,是一种反映肾小球滤过情况的重要指标。目前研究[15]表明,它作为Cats抑制剂与Cats互相作用参与肿瘤发生、发展。近期研究发现血液、体液中cystatin C高表达的患者预后差,有希望作为预测肿瘤预后标记物。
目前为止,我们尚未发现肺癌患者血清Cat X的研究,cystatin C在肺癌患者血清研究的报道也少见,cystatin C作为Cats强有力的抑制剂,它与Cat X血清表达水平之间可能存在相关性。目前已有cystatin C与Cat B、Cat L的相关性研究,但是尚无cystatin C与Cat X之间的研究。本研究旨在检测肺癌患者和健康人血清Cat X与cystatin C表达水平以及二者相关性和与肺癌临床病理、预后关系。
1 材料与方法
1.1 研究对象 选择2007年3月-9月西安交大二附院84例肺癌患者,其中男性50例,女性34例,年龄41岁-78岁,中位年龄61.5岁;鳞癌30例,腺癌40例,小细胞肺癌(small cell lung cancer, SCLC)14例。临床分期(TNM分期),I期+II期28例,III期+IV期56例。所有患者均经过组织学或病理学检查确诊为肺癌,采血前均未行手术、放化疗以及中成药等其它抗肿瘤治疗。另外,选取健康查体者36例作为对照组,男性20例,女性16例;年龄40岁-79岁,中位年龄60.4岁。本研究得到西安交大二附院伦理委员会许可,患者均签署知情同意书。
1.2 标本采集 所有肺癌患者和健康体检者分别抽取晨间空腹静脉血3 mL,抽取后1 h内,4oC,3,000 g离心10 min,分离的血清-80oC冻存待检。
1.3 检测方法 Cat X及cystatin C水平均采用酶联免疫吸附法测定。严格按照ELISA检测试剂盒(上海郎卡公司)的说明书操作,标准品孔各加不同浓度的标准品50 μL;然后样本孔先加待测样本10 μL,再加样本稀释液40 μL;后分别加入辣根过氧化物酶(HRP)标记的检测抗体100 μL,封板膜封孔,37oC恒温箱温育60 min。手工洗板法清洗,每孔加入底物A、B各50 μL,37oC避光孵育15 min,后每孔加入终止液50 μL,15 min内,在450 nm波长处测定各孔的OD值。实验重复3次。
1.4 随访 84例患者术后均进行了随访,总生存期OS定义为首次确诊至患者死亡时间或末次随访时间。死于非肺癌相关原因的患者排除在本研究外。随访最长时间为60个月。
1.5 统计学处理 数据采用SPSS 16.0软件进行统计分析。每组数据均采用Mean±SD表示。组间差异采取Mann-Whitney和Kruskal-Wallis检验。Pearson's相关系数评价Cat X和cystatin C之间的相关性。Kaplan-Meier法(组间生存率比较采用Log-rank检验)及Cox单因素以及多因素风险回归模型进行生存分析。双侧P<0.05为差异有统计学意义。
2 结果
2.1 肺癌患者和健康人Cat X和cystatin C表达水平比较肺癌患者及健康人血清Cat X水平分别为(2.24±0.07)ng/mL、(1.85±0.09)ng/mL;cystatin C分别为(529.77±6.15)ng/mL、(476.76±13.95)ng/mL。肺癌患者血清Cat X和cystatin C水平明显高于健康人(P<0.01)。此外,肺癌患者cystatin C/Cat X比值与健康人相比,差异无统计学意义(P=0.372)。Pearson相关分析显示,肺癌患者血清Cat X与cystatin C水平无明显相关性(r=-0.049,P=0.66)。
2.2 肺癌患者Cat X和cystatin C表达水平与临床病理特征的关系 Cat X和cystatin C/Cat X与肺癌患者性别、年龄、病理类型、淋巴结转移、细胞分化及TNM分期无明显相关,但Cat X与病理类型有相关趋势(P=0.076),cystatin C/Cat X与淋巴结转移有相关趋势(P=0.058)。cystatin C水平与肺癌分期相关,III期+IV期肺癌患者cystatin C水平明显高于I期+II期(P=0.01),与其它临床病理特征无关(表1)。
2.3 肺癌患者Cat X和cystatin C水平与预后的关系
2.3.1 Kaplan-Meier生存分析 将患者性别、淋巴结状态、分化程度、分期分组,以及根据年龄、Cat X、cystatinC、cystatin C/Cat X的中位数以二分法的方式分<中位数组以及≥中位数组,进行Kaplan-Meier生存分析,生存差异的统计学意义用Log-rank法判定。结果示低Cat X和高Cat X患者中位OS分别为22.9个月和15.8个月,差异有统计学意义(P=0.019, RR=1.678),低Cat X患者和高Cat X患者相比OS更长(图1)。I期+II期和III期+IV期肺癌患者中位OS分别为23.8个月和15.4个月,差异有统计学意义(P=0.011, RR=1.827),晚期肺癌患者预后更差(图2)。高、低cystatin C/Cat X值患者中位OS分别为23.5个月和18.5个月,差异无统计学意义,但有一定的差异趋势(P=0.069)。性别、年龄、淋巴结状态、分化程度以及cystatin C对肺癌患者OS无明显影响(表2)。

表 1 肺癌患者血清Cat X和cystatin C表达水平与临床病理特征的关系Tab 1 Relationship of Cat X and cystatin C in the sera of patients with lung cancer on the clinicopathological parameters

图 1 血清Cat X高表达组和低表达组肺癌患者Kaplan-Meier生存曲线Fig 1 Kaplan-Meier survival curves of lung cancer patients with low or high levels of Cat X in sera
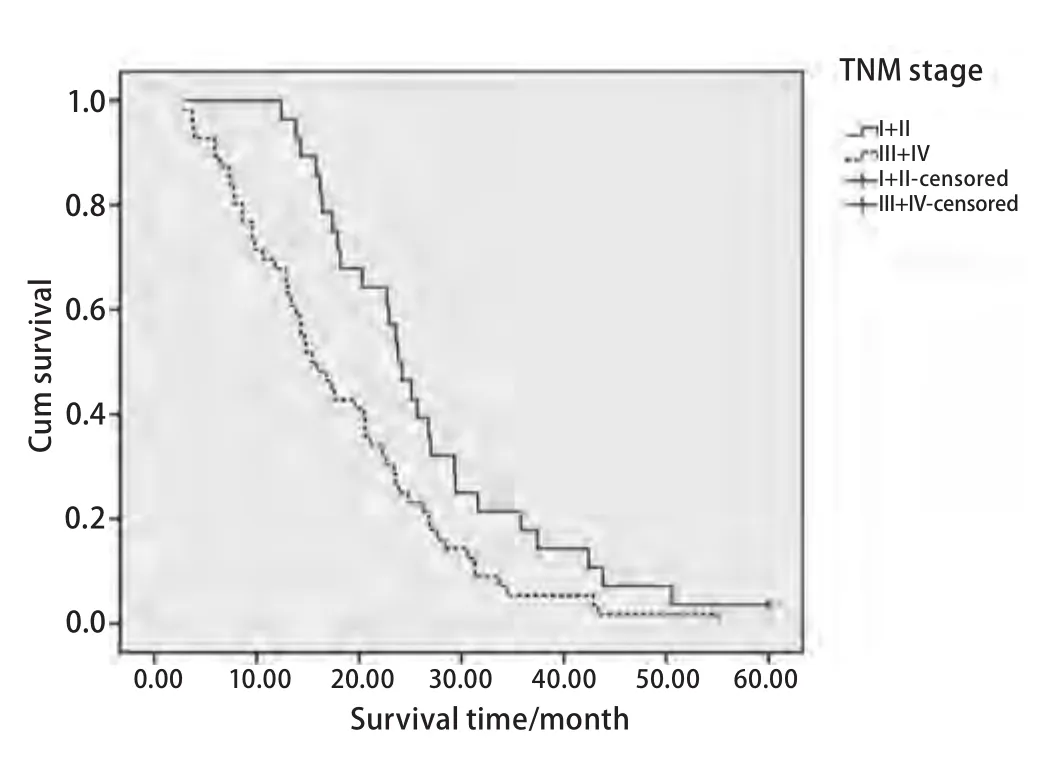
图 2 TNM I+II组和III+IV组肺癌患者生存曲线Fig 2 Kaplan-Meier survival curves of lung cancer patients with TNM stage I+II or stage III+IV
2.3.2 Cox比例风险回归模型分析 采取单因素及多因素Cox回归法分析影响肺癌患者预后的独立危险因素。利用Cox单因素回归分析发现Cat X高表达以及TNM分期是影响肺癌预后独立因素,继续将各个变量引入Cox多因素回归模型,结果显示,仅有TNM分期是患者预后的独立危险因素(表2)。

表 2 单因素和多因素分析肺癌Cat X、cystatin C及其它因素与预后的情况Tab 2 Univariate and multivariate analysis of Cat X, cystatin C, and other potential factors for prognosis in patients with lung cancer
3 讨论
肺癌是目前发病率高的恶性肿瘤之一,大部分发现时已经是中晚期,失去了手术机会,患者生存期短,5年生存率约15%[16]。因此肺癌的早诊断、早治疗至关重要。血清肿瘤标记物具有取材方便、方法易行等独特优势,在肺癌早期诊断、预后判断中有重要价值,因此人们一直在寻找有价值的血清肿瘤标记物。
Cat X是近年来发现一种新的Cats,通常以酶原形式存在于免疫细胞的溶酶体内,受到激活后,转化为有活性的酶释放到血液和细胞外基质中[17]。Cat X在恶性肿瘤患者血清和细胞外基质中也有表达,Vizin等[18]研究了Cat X在结肠癌、腺瘤、其它结肠良性病变以及健康者血清中的表达情况,虽未发现Cat X在4组中表达有差异,但Cat X水平高的结肠癌患者OS更短。Decock等[19]比较了早期乳癌和炎性乳癌中血清Cat X水平,发现炎性乳癌患者中血清Cat X中水平低,有可能为炎性乳癌的诊断提供一定的参考价值。本研究检测了肺癌患者和健康人血清Cat X水平,结果提示肺癌患者Cat X水平明显高于健康人,提示Cat X可能与肺癌发生有关,有希望作为肺癌的肿瘤标记物。
Cystatin C是Cats抑制剂,可能会减轻Cats在肿瘤侵袭、转移过程中作用[20]。Nishikawa等[21]用ELISA法检测良、恶性卵巢瘤患者和健康人的血清cystatin C,发现卵巢癌患者血清cystatin C水平明显高于良性肿瘤及健康人。Saleh等[22]也发现在结直肠癌组织中cystatin C高表达,特别是在腺癌中达到100%。然而也有研究[23]表明在肺鳞癌和正常肺组织中表达无明显差异。Wegiel等[24]则发现前列腺癌中cystatin C表达减低。我们检测了肺癌患者和健康人血清cystatin C水平,结果示肺癌患者血清cystatin C水平明显高于健康人。究其原因可能是肺癌患者中Cats升高,cystatin C为了抑制其活性也随之升高,但是仍然无法有效抑制蛋白水解酶的活性,导致肿瘤发生。
Cystatin C与Cats之间的失衡可能与肿瘤发生有关。Zore等[25]发现结肠癌患者血清Cat B的含量增加,cystatin C也随之增加,但Cat B的活性并未被相应增加的cystatin C抑制,提示随着肿瘤的进展,两者改变的同时伴随Cat B和cystatin C之间的失平衡。故有人把cystatin C与Cats的比值作为诊断肿瘤恶性程度的指标。本研究提示肺癌患者cystatin C/Cat X比值与健康人相比,无统计学差异,未见到cystatin C和Cat X失衡与肺癌相关。我们研究发现肺癌患者血清cystatin C和Cat X之间无相关性。Chen等[26]报道cystatin C与Cat B、Cat L之间无明显相关。原因可能是由于cystatin C并不是Cats唯一的抑制剂,其它抑制剂如stefin A也可能涉及到Cats的抑制。
本研究显示,Cat X与肺癌患者性别、年龄、病理类型、淋巴结转移、细胞分化及TNM分期之间无明显相关。Sevenich等[27]研究提示,在基因敲除的乳腺癌小鼠模型中,Cat X在肿瘤发展的初期表达增高,而在进展期及转移瘤中表达降低。此外Hidaka等[13]研究结果提示20q13.2扩增与结肠癌进展和转移有关。Wang等[28]研究也发现Cat X与晚期肝癌有关。而Lines等[29]报道了相反的结论,提示Cat X降低了细胞粘附,并减少胰腺癌转移。这些不同研究结果可能由于样本量偏小、检测方法以及检测标本不同或Cat X在不同肿瘤中表达不同所致。
本研究显示,cystatin C与肺癌分期有关,但是与其它临床特征之间无明显相关。Vigneswaran等[30]研究发现cystatin C与乳腺癌淋巴结转移无关,但与肿瘤大小有关。Saleh等[22]研究发现cystatin C在晚期结肠癌中表达高于早期结肠癌。本研究与上述研究一致,提示cystatin C升高可能与肿瘤浸润、转移有关。
本研究未发现cystatin C/Cat X比值与肺癌临床病理特征相关。Kolwijck等[31]报道cystatin C/Cat H和cystatin C/Cat X比值与卵巢癌病理类型相关,在低分化癌中明显升高。cystatin C与Cat X失衡与肿瘤研究甚少,还需要进一步扩大样本量或在其它肿瘤上进一步研究。
本研究表明,Cat X低水平肺癌患者同高水平患者相比有更好的OS。Vizin等[18]报道了血清Cat X高水平的结肠癌患者OS更短,与结肠癌预后有关。本研究与Vizin等[18]研究一致,提示Cat X有希望作为判断肺癌预后的指标。
我们研究提示,血清cystatin C高水平的肺癌患者OS短于低水平者(22.6个月 vs 13.7个月),但差异无统计学意义(P=0.105)。Strojan等[32]研究报道cystatin C与头颈部肿瘤预后有关,cystatin C低表达的患者无病生存期更长。Kos等[33]研究了黑色素瘤患者中cystatin C与预后关系,未发现两者之间存在相关性。
我们用单因素Cox回归分析发现Cat X水平以及TNM分期是影响肺癌预后独立因素,Cat X高水平以及晚期肺癌患者预后更差。多因素回归分析表明分期是影响肺癌患者生存的独立危险因素,晚期患者预后更差、OS更短,死亡的风险是早期的2.250倍。我们的结果进一步佐证了晚期肺癌预后更差。
总之,我们的研究初步证明在肺癌患者中血清Cat X和cystatin C水平升高,可能与肺癌的发生、发展有关。cystatin C在晚期肺癌中表达增高,可能与肺癌转移、侵袭相关。Cat X高水平的患者OS更短,单因素Cox回归分析显示Cat X是影响肺癌患者预后的独立因素。但本研究样本量还不大,需要扩大样本量进一步研究Cat X等因子与肺癌临床特征及预后的关系。

