耐UV辐射微生物高通量筛选模型的建立及初步验证
张志东,朱 静,顾美英,王 玮,石劲松,谢玉清,唐琦勇,宋素琴
(1.新疆农业科学院 微生物应用研究所,新疆 乌鲁木齐 830091;2.新疆医科大学 第一附属医院,新疆 乌鲁木齐 830091)
自1956年美国Anderson首次发现极端耐辐射微生物——耐辐射奇球菌(Deniococcus radiodurans)以来[1],世界各国已从不同地区、不同环境分离出Deniococcus属标准模式种40余个[2]。除此之外,其他属如:Rubrobacter、Acinetobacter 、Chroococcidiopsis、Hymenobacter、Kineococcus、Kocuria、Methylobacte-rium、Thermococcus等属多种微生物也具有较强的耐辐射特性[3]。研究表明,耐辐射微生物除具有极强的抗辐射特性外,其特殊的生命现象、生理机制,以及在环境工程、人类健康、生物技术乃至军事、地外空间等方面的应用前景,也成为科学界关注的热点[4-7]。
1 耐UV辐射微生物简介
虽然从γ射线与UV线(紫外线)辐射造成的微生物致死的机理来看,γ射线为一种强电磁波,当进入微生物细胞内部后,主要通过电离作用后的离子作用于如蛋白质、核酸和酶等有机分子,而使其变性或突变,进而使细胞失去活性[8];UV辐射细胞主要作用于DNA,造成DNA的突变和失活[9]。两者机理不同,但研究发现,大多数耐γ射线辐射微生物均具有不同程度的耐UV辐射特性,并且两者之间存在着一定的正相关特性[10]。耐UV辐射微生物的筛选因不需要特殊的实验设备,且操作条件要求简单,所以可以更加方便、容易地通过对耐UV辐射微生物的筛选获得耐γ射线辐射微生物。
目前,耐UV辐射微生物的筛选主要通过菌株的UV辐照时间-存活特性来确定[11-13]。这一方法存在工作量大、时间长以及耗材多等缺点,仅适合对少量特殊耐辐射微生物的鉴定和抗辐射特性的研究使用,而对大量菌株的筛选较为困难。因此,本研究利用96孔板与菌液点板法,通过对各影响因素的分析和优化,建立耐UV辐射微生物高通量筛选模型。
2 材料
(1)大肠杆菌 DH5α(E.coli DH5α)和耐辐射奇球菌(Deniococcus radiodurans)均为我所菌保室保存。
(2)培养基。LB培养基:蛋白胨10g,酵母浸粉5g,NaCl 5g,纯净水1000mL,pH 7.0。TGY培养基:蛋白胨5g,酵母浸粉3g,葡萄糖2g,纯净水1000mL,pH 7.5。
3 方法
3.1 微生物的培养
从新鲜斜面刮取辐射敏感菌大肠杆菌DH5α(E.coli DH5α)一环,划线接种至LB培养基平板上,置于37℃恒温培养12h后取出备用。从上述新鲜培养物中,调取单菌落接种至LB液体培养基中,于37℃、180r/min恒温震荡培养12h,菌液于5000r/min下离心5min后弃上清,菌体备用。
新鲜斜面刮取辐射抗性对照菌株D.radiodurans一环,划线接种至TGY培养基平板上,置于30℃恒温培养72h后取出备用。从上述新鲜培养物中,调取单菌落接种至LB液体培养基中,于30℃、180 r/min恒温震荡培养72h,菌液于5000r/min下离心5min后弃上清,菌体备用。
3.2 悬浮液及菌体浓度的选择
分别选取0.05mol/L、pH值为7.2的磷酸缓冲液、生理盐水、无菌水以及Biolog所使用的菌体悬浮液吉冷胶作为悬浮液,分别在200~400nm内进行波长-吸光度扫描。并将前面所述离心收集的菌体混匀,分别配置成不同的菌体浓度,将分光光度计样品槽调至狭缝进光后,于波长600nm下进行样品的时间-吸光度值进行扫描,并记录数据进行分析。
3.3 加样位置对辐射效果的影响
分别吸取上述制得的菌悬液67μL,加样于无菌96孔板的中心以及4个角,于超静工作台的15W紫外灯下,垂直距离30cm处进行辐照,每间隔一定时间取样2μL,并点样于LB培养平板上,置于37℃恒温培养12h后,观察菌落形态的不同[14]。
3.4 菌体培养方式对辐射效果的影响
挑取前述菌种新鲜培养物一环至无菌0.02mol/L、pH 7.2的磷酸钾缓冲液中,混匀并洗涤3次重悬后,吸取菌悬液加入无菌96孔板中,置于酶标仪于600nm下测定OD值。通过分析测定菌液的OD值,对菌悬液进行适当稀释至后备用。
分别吸取平板培养和液体培养制得的相同浓度菌悬液67μL加入于另一无菌96孔板中心,置于超静工作台的15W紫外灯下,垂直距离30cm处进行辐照,每间隔一定时间取样2μL,并点样于LB培养平板上,置于37℃恒温培养24h后,观察菌落数量的不同。
3.5 辐照效果的验证
分别以D.radiodurans和E.coli作为验证菌株,收集液体培养基中新鲜培养的各菌的菌体,以用0.05 mol/L磷酸钾缓冲液(pH 7.2)洗涤菌体3次,并调整至浓度0.5OD600。分别取10mL菌悬液置于9cm培养皿中,放置于15W紫外灯下30cm处,黑暗振荡辐照处理[13],每间隔一定时间取样2μL,并点样于LB培养平板上,置于30℃恒温培养一定时间后,观察菌落形态的不同,并对本研究建立的实验方法进行验证。
4 结果与分析
4.1 辐射模型条件的确定
4.1.1 悬浮液的确定
在本实验模型中因使用96孔板,无法进行电磁搅拌。为了使在辐射过程中菌液相对均匀,本实验对悬浮液和菌体浓度进行了分析。实验首先选取0.02 mol/L、pH 7.2的磷酸缓冲液、生理盐水、无菌水以及biolog所使用的菌体悬浮液吉冷胶作为悬浮液,分别在200~400nm下进行波长-吸光度扫描。实验结果发现Biolog所使用的菌体悬浮液吉冷胶在200~250 nm范围内有明显的吸收峰,因而不适合作为耐UV辐射菌筛选中的悬浮液(见图1)。而磷酸缓冲液、生理盐水、无菌水均无吸收,考虑实验过程中菌体自身释放的代谢物质或因紫外辐射造成菌体物质或代谢物质的释放造成pH的变化,因此本研究优先使用0.02 mol/L、pH 7.2的磷酸缓冲液[12]。
4.1.2 菌悬液浓度的确定
目前文献有关耐UV辐射菌的研究中为了使菌体在辐照时间内保证菌液均一性,往往需要使用电磁搅拌器进行搅拌[11-12]。在本实验模型中因使用的为96孔板,无法进行电磁搅拌。为了使在辐射过程中菌液相对的均匀,本实验对悬浮液和菌体浓度进行了分析。
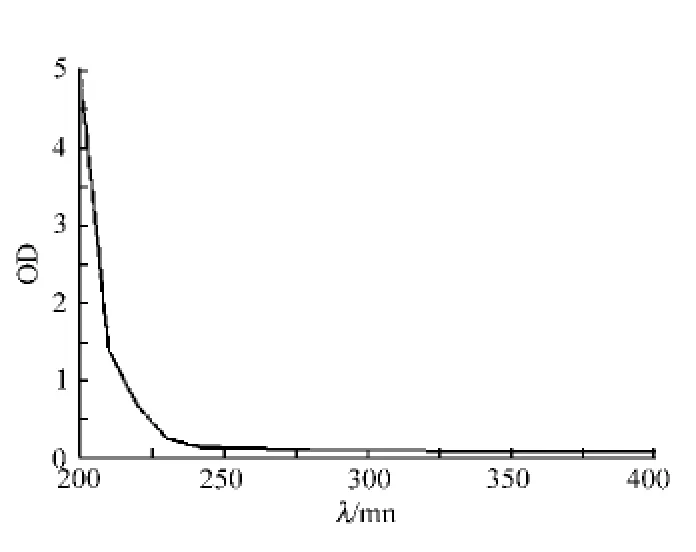
图1 10%吉冷胶的波长-吸光度扫描曲线
以D.radiodurans和E.coli为实验菌,分别使用0.05mol/L磷酸缓冲液(pH 7.2)配置成0.5OD600和1.0OD600菌悬液,将分光光度计样品槽调至狭缝进光后,于波长600nm下进行样品的OD-时间扫描,并记录数据(见图2)。由图2可以看出,在实验时间内,不同浓度的E.coli菌悬液,其上层吸光度几乎不变。对于不同浓度的D.radiodurans菌悬液来说,1.0 OD600的菌悬液在静置过程中上层吸光度会不断降低,当达到0.9OD600后下降趋势变慢;而0.5OD600菌悬液在实验过程中几乎无变化,因此,选择0.5OD600菌悬液为实验菌体浓度。
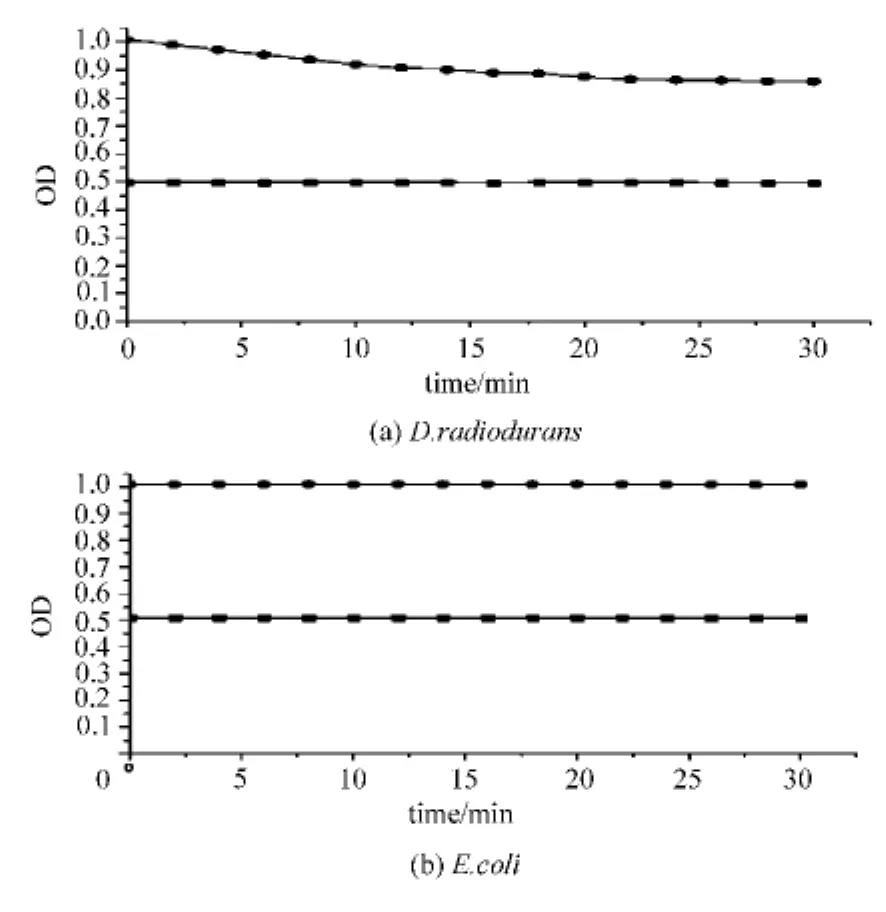
图2 不同悬浮液下菌体OD-时间的描曲线
另外,通过计算和测量常规UV辐射时10mL菌悬液置于9cm培养皿时菌液厚度,得到在96孔板条件下加67μL与菌液厚度相当,并通过游标卡尺测量数据一致,因此后续实验菌液的加样量取67μL。
4.1.3 加样位置对辐射效果的影响
UV辐射的剂量率主要与紫外灯的功率、辐射距离有关。在紫外灯功率一定下,辐射剂量与辐射距离平方成反比。考虑到当96孔板至于灯管正下方且与灯管方向平行时,96孔板中心线与边线与灯管距离的不同,可能带来辐射效果的不同。实验以辐射敏感菌E.coli为实验菌,分别对96孔板的特殊位置,即4个角A1、A12、H1、H12及中心区域点E6分别加样67 μL,于超静工作台下辐照一定时间后取样2μL,并点样于LB培养平板上,恒温培养后观察菌落数量的不同(见图3)。由图3可以看出,上述5个位置中样品分别照射60s和75s后菌量数基本一致。
分析原因为,尽管边线和中心线到灯管距离存在不同且成一定角度,经计算边线到紫外灯的距离为30.15cm,按剂量率与距离的平方计算,边线的剂量率约为中心线的99.01%,如再考虑到灯管自身的直径,剂量率相差将更小,因此在不同点上辐射结果类似,可以认为在本实验条件下,紫外灯照射在96孔板上每个孔的剂量率是相同的。

图3 不同位置对紫外辐射效果的影响
4.1.4 菌体培养方式对辐射效果的影响
在常规UV辐射时,一般选择使用液体摇瓶培养菌体到对数期后期收集菌体,通过洗涤和重悬后,进行UV辐射。上述方法对于大量筛选耗时耗力,特别是在本模型中仅需少量菌体的情况下,尤显耗材多。因此本实验以辐射敏感菌E.coli为实验菌,分别对液体培养和固体培养的菌体,菌体洗涤重悬后加入96孔板中进行辐射,并以常规方法(液体培养)进行辐射作为对照验证,结果见图4。由图可以看出三者的结果一致。因此,在本模型中可利用平板或斜面培养的菌体进行耐UV辐射菌的筛选。

图4 不同培养方式对紫外辐射效果的影响
4.2 辐照效果的验证
为了进一步验证模型的可靠性,分别以耐辐射菌D.radiodurans作为验证菌株,收集菌株在平板上新鲜培养的菌体,以0.05mol/L磷酸钾缓冲液(pH7.2)洗涤菌体3次,并调整至浓度0.5OD600,吸收67μL置于96孔板的孔中上样。然后放置于15W紫外灯下30cm处,黑暗振荡辐照处理,每间隔一定时间取样2μL,并点样于LB培养平板上,置于30℃恒温培养一定时间后,观察菌落形态的不同。同时,以传统方法,即利用液体培养收集洗涤菌体,并配制相同浓度的菌悬液,分别取10mL菌悬液置于9cm培养皿中辐射作为对照,结果见图5(图中A为传统方法,B为本模型方法)。由图5可以看出,两者结果一致,证明本模型具有可靠性。

图5 基于D.radiodurans的模型验证
4.3 耐UV菌的高通量筛选及进一步的验证
挑取从辐射污染地区及周边分离出的96株细菌,分别制得相同浓度的菌悬液,以耐辐射菌D.radiodurans耐辐射剂量为参考,以UV辐射20min为处理时间,随后取样点板,并置于恒温培养箱培养,并观察实验结果。随机挑取一株不产芽孢的耐UV辐射菌株,利用传统方法进行辐射存活率验证,结果见图6。由图6可以看出,验证菌株的确具有耐受20min的特性,因此也再一次证明模型的可行性。

图6 菌株T93的耐UV辐射曲线
4.4 筛选模型的进一步优化
在利用前述的筛选模型条件下,实验前期发现分离获得大量的芽孢杆菌。通过实验观察,除芽孢杆菌自身营养体具有一定的耐UV辐射特性外,另与平板培养时间控制不当、造成菌落大量产生芽孢有关。因为芽孢本身具有极强的抗紫外等抗逆性,造成实验筛出结果偏高。因此在后续实验操作过程,一方面可通过密切观察相关菌种的生长情况,及时镜检避免上述情况。在实际操作中,一般选择菌落形成不久即进行辐射处理。另外,为了节约时间和工序,可单独将产芽孢的菌株拿出,单独进行筛选。
由前期实验可知,在前述模型下96孔板上紫外辐射剂量率近似均匀。实验设计了一个简单装置(见图7),即在原有的96孔板外层包裹了一层铝箔纸,且铝箔纸可以按实验所需抽动。在同一菌株不同时间紫外照射时,可事先在实验所需的孔中加入菌悬液,操作时只需每隔一定时间抽出一个孔的距离,待实验结束后,可统一进行点样。其中最后一个未辐射样为零时间处理,第1个样为最长时间处理。用上述方法不仅进行一步简便了处理步骤,同时也减少了操作工序。

图7 实验模型所用装置
5 结论
耐辐射微生物作为特殊环境微生物,与其相关的研究具有极其重要的意义,业已成为微生物学研究热点之一。针对耐辐射微生物的耐γ射线辐射特性和耐UV辐射特性的相关性,及传统耐UV辐射微生物筛选费时、费力和费材的缺点,设计了一种基于96孔板的高通量筛选方法。通过不同菌的实验验证,及该模型筛选菌的耐UV特性研究表明,该模型方便可行,为高通量筛选耐UV辐射菌的筛选提供了可能。
(References)
[1]Brooks B W,Murray R.Nomenclature for“Micrococcus radiodurans”and other radiation-resistant cocci:Deinococcaceae fam.nov.and Deinococcus gen.nov.,including five species[J].International Journal of Systematic and Evolutionary Microbiology,1981,31:353-360.
[2]Sathiyaraj S,Myung K K,Lim S Y,et al.Deinococcus daejeonensis sp.nov.,isolated from sludge in a sewage disposal plant[J].International Journal of Systematic and Evolutionary Microbiology,2012,62:1265-1270.
[3]孙继华.耐辐射菌株WGR700、WGR702的分离鉴定及耐辐射特性初步研究[D].南京:广西大学,2008.
[4]Christopher E,Bagwell S B,Gary M H,et al.Survival in nuclear waste,extreme resistance,and potential applications cleaned from the genome sequence of Kineococcus radiotolerans SRS30216[J].PLoS ONE,2008,3(12):e3878.
[5]侯晓光,李新娜,张维,等.耐辐射异常球菌的微生物资源及其应用[J].中国农业科技导报,2010(4):18-23.
[6]何冰芳,欧阳平凯.极端微生物与工业生物催化剂开发[J].化工进展,2006(10):1124-1127.
[7]王建龙.耐辐射基因工程菌Deinococcus radiodurans及其在环境修复中的应用[J].辐射研究与辐射工艺学报,2004,22(5):257-260.
[8]Luckey T D.Ionizing radiation promotes protozoan reproduction[J].Radiation Research,1986,108:215-219.
[9]Zelle M R.Biological effects of ultraviolet radiation[J].Medical E-lectronics,1960,7:130-138.
[10]Arrage A A,Phelps T J,Benoit R E,et al.Bacterial sensitivity to UV light as a model for ionizing radiation resistance[J].Jour-nal of Microbiological Methods,1993,18:127-136.
[11]Zhang Y Q,Sun C H,Li W J,et al.Deinococcus yunweiensis sp.nov.,agamma-and UV-radiation-resistant bacterium from China[J].International Journal of Systematic and Evolutionary Microbiology,2007,57:370-375.
[12]Wang W,Mao J,Zhang Z D,et al.Deinococcus wulumuqiensis sp.nov.,and Deinococcus xibeiensis sp.nov.,isolated from radiation-polluted soil[J].International Journal of Systematic and Evolutionary Microbiology,2010,60:2006-2010.
[13]张志东,谢玉清,王玮,等.耐辐射黑色酵母状真菌的筛选和特性研究[J].微生物学通报,2012(5):724-731.
[14]王玮,宋素琴,张志东,等.耐辐射异球菌pprM基因克隆及功能预测[J].新疆农业科学,2012(8):1449-1455.

