以贝壳为钙源的绿色综合化学实验研究探索
杨喆云,梁 敏,张 中,黄义丽
(1.广西师范大学 化学化工学院,广西 桂林 541004;2.明尼苏达大学 科学与工程学院,美国明尼苏达州 明尼阿波利斯 55455)
在高校的化学实验教学中开设综合性、探索性实验不仅能将“四大化学”的基础理论知识与实验操作技能融会贯通,还能提升学生发现问题、分析问题、解决问题的能力,培养学生的科学素养和创新精神[1]。综合化学实验除了实验内容广泛、操作技能多样化的特点外,更应突出实用性,贯穿绿色化学理念,为学生提供自主设计实验的机会[2-4],这样才能有效激发学生的学习兴趣,充分发掘学生的创新意识。
贝壳作为贝类食品的废弃物,易于收集,其特殊的多孔构造决定了可作为营养素或药物载体、水泥添加剂、废水处理等的材料,在医药、建筑工业以及环境保护方面显示出广泛的应用前景[5-7]。另一方面贝壳含有丰富的矿物质,其中碳酸钙的含量达到90%以上,是很好的绿色钙源[8]。但是贝壳中的碳酸钙难以被人体直接吸收利用,因此探索合理的制备工艺,能将其转化成水溶性好、人体吸收率高、价格合理的活性钙试剂才能综合利用贝壳,才能够解决贝壳占用土地资源和易造成环境污染的问题[9]。本文以食用废弃物贝壳作为钙源制备乳酸钙,设计了一个绿色综合化学实验。该实验成本低廉,操作方案简便,药品毒害性小。通过该实验不但能够使学生灵活应用多种实验手段,提升综合实验操作技能,还能够培养学生的环境保护意识,贯彻绿色化学的理念,增强学生的创新意识。
1 实验材料与仪器
实验材料:贝壳(花甲、车螺食用后废弃物);盐酸、硝酸、高氯酸、氢氟酸、氢氧化钠、乳酸、无水乙醇等试剂均为分析纯(西陇化工厂)。
仪器设备:美国热电公司IRIS IntrepidⅡXSP等离子发射光谱仪;上海致金仪器设备有限公司SX-8-10马弗炉;山东鄄城科源仪器设备厂磁力加热搅拌器;上海科导超声仪器有限公司SK-2200HP超声波仪;上海精宏实验设备有限公司DHG-9076A电热恒温鼓风干燥箱;北京赛多利斯仪器有限公司TE212-L型电子天平。
2 实验方法
2.1 贝壳的清洗与烘干粉碎
收集的贝壳表面含有大量油渍等,需进行预处理。首先将贝壳用5%NaOH溶液浸泡处理1h,用清水洗净;然后置于300℃马弗炉中烘烤2h,干燥碎化。经研磨后过筛,得到200目的灰色干贝壳粉,备用。
2.2 CaO灰分的制备
取部分干贝壳粉放入马弗炉,在950℃高温下[10]煅烧2h,碳酸钙分解得到白色CaO粉末,备用。
2.3 乳酸钙的制备
(1)方法1:由干贝壳粉制备乳酸钙。反应原理:
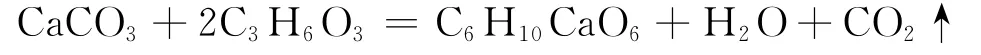
称取6.0g干贝壳粉置于250mL烧杯中,缓慢加入一定量的乳酸水溶液(V乳酸∶V水=1∶3),混合反应1min;然后向体系中加入50mL蒸馏水,将盛有反应样品的烧杯放到磁力搅拌器上在35°C下恒温反应(选择不同的反应时间和反应物配比进行对比实验);待反应完成后,升温至50℃,趁热抽滤,取滤液蒸发浓缩;冷却至室温,静置析晶;抽滤分离晶体和母液,母液再次浓缩、结晶,合并晶体;加入适量无水乙醇洗涤晶体,抽滤;将洗涤后的产品置于130℃的鼓风干燥箱中干燥至恒重,取出样品,进行分析并计算产率。
(2)方法2:由氧化钙粉末制备乳酸钙。反应原理:

称取6.0g氧化钙灰,分2份分别置于250mL锥形瓶或250mL烧杯中,缓慢加入一定量的乳酸水溶液(V乳酸∶V水=1∶3),混合反应1min;然后向体系中加入50mL蒸馏水,将盛有反应样品的锥形瓶置于超声仪中;盛有反应样品的烧杯放到磁力搅拌器上在70℃下恒温反应(选择不同反应时间进行对比实验);待反应完成后,升温至70℃,趁热抽滤,取滤液蒸发浓缩;冷却至室温,静置析晶;抽滤分离晶体和母液,母液再次浓缩、结晶,合并晶体;加入适量无水乙醇洗涤晶体,抽滤;将洗涤后的产品置于130℃的干燥箱中干燥至恒重,取出样品,进行分析并计算产率。
2.4 乳酸钙产率的计算
贝壳中碳酸钙的含量达90%,将干贝壳粉或煅烧贝壳粉得到的CaO灰分均以CaCO3计算,由此得到一定用量的干贝壳粉或CaO灰分所生成的乳酸钙的理论产量。乳酸钙的产率计算公式为

2.5 乳酸钙含量的测定
称取约0.3g试样(精确至0.0002g),溶于已加有2mL盐酸溶液的50mL蒸馏水中,搅拌下滴加约15mL乙二胺四乙酸二钠标准滴定溶液,再加入5mL氢氧化钠溶液和0.1g钙试剂羧酸钠指示剂,继续用乙二胺四乙酸二钠标准溶液滴至蓝色为终点[11]。乳酸钙(C6H10CaO6)的质量分数W 算式为
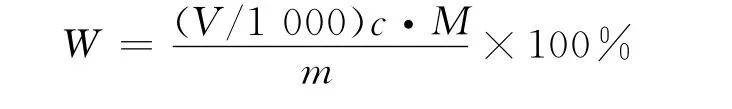
式中:V为滴定中消耗的乙二胺四乙酸二钠标准溶液体积(mL);c为乙二胺四乙酸二钠标准溶液浓度(mol/L);m为产品质量(g);M 为乳酸钙(C6H10CaO6)摩尔质量(g/mol),M=218.2g/mol。取两次平行测定结果的算术平均值为测定结果,两次平行测定结果的绝对差值不大于0.3%。
2.6 重金属含量的测定
分别称取1g由干贝壳粉(来源于花甲或车螺)制取的乳酸钙样品,用小火在可调式电热板上炭化至无烟;然后移入马弗炉以550℃灰化6~8h,冷却;用0.5mol/L硝酸将灰分溶解,用滴管将试样消化液洗入或滤入容量瓶中,并用水少量多次洗涤坩埚,洗液合并于容量瓶中并定容至刻度,混匀待测。同时进行空白试剂试验[12]。
3 结果与讨论
3.1 反应时间的选择
以干贝壳粉和乳酸为原料制备乳酸钙的反应为多相反应,反应速率较慢,因此反应时间是影响反应产率的一个主要因素。将干贝壳粉的用量设定为6.0g,乳酸的用量设定为11.0mL,反应温度35℃,分别以不同的反应时间进行对比实验,结果见表1。从表1可看出,在90min内,乳酸钙的产率随着反应时间的延长而增大;达到90min后,继续延长反应时间产率提升不明显。因此,选择90min为最佳反应时间。
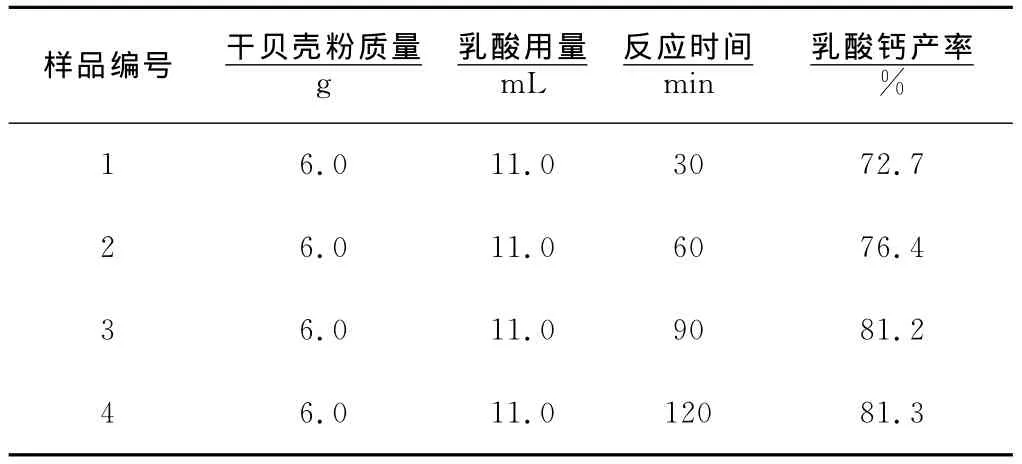
表1 反应时间对乳酸钙产率的影响
3.2 乳酸用量的选择
分别称取干贝壳粉6.0g,反应温度控制在35℃,反应时间为90min,分别加入不同用量的乳酸进行对比试验,结果见表2。从表2可看出,乳酸钙的产率随着乳酸加入量的增加而提高,不过当乳酸的用量达到12.0mL时,乳酸钙的产率已接近90%,继续加入乳酸产率的增幅明显下降。从节约成本的角度看,将乳酸的用量控制在12.0mL为宜。
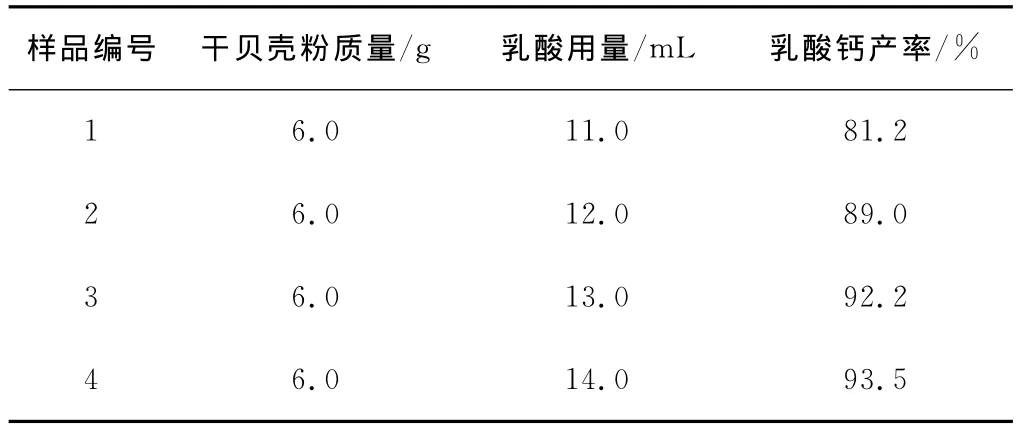
表2 乳酸用量对乳酸钙产率的影响
3.3 制备方法以及合成手段的探讨
将干贝壳粉煅烧得到氧化钙灰分,其与乳酸的反应也是制取乳酸钙的一个有效途径。分别称取CaO灰分6.0g,乳酸的用量设定为22.0mL,反应温度控制在70°C,分别以不同的反应时间进行实验,结果见表3。将该结果与表2所列的由干贝壳粉制取乳酸钙的结果进行比较分析可见,氧化钙灰分的碱性较强,与乳酸的反应速率较快,反应时间达到60min时乳酸钙的产率已基本恒定,相比第1种方法不但缩短了反应时间,而且乳酸钙的产率也较第1种方法有一定提升。不过在35℃下进行反应时乳酸钙易结晶析出,影响搅拌,因此需要将反应温度升高至70℃,以增大乳酸钙的溶解度。为避免乳酸钙产物在中和反应过程中析出,也可以采用超声合成法代替磁力搅拌法,该方法在常温下进行,反应平稳,乳酸钙产物不会迅速析出,反应时间相同时产率比磁力搅拌法略高。不过,考虑到由干贝壳粉灼烧制备CaO灰分不但耗时,还需要消耗大量的能源,比较而言由干贝壳粉制备乳酸钙这一方案不仅时效比高,而且更为绿色环保。
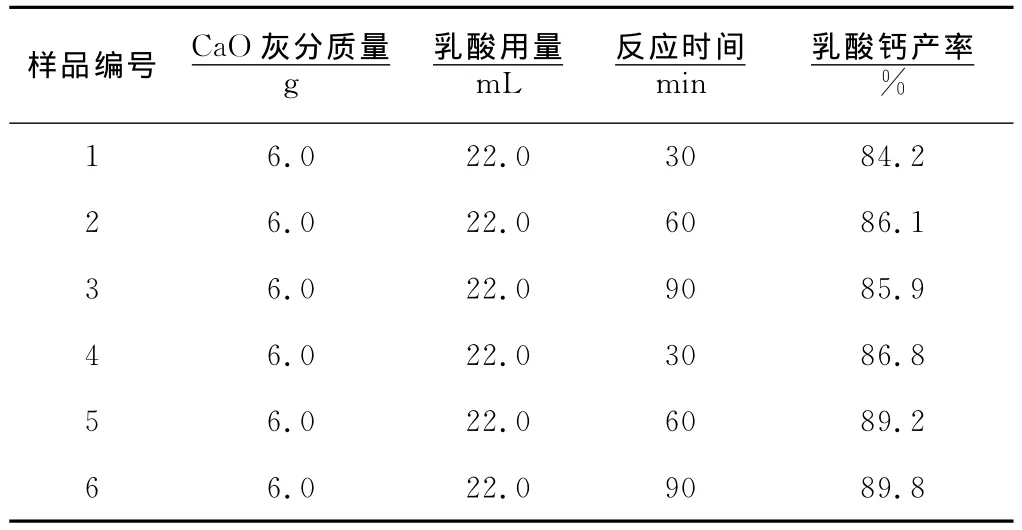
表3 不同制备方法和合成手段的比较
对上述不同实验方法制取的乳酸钙产品的纯度经滴定分析法测定结果表明,均可达到98% 以上,符合食品添加剂乳酸钙的国家质量标准[11],表明不同制备方法与合成手段对于产品纯度的影响较小。
3.4 重金属含量的测定
制取干贝壳粉的贝壳有花甲和车螺两种来源,分别选取两种来源的干贝壳粉制备得到的乳酸钙产物进行重金属元素分析,结果见表4(表4中ρ为重金属元素含量)。从表4可看出,由车螺壳制备得到的乳酸钙中Cd2+、Hg2+、Fe3+离子的含量明显高于花甲壳制取的产物,不过所有产物中重金属离子Cd2+、Hg2+、Zn2+及Fe3+的含量都很低,符合食品添加剂乳酸钙的国家标准。因此使用上述原料制取的乳酸钙产品中的重金属含量在安全范围内。

表4 乳酸钙产品中重金属含量的测定结果
4 结束语
本文对干贝壳粉与乳酸在温和条件下制取乳酸钙的实验方案进行了研究探索。将该实验作为综合化学实验的新内容,不但有助于学生了解和掌握碳酸钙、氧化钙以及乳酸钙等化合物的基本性质和应用,提高学生的综合实验操作技能,还能够培养学生绿色化学、保护环境、变废为宝以及资源的综合利用等理念。
(References)
[1]王伯康,王志林,孙尔康.开设综合化学实验的探索与实践[J].大学化学,2001,16(2):25-26.
[2]陈小燕,李冰,魏希文,等.综合化学实验的绿色化探索[J].广州化工,2012,40(4):168-169.
[3]李珺,张逢星,董绮功,等.开设化学学科本科生“综合化学实验”的做法和体会[J].高等理科教育,2003,47(1):50-58.
[4]杨毅,练必荣,程声娟.无机实验合成产物再利用开放教学的探讨[J].实验技术与管理,2010,27(6):143-146.
[5]李金志.贝壳的综合利用[J].淮海工学院学报,2001,6(10):22-23.
[6]姚梦迪,宋浩,岳强.贝壳粉强化污水除磷效果研究[J].黑龙江科技信息,2012(27):61.
[7]赖雨水.利用贝壳烧制水泥探讨[J].福建建材,1995,49(3):12-13.
[8]夏静芬,钱国英,陈亮,等.珍珠粉和贝壳粉的化学成分和结构特征分析[J].化学研究与应用,2011,22(11):1467-1471.
[9]赵桂丰,杨林,陈雷,等.微波高温加热法分解贝壳制取葡萄糖酸钙[J].大连工业大学学报,2009,28(6):438-440.
[10]刘怀乐.碳酸钙的热分解温度是多少[J].化学教育,2009,30(7):73.
[11]中国国家标准管理委员会.GB 6226-2005 食品添加剂乳酸钙[S].北京:中国标准出版社,2005.
[12]段建坤,曾爱民,杨永,等.电感耦合等离子体原子发射光谱分析食品营养强化剂中的痕量元素[J].食品科技,2011,36(11):261-264.

