苦参碱对肝癌细胞增殖及其细胞自噬的影响
范 悦 王世明 石青青
山西医科大学第一医院普通外科,山西太原 030001
在中国传统医药中,苦参碱是一种从苦参、山豆根中提取的生物碱,其分子式为C15H24N2O。而苦参碱早被广泛用于治疗病毒性肝炎、肝纤维化、心律失常等疾病[1]。国内外研究表明[2]:无论是在体内还是体外,苦参碱具有较高的抗肿瘤活性。它可以抑制肿瘤增殖、诱导分化、诱导凋亡、抗转移等作用,同时又具有免疫调节、升高白细胞、缓解癌痛等许多常规化疗药物所不具备的优势。此外,研究发现苦参碱诱导了大鼠C6胶质瘤细胞的自噬[3]。而自噬与肿瘤关系密切,同样在抑制肿瘤中起着非常重要的作用[4-5]。细胞自噬在辅助化疗药物治疗恶性肿瘤方面起着非常重要的作用。本实验通过研究不同浓度的苦参碱作用于肝癌HepG2细胞,探讨苦参碱对肝癌HepG2细胞细胞周期以及细胞自噬的影响,为临床化疗药物治疗肝癌提供理论基础。
1 资料与方法
1.1 一般资料
肝癌HepG2细胞由北京协和医学院提供。苦参碱(Matrine,广州白云山明兴制药有限公司)、DMEM 4.5 g/L Glu(Gibco公司)、PBS 液、胎牛血清(美国 Sigma公司)、单丹磺酞戊二胺(MDC)(美国Sigma公司)、二甲基亚砜(DMSO)、荧光显微镜(日本 OlympuS公司)、CO2培养箱、离心机(北京医用离心机厂)、流式细胞仪(美国BD公司,型号:FACSCalibur)、电热恒温培养箱 (河北省黄石市医疗器件厂)等。
1.2 方法
1.2.1 细胞培养及处理 将肝癌HepG2细胞培养在含10%胎牛血清的DMEM培养液的培养瓶中,在37℃、5%CO2、饱和湿度下常规培养。显微镜下观察细胞贴壁达80%时,用胰酶消化处理,取对数期细胞进行实验。
1.2.2 MTT法 肝癌HepG2细胞用0.25%胰酶处理制成单细胞悬液,以每孔约104个细胞接种于96孔板(每孔100μL)。分别加入不同浓度的苦参碱溶液,使其终浓度为0.5、1.0、2.0 mg/mL,每个浓度设三个孔。然后在加培养液100 μL,每孔总体积为200 μL,同时设定空白孔及对照孔。然后放回CO2箱中培养24、36、48 h。分别在各个时间段结束前4 h加入 MTT(5 mg/mL)溶液 10 μL,反应 4 h离心弃上清液。每孔加入DMSO 150 μL振荡荡5~10 min。用酶标仪测定波长为490 nm的吸光值。根据公式计算:肿瘤细胞增值抑制率=(1-实验组OD值/对照组OD值)×100%。
1.2.3 流式细胞术分析细胞周期 肝癌HepG2细胞以5×104/mL接种至6孔板中,细胞贴壁后,分别加入0.5 mg/mL、1.0 mg/mL、2.0 mg/mL的苦参碱,培养36 h后,收集细胞,并用流式细胞仪行细胞周期分析。
1.2.4 单磺酰戊二胺 (monodansylcadaverine,MDC)荧光染色 将DMEM液培养的肝癌HepG2细胞以1×104/mL接种至12孔板中,待细胞贴壁后,分别加入0.5、1.0、2.0 mg/mL的苦参碱,培养36 h弃培养液,用PBS液洗2遍,加入50 μmol/L MDC,37℃孵育10 min染色。 再用 PBS漂洗细胞3次,在荧光显微镜下观察。
1.3 统计学方法
2 结果
2.1 苦参碱显著抑制肝癌HepG2细胞的增殖
MTT测定结果见图1,苦参碱显著抑制肝癌HepG2细胞的增殖,并呈现时间-剂量依赖性。见表1。苦参碱0.5、1.0、2.0mg/mL作用于肝癌HepG2细胞36 h后的抑制率分别:(17.21±2.02)%、(28.25±3.20)%、(38.77±5.58)%。

表1 不同浓度苦参碱作用于肝癌HepG2细胞不同时间的抑制率(±s,%)
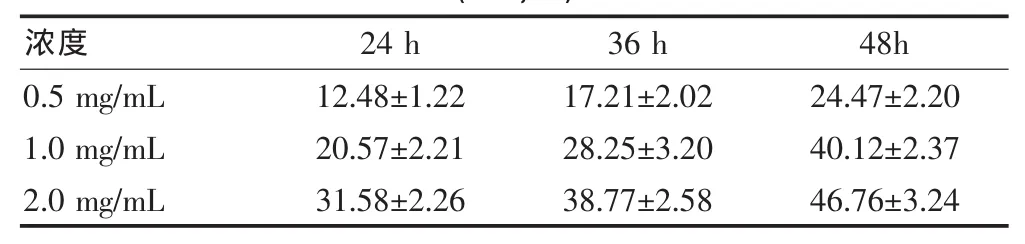
表1 不同浓度苦参碱作用于肝癌HepG2细胞不同时间的抑制率(±s,%)
注:同一浓度不同时间比较,P<0.05;同一时间不同浓度比较,P<0.05
浓度 24 h 36 h 48h 0.5 mg/mL 1.0 mg/mL 2.0 mg/mL 12.48±1.22 20.57±2.21 31.58±2.26 17.21±2.02 28.25±3.20 38.77±2.58 24.47±2.20 40.12±2.37 46.76±3.24
2.2 流式细胞仪检测结果
不同浓度苦参碱作用于肝癌HepG2细胞36 h后,流式细胞仪分析细胞周期见表2。结果所示:不同浓度苦参碱作用于肝癌HepG2细胞中36 h后,G1期细胞增多,S期细胞减少,呈现剂量依赖性。结果表明苦参碱将肝癌HepG2细胞阻滞在细胞周期的G1期。
表2 不同浓度的苦参碱作用于肝癌HepG2细胞36 h后细胞周期(±s)

表2 不同浓度的苦参碱作用于肝癌HepG2细胞36 h后细胞周期(±s)
注:同一时间不同浓度组之间,分别比较G1期和S期P<0.05,而G2/M期P>0.05
浓度 G1期 S期 G2/M期0.5 mg/mL 1.0 mg/mL 2.0 mg/mL 37.23±1.72 39.42±1.74 42.66±1.35 35.34±2.16 35.26±0.87 34.75±1.27 15.02±1.35 15.36±1.47 14.92±2.03
2.3 MDC染色显示苦参碱诱导肝癌HepG2细胞自噬的产生
为了研究苦参碱是否诱导了肝癌HepG2细胞自噬的产生,本文用荧光镜观察MDC染色的肝癌HepG2细胞,细胞显著的形态学变化如图2所示。MDC是自噬泡的特异性标记物荧光显微镜下观察细胞时,胞质内可见到清晰的点泡状结构,表明苦参碱诱导了自噬 的产生。

3 讨论
原发性肝癌是恶性程度最高的肿瘤之一。全球男性发病率位于恶性肿瘤的第5位,死亡率居恶性肿瘤的第2位;全球女性发病率位于第7位,死亡率位于第6位。全球每年新发肝癌约75万人,而我国占半数以上[6]。由于肝癌具有恶性程度高、病情发展快、预后差、死亡率高等特点,多数就诊时已属晚期。目前手术治疗依然是肝癌的首选,但是肝癌发病隐匿,确诊时能手术者仅占l0%~15%,因此必须联合其他非手术措施(如化疗、生物治疗等)进行综合治疗,才能有望提高肝癌患者的长期生存率[7]。近年来,苦参碱作为一种新型化疗药物,具有疗效显著、副作用小、毒性低等特点应用于临床。
苦参碱(Matrine)是中药苦参、山豆根、苦豆子的主要活性成分,具有保护肝细胞、抗病毒、抗过敏等多种药理作用[8]。此外苦参碱具有广泛的抗肿瘤作用。研究发现:在体外实验中苦参碱可明显地诱导人乳腺癌[9]、骨肉瘤[10]及肝癌细胞[11]等的凋亡。苦参碱的抗肿瘤的作用机制很多,主要包括诱导肿瘤细胞凋亡、诱导肿瘤细胞分化、诱导细胞自噬以及细胞毒等多种作用[3,12-13]。本实验结果表明:苦参碱对人肝癌HepG2细胞有明显的抑制作用,不同浓度的苦参碱作用不同时间后,肝癌细胞的存活率降低,这种抑制作用呈时间和剂量依赖性。流式细胞仪分析细胞周期结果:苦参碱作用于人肝癌HepG2细胞后,G1期细胞数目明显增多,S期细胞数目减少(P<0.05),这表明苦参碱作用肝癌细胞后将细胞周期阻滞在G1期,使细胞不能进入S期进行DNA合成,并最终抑制了肝癌HepG2细胞的抑制,本文实验结果与以往郭丹等[14]、夏宝妹等[15]、杨道科等[16]在肝癌、子宫内膜癌以及结肠癌细胞中的研究结果一致。同时荧光显微镜检测:苦参碱诱导肝癌HepG2细胞自噬泡的产生,这表明自噬参与了苦参碱抑制肝癌HepG2细胞的增殖,可能提示苦参碱作用于肝癌HepG2细胞后,自噬多发生在细胞周期的G1期。而自噬作为一把双刃剑,它与肿瘤之间的关系错综复杂,既可以促进肿瘤的生长,也可以诱导肿瘤的生长,在本实验研究中认为它参与了苦参碱抑制肝癌细胞的增殖。本文在既往研究的基础上,探讨了苦参碱对人肝癌HepG2增殖及其细胞自噬的影响,而其发生的信号通路及其作用机制仍需作进一步的研究。希望本实验研究能为细胞周期与肿瘤的增值、分化等之间的关系提供研究基础,为临床进一步更好的治疗肝癌提供理论基础。
[1]李正蓉.苦参素的药理与临床研究进展[J].华西药学杂志,2003,18(6):435-437.
[2]Han Y,Zhang S,Wu J,et al.Matrine induces apoptosis of human multiple myeloma cells via activation of the mitochondrial pathway[J].Leuk Lymphoma,2010,51(7):1337-1346.
[3]Zhang S,Qi J,Sun L,et al.Matrine induces programmed cell death and regulates expression of relevant genes based on PCR array analysis in C6 glioma cells[J].Mol Biol Rep,2009,36(4):791-799.
[4]Morselli E,Galluzzi L, Kepp O, et al.Anti-and pro-tumor functions of autophagy[J].Biochim Biophys Acta,2009,1793(9):1524-1532.
[5]Biederbick A,Kern HF,Elsasser HP.Monodansylcadaverine(MDC)is a specific in vivo marker for autophagic vacuoles[J].Eur J Cell Biol,1995,66(1):3-14.
[6]Jemal A,Bray F,Center M M,et al.Global cancer statistics[J].CA Cancer J Clin, 2011,61(2):69-90.
[7]Marin JJ,Romero MR, Martinez-Becerra P, et al.Overview of the molecular bases of resistance to chemotherapy in liver and gastrointestinal tumours[J].Curr Mol Med,2009,9(9):1108-1129.
[8]廖春燕,梁健,杨燕,等.苦豆子的药理及应用概述[J].中国民族民间医药,2009,18(5):6-8.
[9]周炳刚,孙靖中,苏刚,等.苦参碱诱导人乳腺癌细胞MCF27/ADR的凋亡研究[J].中华实验外科杂志, 2003, 20(6):515-516.
[10]郑安祥,陈杰,陶惠民.苦参碱抑制人骨肉瘤MG-63细胞增值和诱导凋亡的体外实验研究[J].实用肿瘤杂志,2005,20(6):516-519.
[11]张立明,郑传莉.苦参碱诱导人肝癌细胞SMMC-7721凋亡的实验研究[J].西北药学杂志,2006,22(3):128-129.
[12]查勇,寸英丽,黄云超,等.苦参碱对肝癌细胞株SMMC-7721凋亡和自噬相关基因表达的影响[J].世界华人消化杂志,2010,18(29):3078-3083.
[13]薛净,李瑜元,聂玉强,等.苦参碱对人肝癌细胞株HepG2基因表达谱的影响[J].胃肠病学和肝病学杂志,2007,16(4):341-343.
[14]郭丹,陈娜娜,周萍,等.苦参碱抑制肝癌Hep3B细胞生长及β-catenin的转录活性[J].中药材,2010,33(5):778-781,
[15]夏宝妹,周怀君,胡娅莉,等.氧化苦参碱抑制子宫内膜癌细胞株Ishikawa 的实验研究[J].现代妇产科进展,2009,18(4):278-281.
[16]杨道科,王英俊,朱洪海.氧化苦参碱诱导结肠癌细胞株SWI116凋亡的实验研究[J].中国医药导报,2008,5(27):26-27.

