不同反胶束体系萃取纤维素酶的条件优化对比研究
刘 薇,袁兴中*,曾光明,黄华军,崔凯龙,彭 馨,方振敏,郭灵芝,赵艳鸽
(1.湖南大学环境科学与工程学院,湖南 长沙 410082;2.湖南大学,环境生物与控制教育部重点实验室,湖南 长沙 410082)
纤维素是一种含量丰富的自然资源,但目前这些资源大部分通过焚烧等简单的方式利用,不仅浪费了资源还对环境造成了污染[1].通过纤维素酶降解纤维素是一种有效利用纤维素的生物技术,因此,通过反胶束萃取技术获得高效木质纤维素酶极具现实意义[2].
反胶束萃取是反胶束溶液与含有酶蛋白的水相接触后,由于反胶束溶液表面与酶蛋白表面间的相互作用,在两相界面形成了包含有酶蛋白的反胶束,此反胶束扩散进入有机相中,从而实现了酶蛋白的萃取[3].反胶束萃取技术具有成本低、溶剂可反复利用、萃取率高、条件温和不易引起酶蛋白变性等优点[4].寻找更好的新的反胶束体系是反胶束萃取酶等生物大分子技术的发展方向之一.目前国内外研究的主要是化学表面活性剂构建的反胶束体系,资源有限且合成过程中易造成环境污染.常用的化学表面活性剂有双(2-乙基己基)磺基琥珀酸钠(AOT)、十六烷基三甲基溴化铵(CTAB)、氯化三辛基甲铵(TCMAC)、磷脂酰乙醇胺(PTEA)以及磷脂酸(PTA)等.而生物表面活性剂则以其独特的结构、环境无毒、可生物降解等优点引起人们的注意[5-10].现阶段生物表面活性剂用于反胶束萃取还处于试验性阶段,但其具有巨大的经济效益和社会效益.通过对生物表面活性剂反胶束萃取酶蛋白的工艺进行改进,或开发和应用不同的产品,生物表面活性剂将很有可能成为化学表面活性剂的代替品或升级品.微生物生产的生物表面活性剂的种类很多,如鼠李糖脂(RL)、槐糖脂、海藻糖脂、纤维素二糖脂、表面活性激素等.目前,有关生物表面活性剂和化学表面活性剂构建的反胶束体系萃取纤维素酶的条件优化对比的研究甚少.
因此,本研究以有效萃取分离纤维素酶为目的,从水相pH值、离子强度、离子种类、表面活性剂的种类及浓度等方面对比分析了 3种表面活性剂(阴离子型AOT和RL、阳离子型CTAB)构建的反胶束体系的萃取条件及机理.
1 材料与方法
1.1 实验材料及仪器
表面活性剂:化学表面活性剂 CTAB(天津市科密欧化学试剂厂)、AOT(Sigma);生物表面活性剂鼠李糖脂(实验室自制).
油相:溶剂异辛烷(天津市大茂化学试剂厂),助溶剂正己醇(天津市福晨化学试剂厂).
水相:超纯水;其他试剂:纤维素酶(上海贝塔生物制品有限公司).
主要仪器:紫外分光光度计,磁力搅拌器,电热恒温水浴锅,离心机,超声波振荡器,pH计等.
1.2 反胶束体系的构建及其对纤维素酶的萃取
取一定量的表面活性剂溶解于5mL异辛烷/正己醇混合液(异辛烷/正己醇=4.5mL:0.5mL),再将0.5mg/mL粗纤维素酶水溶液和上述混合液等体积混合置于锥形瓶中,磁力搅拌 30min,达萃取平衡后,4000r/min离心 20min分相,上清液即为反胶束的前萃液,下层为萃余液[11-12].反胶束萃取示意图如图1所示.
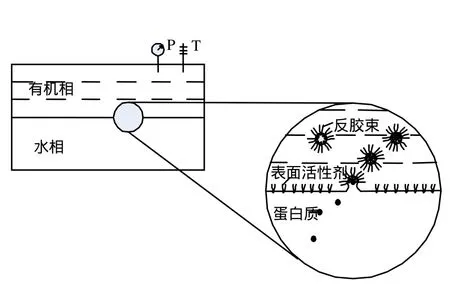
图1 反胶束萃取纤维素酶的示意Fig.1 Schematic representation of the reversed micellar extraction of cellulase
用考马斯亮蓝法[13]测定原酶液和萃余相中酶蛋白含量.萃取率(E)=(初始水相中纤维素酶蛋白含量-萃余液中纤维素酶蛋白含量)/(初始水相中纤维素酶蛋白含量).
2 结果与讨论
2.1 水相pH值对不同反胶束体系萃取的影响
在室温条件下,AOT、CTAB和RL 3种表面活性剂的浓度分别为 23.7,15,2.75mmol/L,NaCl浓度为 0.05mol/L,研究水相 pH值(pH=3.0~8.0)对不同反胶束体系萃取纤维素酶的影响,结果如图2所示.
由图 2可知,由阴离子表面活性剂 AOT和RL构建的反胶束体系的萃取率随着水相pH值的降低而升高,且均在pH值为3.0时达到最高萃取率(AOT为66.73%和RL为47.14%).而阳离子表面活性剂 CTAB构建的反胶束体系的萃取率随着水相pH值的升高而升高,在pH值为8.0时达到最高萃取率84.57%.比较各反胶束体系在实验条件下的最佳萃取率:CTAB>AOT>RL.pH值较低(pH2)或较高(pH9)时,两相界面间出现白色膜状物沉淀,萃取率急剧下降且蛋白质部分变性.
水相 pH值对萃取率的影响主要表现在对蛋白质的表面电荷及蛋白质构象的改变,pH值决定了酶蛋白带电基团的解离速率和所带的净电荷.对于阴离子表面活性剂AOT和RL形成的反胶束,萃取一般只发生在pH 图2 在不同反胶束中pH值对纤维素酶萃取率的影响Fig.2 Effect of aqueous phase pH on the exaction of cellulase in different reverse micelles 2.2 表面活性剂浓度对不同反胶束体系萃取的影响 在室温条件下,调节各反胶束体系中水相pH值为最佳值:AOT、CTAB和 RL反胶束体系中水相 pH分别为 pH=3.0、pH=8.0和 pH=3.0,水相中NaCl浓度为0.05mol/L,分别改变各反胶束中表面活性剂的浓度(表1).表面活性剂AOT、CTAB和 RL的临界胶束浓度(CMC)分别为:0.79mmol/L、1.00mmol/L,0.055mmol/L.研究各反胶束中表面活性剂浓度对纤维素酶萃取的影响,结果如图3所示. 表1 不同反胶束中表面活性剂的浓度(mmol/L)Table1 Surfactant concentration in different reverse micelles(mmol/L) 图3 在不同反胶束体系中表面活性剂浓度对纤维素酶萃取率的影响Fig.3 Effect of surfactant on the exaction of cellulase in different reverse micelles 由图 3可知,各表面活性剂都存在一个最佳浓度,AOT的最佳浓度为 30倍 CMC (=23.7mmol/L), CTAB的最佳浓度为15倍CMC (=15mmol/L),RL的最佳浓度为 50倍 CMC(=2.75mmol/L),在此浓度下,纤维素酶的萃取效果最好.各表面活性剂浓度太高或太低,都不利于各反胶束萃取纤维素酶.比较各反胶束体系在实验条件下的最佳萃取率:CTAB>AOT>RL. 表面活性剂浓度对纤维素酶萃取性能的影响主要表现在改变反胶束数量与反胶束相的聚集结构两方面. 表面活性剂浓度较低时,增加表面活性剂的浓度使反胶束聚集数和反胶束相的整体极性增加,从而引起偶极子-偶极子间的作用减弱,此时,酶蛋白增溶到反胶束的机会增多.但是,表面活性剂的浓度不能过高,否则萃取率会降低.这是由于表面活性剂的浓度增大,水含量不变的情况下,W0(有机相中水与表面活性剂的物质的量比,称为含水率)值变小,则反胶束的尺寸也随之减小,当反胶束减小到小于被萃取的酶蛋白分子的体积时,酶蛋白分子受空间阻力的作用不能进入反胶束[16].所以,当表面活性剂浓度较低时,增加表面活性剂浓度,蛋白质萃取率增大;当表面活性剂增加到一定浓度时,酶蛋白萃取率达到最大;随后,随着表面活性剂浓度的增加,酶蛋白的萃取率开始下降. 2.3 离子强度对不同反胶束体系萃取的影响 在室温条件下,在表面活性剂 AOT、CTAB和RL最佳浓度分别为23.7,15,2.75mmol/L,调节AOT、CTAB和RL反胶束体系中水相pH值分别为3、8和3,调节粗纤维素酶液中NaCl的浓度为 0.05、0.10、0.15、0.20、0.25mol/L,研究各反胶束体系中盐离子浓度对纤维素酶萃取的影响,结果如图4所示. 由图 4可知,在离子强度为 0.05mol/L时,3种表面活性剂构成的反胶束体系萃取纤维素酶的效率均达到最大值.随着离子强度的增大,反胶束的萃取率均下降.且在实验过程中发现,离子强度太小时(小于0.05mol/L时),容易产生乳化现象(图 5),难以分相.比较各反胶束体系在实验条件下的最佳萃取率:CTAB>AOT>RL. 少量的盐起盐溶作用,能够增加蛋白质的溶解度,从而提高酶蛋白的萃取率.但盐浓度太低,反胶束乳化现象严重,水相和有机相难以分相.随着盐浓度的增加,一方面,离子强度越大,反胶束内表面双电池变薄,酶蛋白与反胶束内表面之间的相互吸引力减弱,酶蛋白的溶解降低;第二个方面,反胶束内表面双电层变薄,表面活性剂极性头之间的相互作用也随之减弱,反胶团体积减小,酶蛋白不易进入;第三个方面,离子强度增大时,离子向反胶束体系中水池的迁移也增大了,影响酶蛋白的溶解,甚至引起酶蛋白从反胶束中盐析出来[17-18].当盐浓度为 0.05mol/L时,3种反胶束体系对纤维素酶的萃取率均达到最大.随着盐浓度的升高,萃取率均下降. 图4 在不同反胶束体系中盐浓度对纤维素酶萃取率的影响Fig.4 Effect of salt concentration on the exaction of cellulase in different reverse micelles 图5 离子强度过低时产生的乳化现象Fig.5 Emulsification phenomenon at low ionic strength 2.4 盐离子种类对不同反胶束体系萃取的影响 室温条件下,在 AOT、CTAB和RL的浓度分别为最佳浓度, 调节AOT、CTAB和RL反胶束体系中水相pH值分别为3、8和3,调节粗纤维素酶液中盐离子的浓度为 0.05mol/L,改变离子种类为 NaCl、NaBr、KCl、KBr,实验结果如表2所示. 对于阴离子表面活性剂,改变水相中阴离子种类(Cl-、Br-),对萃取率无明显影响,而改变阳离子种类(Na+、K+),对萃取率有强烈的影响,且在相同的离子强度下,影响程度 K+>Na+.对于阳离子表面活性剂则相反,改变阳离子种类(Na+、K+),对萃取率无明显影响,而改变阴离子种类(Cl-、Br-),对萃取率有强烈的影响,且在相同的离子强度下,影响程度 Br->Cl-.比较各反胶束体系在本实验条件下的最佳萃取率:CTAB>AOT>RL. 表2 在不同反胶束体系中盐离子种类对纤维素酶萃取率(%)的影响Table.2 Effect of salt species on the exaction of cellulase in different reverse micelles(%) 离子种类会影响表面活性剂极性头的静电屏蔽作用,从而阻碍酶蛋白与表面活性剂间的相互作用.离子半径大的静电屏蔽作用大,萃取率就小[19].所以,对于阴离子表面活性剂,K+比 Na+的影响程度大,产生的静电屏蔽作用强,萃取率较小,而阴离子种类对萃取率影响不大;对于阳离子表面活性剂,Br-比 Cl-的影响程度大,产生的静电屏蔽作用强,萃取率较小,而阳离子种类对萃取率影响不大[20]. 2.5 表面活性剂种类对纤维素酶萃取效率的影响 表面活性剂的种类会影响反胶束的大小和形状,从而影响酶蛋白的萃取:不同的表面活性剂形成的反胶束W0值(胶束的含水率,W0=[H2O]/[表面活性剂])不同.W0值较小时,反胶束的尺寸比较小,大分子酶蛋白受到空间阻力不能增溶到反胶束内腔;当W0值较大时,则不存在空间阻碍作用,酶蛋白易进入反胶束内腔,萃取率较高.Goto 等[21]发现表面活性剂的结构,特别是它的疏水部位强烈影响酶蛋白的萃取.当酶蛋白从水相转移到有机相时,在界面处与表面活性剂形成中间复合物,即界面复合物,它的疏水性(由表面活性剂结构决定)对萃取率起到关键性影响.当界面复合物有较强的疏水性时,酶蛋白易溶于有机相,萃取率高;当界面复合物有较弱疏水性时,酶蛋白难溶于有机相,沉淀于水相,或聚集在界面处,大大降低了萃取率[22-23].表面活性剂结构的微小不同,将会产生完全不同的萃取效果,反胶束萃取纤维素酶时,应选择适当的表面活性剂. 综合考虑不同表面活性剂种类对反胶束大小和形状及界面复合物疏水性的影响,比较了各反胶束体系在优化条件下的最佳萃取率为CTAB>AOT>RL. 3.1 各表面活性剂构成的反胶束体系萃取纤维素酶的最佳条件为:阴离子表面活性剂 AOT和RL构建的反胶束体系水相最佳pH值为3.0,阳离子表面活性剂 CTAB为 8.0;AOT、CTAB、RL的最佳浓度分别为 23.7,15,2.75mmol/L;盐离子浓度均为 0.05mol/L;对于阴离子表面活性剂构成的反胶束,改变水相中阴离子种类对萃取率无明显影响,阳离子种类对萃取率影响程度K+>Na+,而对于阳离子表面活性剂构成的反胶束,改变水相中阳离子种类对萃取率无明显影响,阴离子种类对萃取率影响程度Br->Cl-. 3.2 生物表面活性剂和化学表面活性剂都能实现对纤维素酶的有效萃取.不同表面活性剂构建的反胶束萃取纤维素酶的最佳萃取率为CTAB>AOT>RL. [1]Zeng X Y, Ma Y T, Ma L R. Utilization of straw in biomass energy in China [J]. Renewable and Sustainable Energy Reviews,2007,11(5):976-987. [2]Zhang Y H, Himmel M E, Mielenz J R. Outlook for cellulaseimprovement: Screening and selection strategies [J].Biotechnology Advances, 2006,24(5):452-481. [3]Göklen K E, Hatton T A. Protein extraction using reverse micelles[J]. Biotechnology Progress, 1985,1(1):69-74. [4]Leser M E, Luisi P L. Application of reverse micelles for the extraction of amino acids and proteins [J]. Swiss Chemical Society, 1990,44(9):270-280. [5]陈桂秋,曾光明,黄国和,等.鼠李糖脂的表面化学和生物合成及其在垃圾堆肥中的应用展望 [J]. 中国生物工程杂志, 2005,(B04):125-130. [6]Mulligan C N. Environmental applications for biosurfactants [J].Environmental Pollution, 2005,133(2):183-198. [7]Mukherjee S, Das P, Sen R. Towards commercial production of microbial surfactants [J]. Trends in Biotechnology, 2006, 24(11):509-515. [8]崔凯龙,袁兴中,曾光明,等.生物表面活性剂用于逆胶束体系的构建及微水相条件优化 [J]. 中国环境科学, 2011,31(9):1444-1450. [9]Peng X, Yuan X Z, Zeng G M, et al. Extraction and purification of laccase by employing anovel rhamnolipid reversed micellar system [J]. Process biochemistry, 2012,47(5):742-748. [10]郭灵芝,袁兴中,曾光明,等.木素过氧化物酶的逆胶束纯化研究[J]. 中国环境科学, 2012,32(6):1104-1109 . [11]Hebbar H U, Sumana B, Raghavarao K S M S. Use of reverse micellar systems for the extraction and puri fi cation of bromelain from pineapple wastes [J]. Bioresource Technology, 2008,99(11):4896-4902. [12]许林妹,许虎君,卢青松,等.Gemini型阳离子表面活性剂反胶束体系萃取纤维素酶的研究 [J]. 食品科学, 2006,27(02):72-75. [13]安志强,孙新顺,乔文庆.考马斯亮蓝法测定青霉素发酵液中可溶性蛋白质含量 [J]. 河北化工, 2010,33(9):60-61. [14]Kilikian B V, Bastazin M R, Minami N M, et al. Liquid-liquid extraction by reversed micelles in biotechnological processes [J].Brazilian Journal of Chemical Engineering, 2000,17(1):29–38. [15]Gaikaiwari R P, Wagh S A, Kulkarni B D. Efficient lipase purification using reverse micellar extraction [J]. Bioresource Technology, 2012,108:224-230. [16]Nandini K E, Rastogi N K. Reverse micellar extraction for downstream processing of lipase:Effect of various parameters on extraction [J]. Process Biochemistry, 2009,44(10):1172–1178. [17]Sun X H, Zhu K X, Zhou H M. Protein extraction from defatted wheat germ by reverse micelles:Optimization of the forward extraction [J]. Journal of Cereal Science, 2008,48(3):829–835. [18]Andrews B A, Pyle D L, Asenjo J A. The effects of pH and ionic strength on the partitioning of four proteins in reverse micelle systems [J]. Biotechnology and Bioengineering, 1994(43):1052-1058. [19]Kinugasa T, Kondo A, Mouri E, et al. Effects of ion species in aqueous phase on protein extraction into reversed micellar solution [J]. Separation and Purification Technology, 2003,31(3):251-259. [20]王金枝,曹学君.反胶束萃取技术分离胰激肽原酶 [J]. 中国生物工程杂志, 2007,27(3):93-99. [21]Goto M, Ono T, Nakashio F, et al. Design of new surfactants suitable for protein extraction by reversed micelles [J].Biotechnology and Bioengineering, 1997,54:26-32. [22]Zhao X Y, Wei Z Y, Du F L, et al. Effects of surfactant and salt species in reverse micellar forward extraction efficiency of isoflavones with enriched protein from soy flour [J]. Applied Biochemistry and Biotechnology, 2010,162(7):2087–2097. [23]娄文勇,宗敏华,刘森林,等.反胶束萃取酶蛋白的研究进展 [J].工业微生物, 2001,31(4):54-58.





3 结论

