中晚期卵巢癌术后化疗的临床观察
陈静平
·论著·
中晚期卵巢癌术后化疗的临床观察
陈静平
目的 分析两种给药途径(顺铂+紫杉醇静脉化疗, 顺铂+紫杉醇腹腔化疗)对中晚期卵巢癌术后的化疗效果。方法 选择2011年6月至2012年6月本院收治的确诊为卵巢癌中晚期并已行肿瘤细胞减灭术后的48例患者, 随机分为腹腔化疗组, 静脉化疗组, 各24例, 观察两组不良反应, 近期疗效, 化疗完成情况等。结果 腹腔化疗组和静脉化疗组的有效率分别为83.3%(20/24)和79.1%(19/24),差异无统计学意义(P>0.05), 毒副反应的发生率腹腔化疗组为95.8%(23/24), 静脉化疗组100%(24/24), 差异无统计学意义(P>0.05)。但重度消化道副作用腹腔化疗组33.3%(8/24), 静脉化疗组0%(0/24), 差异有统计学意义(P<0.05)。结论 腹腔灌注化疗可以减轻化疗药物消化道毒副反应的程度, 治疗有效。
卵巢癌;化学治疗;腹腔灌注;毒副反应
卵巢癌是我国女性生殖系统第三大恶性肿瘤, 我国最新的统计资料表明, 卵巢癌死亡率为3.13/10万, 仅低于乳腺癌, 居于女性生殖系统恶性肿瘤死亡率的第二位[1]。在美国, 2012年卵巢癌新增病例22, 280例, 死亡15, 500例[2], 较2010年有增加的趋势[3]。早期卵巢癌症状隐匿, 临床缺少有效的筛查诊断方法, 早期确诊的患者仅占全部病例的20%, 70%以上的患者在诊断时病变已属晚期, 5年生存率徘徊在30%以下[4,5]。目前卵巢癌的治疗方案以手术为主, 术后辅助化疗、生物治疗及放疗等综合治疗, 化疗是目前卵巢癌术后主要的治疗手段[6]。临床上化疗方案种类较多, 一线化疗是以铂类为基础的方案, 应用最为广泛的是顺铂+紫杉醇方案[7], 给药途径有静脉和腹腔灌注两种[8]。本研究通过广西医科大学第八附属医院收治的确诊为卵巢上皮性中晚期癌患者行肿瘤细胞减灭术后的48例患者进行两种不同给药途径化疗, 观察其近期疗效及毒副反应, 现总结报告如下。
1 资料与方法
1.1 一般资料 2011年6月至2012年6月收治的48例行开腹全面分期的卵巢癌肿瘤细胞减灭术并行病理学检查明确诊断的上皮性卵巢癌患者(病理类型及FIGO分期见表1), 年龄32~63岁, 平均(42.3±11.5)岁, FIGO分期Ⅱ期8例, Ⅲ期34例, Ⅳ期6例, 所有患者均随机分为静脉化疗组和腹腔化疗组, 化疗方案均选择TP(紫杉醇+铂类)。
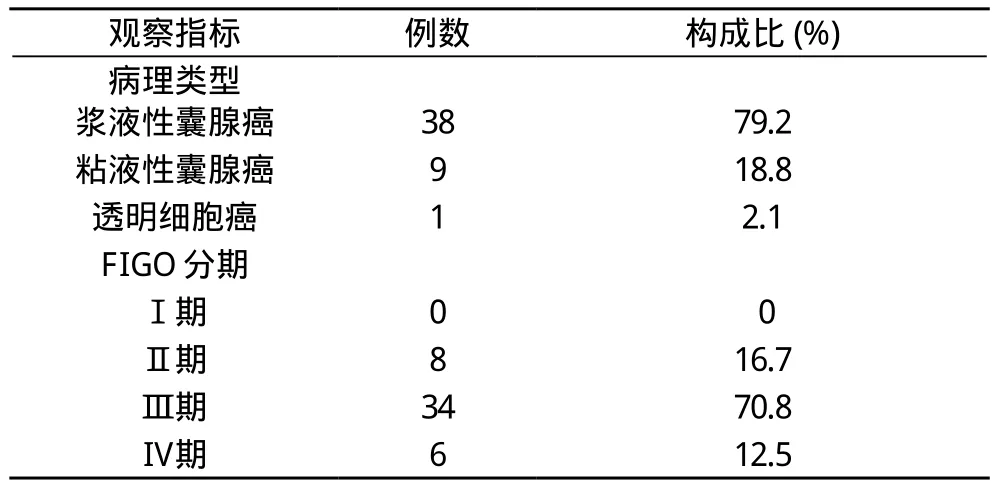
表1 卵巢癌病理组织学类型及FIGO分期
1.2 方法
1.2.1 化疗前准备 评估患者一般情况, 无化疗禁忌证者,所有患者化疗前一天即开始用药:①分两次口服地塞米松,首次10 mg, 口服(用紫杉醇化疗前一日晚上9:00 pm用);第二次10 mg , 口服(用紫杉醇化疗当日凌晨3:00 am用);②苯海拉明50 mg, 肌内注射一次(用紫杉醇化疗当日8:30am用);③西米替丁300 mg+5%GS250 ml静脉滴注(用紫杉醇化疗当日8:30 am用)
1.2.2 静脉化疗组 化疗前注射用生理盐水500 ml静脉滴注, 紫杉醇/Taxol 175 mg/m2+5%葡萄糖液500 ml静脉滴注(9:00 am开始, 3 h滴完。注:专用输液管)随后用5%葡萄糖液250 ml静滴冲管。用药期间持续心电监护及血氧饱和度监护。用紫杉醇化疗1 h以后用顺铂75 mg/m2静脉滴注,顺铂溶于5%葡萄糖液500 ml中。
1.2.3 腹腔化疗组 紫杉醇/Taxol 的使用方法同静脉化疗组;紫杉醇化疗结束后行在B超监护下进行腹腔穿刺, 穿刺部位一般取右髂前上棘至脐连线中外1/3交界处, 腹腔穿刺后先快速注入低分子右旋糖苷250 ml, 接着快速注入顺铂,最后再注入右旋糖苷250 ml, 生理盐水500 ml。
静脉化疗及腹腔化疗均选择3周疗程, 化疗前后常规监测血CA125, 阴道超声, 并监测患者化疗不良反应, 如骨髓抑制情况, 胃肠道反应, 是否引起肝肾功能受损等。
1.3 疗效评价标准及毒副作用 依据世界卫生组织(WHO)实体癌疗效评估标准和国际妇科肿瘤学会(GCIG)卵巢癌疗效判断标准[9], 完全有效:患者化疗后可测量病灶消失和(或)CA125降至正常1(≤35 U/ml)维持4周以上;部分有效(PR);可测量病灶和(或)CA125减少50%不少于4周,稳定(SD)病灶及CA125减少≤50%或无变化;进展(PD)病灶及CA125继续增长。有效率(RR)=CR+PR。化疗毒性按WHO标准分为0~Ⅳ度。
1.4 统计学方法 所有数据采用SPSS 11.5软件包进行分析。计数资料以均数±标准差( x-±s)表示, 各组疗效及不良反应发生率比较采用四格表χ2检验, 取其95%可信区间(CI), 检验水准为α=0.05, P<0.05为差异有统计学意义。
2 结果
2.1 近期疗效 两组患者均完成6个疗程TP方案的化疗。腹腔化疗组24例, CR 12例(50%), PR 8例(33%), SD 1例(4.1%), PD 1例(4.1%), RR20例(83.3%);静脉化疗组24例, CR 11例(45.8%), PR 8例(33.3%), SD 2例(8.3%), PD 1例(4.1%), RR 19例(79.1%)。两组间比较差异无统计学意义(P>0.05), 见表2。
2.2 毒副反应 腹腔化疗组及静脉化疗组患者毒副反应主要为骨髓抑制, 表现为白细胞明显下降, 对血小板及血红蛋白影响较小。注射局部静脉炎, 脱发, 消化道反应及周围神经毒性两组发生率近似(见表3), 均未出现心肝、肾功能损害、肠梗阻及发热, 过敏反应, 但静脉给药组中重度消化道反应(Ⅱ度及Ⅲ度)8例(33.3%), 腹腔化疗组2例(8.3%), 两组间比较差异有统计学意义(P<0.05), 见表4。
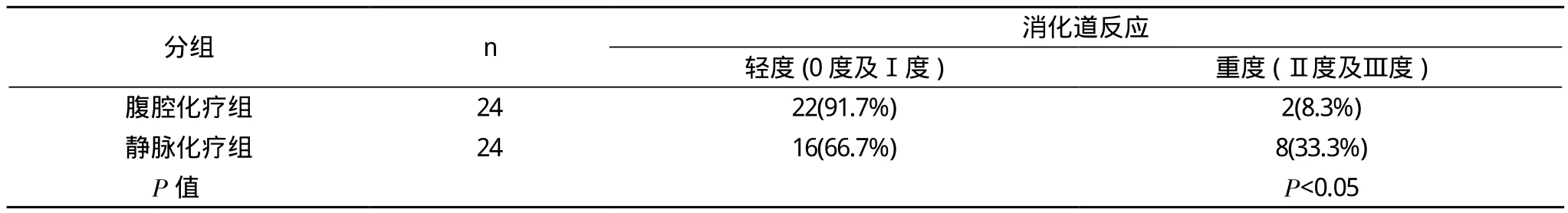
表4 腹腔化疗组及静脉化疗组消化道反应比较[n (%)]
3 讨论
卵巢癌居妇科肿瘤死亡率之首, 初始的铂类联合紫杉醇的一线化疗对75%左右的患者有效, 肿瘤盆腹腔内播散是卵巢癌最常见的复发形式, 患者一旦出现肿瘤腹腔内转移往往预后极差[10]。腹腔化疗是将按一定比例配置的化疗药物在规定的时间注入患者腹腔, 使药物直接与肿瘤细胞接触, 进而杀灭肿瘤细胞的一种针对腹腔内癌细胞转移的方法。腹腔化疗的概念至20世纪50年代开始提出, 70年代起, 腹腔化疗开始应用于卵巢癌[11]。腹腔化疗的抗癌机制是化疗药物通过扩散, 渗透作用, 腹膜吸收以及毛细血管和淋巴管到达肿瘤病灶, 并富集至一定药物浓度, 进而起到对肿瘤细胞的杀伤作用。静脉给药在体循环中由于肾清除和肝代谢清除速度快, 因此腹腔给药时腹腔内化疗药物的浓度显著高于血浆浓度, 使得腹腔游离癌细胞和术后残存的微小癌灶直接浸泡在高浓度的化疗药液中, 有利于药物直接透过肿瘤组织发育不良的脉管系统进入瘤体内, 且腹腔给药径门静脉吸收入肝脏, 使得转移至肝脏的癌细胞也受到高浓度化疗药物作用,有利于对门静脉内癌细胞和肝实质内微小转移灶的杀灭, 通过肝脏首过效应代谢仅极少量药物进入血循环, 血浆药物浓度相对较低, 这样可显著降低化疗药物的全身毒性反应, 因此腹腔灌注顺铂消化道反应明显减轻, 可作为晚期卵巢癌的术后一线化疗方案[12,13]。
由于药物渗透到正常或肿瘤组织的深度仅为1~3 mm[14]。因此腹腔化疗一般对直径<1 cm的肿瘤敏感, 对直径大的肿瘤治疗效果不佳, 腹腔化疗禁用于腹腔内有严重粘连和包裹者;肠梗阻, 腹膜炎或全腹放疗病史的患者, 为避免肠管等损伤穿刺时需B超监护下进行, 且腹腔灌注液体量一般为2000~3000 ml以保证有足够的液体来充满盆、腹腔, 有利于药物在整个盆、腹腔内弥散, 防止因粘连、刺激而导致治疗失败, 灌注液常使用生理盐水或平衡液, 另外“水化”是减少顺铂所致肾毒性的有效措施, 充分的水化可将肾毒性降低至5%。该研究腹腔化疗组成功率100%, 未发生严重化疗不良反应及并发症, 该组患者中重度消化道反应较静脉化疗组低, 相比静脉化疗有其优越性。但是, 在掌握腹腔镜化疗的适应证的同时, 仍需关注其禁忌证:腹腔严重粘连;全腹放疗史;病变已超过腹腔范围, 均不适于行腹腔化疗, 此外关于腹腔化疗毒副反应也需要关注, 如:腹痛:甚至难于坚持到全部疗程结束, 感染:腹腔操作、长期置管, 肠粘连:近期或远期肠梗阻。总之腹腔化疗作为卵巢癌综合治疗的一种治疗策略具有一定的价值[15], 在严格掌握腹腔化疗的适应症同时, 也必须关注其禁忌证及副作用, 并对其副作用有合理的预见及应对策略。
因此, 选择合适的患者进行腹腔化疗可有效减轻化疗副作用, 利于该部分患者完成化疗疗程。
[1] 赵平.中国肿瘤死亡报告—全国第三次死因回顾抽样调查.人民卫生出版社, 2010:227-233.
[2] Rebecca Siegel, Deepa Naishadham, Ahmedin Jemal.Cancer Statistics, CANCER J CLIN, 2012,62:10-29.
[3] Martinek I.E., S.Kehoe.When should surgical cytoreduction in advanced ovarian cancer take place.Journal of Oncology, 2010.
[4] A, J., S.R, W.E.Cancer Statistics.CA Cancer J Clin, 2008, 58(2): 71-96.
[5] 崔恒.卵巢癌的早期诊断.中国妇产科临床杂志, 2010, 11(6): 403-40.
[6] Suh DH, Kim JW, Kim K, et al.Major clinical research advances in gynecologic cancer in 2012.J Gynecol Oncol, 2013, 24(1):66-82.
[7] Bamias A, Bamia C, Zagouri F, et al.Improved survival trends in platinum-resistant patients with advanced ovarian, fallopian or peritoneal cancer treated with first-line paclitaxel/ platinum chemotherapy: the impact of novel agents.Oncology, 2013, 84(3):158-65.
[8] Lee SE, Bairstow SF, Werling JO, et al.Paclitaxel nanosuspensions for targeted chemotherapy- nanosuspension preparation, characterization, and use.Pharm Dev Technol, 2013 Apr 25.
[9] 曹泽毅.妇科常见肿瘤诊治指南.3版.北京:人民卫生出版社, 2010:7293.
[10] Jordan S, Steer C, Defazio A, et al.Patterns of chemotherapy treatment for women with invasive epithelial ovarian cancer - A population-based study.Gynecol Oncol, 2013, 129(2):310-7.
[11] Landrum LM, Java J, Mathews CA, et al.Prognostic factors for stage III epithelial ovarian cancer treated with intraperitoneal chemotherapy: A Gynecologic Oncology Group study.Gynecol Oncol, 2013:S0090-8258(13)00214-X.
[12] Mendivil AA, Micha JP, Brown JV, et al.Increased incidence of severe gastrointestinal events with first-line paclitaxel, carboplatin, and vorinostat chemotherapy for advanced-stage epithelial ovarian, primary peritoneal, and fallopian tube cancer.Int J Gynecol Cancer, 2013,23(3):533-9.
[13] Chang CL, Hsu YT, Wu CC, et al.Dose-dense chemotherapy improves mechanisms of antitumor immune response.Cancer Res, 2013, 73(1):119-27.
[14] NCCN clinical practice Guidelines in Oncology: Ovarian Cancer.V.2.2011, OV-3 [EB/OL] . http://www.nccn.org, 2011-10-20.
[15] Glaze S, Teitelbaum L, Chu P, et al.Dose-dense Paclitaxel with Carboplatin for advanced ovarian cancer: a feasible treatment alternative.J Obstet Gynaecol Can, 2013, 35(1):61-7.
Clinical observation of chemotherapy in advanced ovarian cancer after operation
CHEN Jing-ping.
The deparment of Obstetrics and Gynecology, The Eighth Affiliated Hospital of Guangxi Medical University, Guigang 537100, China
Objective To analyze the two routes of administration (cisplatin and paclitaxel chemotherapy with cisplatin and paclitaxel intraperitoneal chemotherapy) in patients with advanced ovarian cancer after operation.Methods 48 patients diagnosed in hospital from June 2011 to June 2012 with advanced ovarian cancer after cytoreductive were randomly divided into intraperitoneal chemotherapy group and intravenous chemotherapy group, 24 cases in each group, adverse reactions, short-term effect, chemotherapy completion were observed.Results The effective rate was 83.3% (20/24) and 79.1% (19/24) respectively in intraperitoneal chemotherapy and intravenous chemotherapy, there was no statistically significant difference (P>0.05).The incidence of the toxicity in intraperitoneal chemotherapy group and intravenous chemotherapy were 95.8% (23/24) and 100% (24/24), there was no statistically significant difference (P>0.05).However, severe gastrointestinal side effects in intraperitoneal chemotherapy group was 33.3% (8/24), while 0% in the intravenous chemotherapy group (0/24), there was statistically significant difference (P<0.05).Conclusion Intraperitoneal chemotherapy can reduce the extent of gastrointestinal toxicity of chemotherapy drugs, and such treatment is effective.
Ovarian cancer; Chemotherapy; Intraperitoneal chemotherapy; Toxic side effect
537100 贵港, 广西医科大学第八附属医院妇产科

