白花树种子处理过程中内源激素动态变化
吴 君,李因刚,罗修宝,唐永强,周 燕,柳新红*
(1.浙江省林业科学研究院,浙江 杭州 310023;2.浙江省遂昌县林业技术推广总站,浙江 遂昌 323300;3.浙江省建德市新安江林场,浙江 建德 311600)
白花树(Styrax tonkinensis)为安息香科(Styraceae)安息香属(Styrax)落叶乔木,热带、亚热带树种[1-3],是集速生材用、油用、药用和观赏等多种用途于一体的优良树种。该树种成材期短,树干挺直,材质轻软,木纤维较长,为理想的工艺用材[4]。种仁含油率56.00% ~62.80%,不饱和脂肪酸含量达90.16% ~91.45%,是发展生物柴油的优良树种[5-7]。树脂称“安息香”,是贵重药材,可制造高级香料[8]。总状花序,花白色成串、清香,盛开时繁花似雪;果实近球形,果序下垂,是极具观赏价值的园林绿化树种。白花树种子具有休眠性,刚采的种子湿沙贮藏3个月后发芽率可高达90%以上;种子带果皮(未开裂)干沙藏半年仍有相当高的发芽率,而去果皮干沙藏半年丧失发芽能力[9]。目前,对其种子休眠机理的研究未见报道。本文以江西吉水种源地种子为试材,研究不同处理过程中内源激素含量的变化,以此分析种子休眠原因,并为种子贮藏、催芽及苗木生产提供理论和实践指导。
1 材料与方法
1.1 试验材料
试验用种子于2011年10月中旬采自浙江省林业科学研究院的白花树试验林,种源地为江西吉水,林龄4 a。
1.2 试验方法
将新鲜采集的种子洗净阴干后分成2份,一份放入密封塑料袋,在4℃条件下低温干藏;另一份进行层积沙藏(用底部打有小孔的塑料箱放于室内进行),种子与湿沙的体积比为1∶3,沙子相对含水量60% ~70%,定期翻动种子并视水分状况浇水保湿。每个处理种子质量均为1 kg,2011年12月20日开始试验。于贮藏0、30、60、90 d时进行取样,每次取100粒左右,分别测定各处理在不同贮藏时间段种子胚和胚乳的ABA(脱落酸)、IAA(吲哚乙酸)、GA(赤霉素)和ZR(玉米素核苷)等内源激素的质量分数。内源激素的测定采用酶联免疫法,由中国农业大学作物化学控制研究中心完成。
2 结果与分析
2.1 白花树种子内源激素ABA含量的变化
如图1所示,随着处理时间的延长,层积沙藏和低温干藏的胚和胚乳中ABA含量都表现出先降后升的变化趋势。低温干藏处理在60 d时出现最低值,60 d后ABA含量呈上升趋势。至低温干藏处理结束,胚和胚乳ABA含量比未处理时分别上升了20.37%和23.99%。层积沙藏处理在30 d时出现最低值,30 d后ABA含量呈上升趋势。至层积沙藏处理结束,胚和胚乳ABA含量比未处理时分别下降了14.50%和 11.32%。

图1 不同处理的胚和胚乳ABA含量变化Fig.1 Changes of ABA content under different treatments in embryo and endosperm

图2 不同处理的胚和胚乳中IAA含量变化Fig.2 Changes of IAA content under different treatments in embryo and endosperm
2.2 白花树种子内源激素IAA含量的变化
如图2所示,随着时间的延长,层积沙藏和低温干藏处理的胚和胚乳IAA含量都表现出先升后降的变化趋势,且两者IAA含量都呈下降的总趋势;在处理30 d时出现峰值,30 d后快速下降。低温干藏处理的胚和胚乳IAA含量在30 d后下降的速度比层积沙藏处理的快。至试验结束,层积沙藏处理的胚和胚乳IAA含量比未处理时分别下降了38.32%和37.40%;低温干藏处理的胚和胚乳IAA含量比未处理时分别下降了59.32%和60.93%。
2.3 白花树种子内源激素GA含量的变化
随着时间的延长,层积沙藏和低温干藏处理的胚和胚乳GA含量均表现出先降后升的趋势(图3)。层积沙藏处理的胚和胚乳在60 d后GA含量由原先的下降趋势转为上升趋势;而低温干藏处理的GA含量,则在处理30 d后也开始慢慢回升。至层积沙藏处理结束,胚和胚乳GA含量比未处理时分别上升了12.64%和15.33%;而低温干藏处理结束,胚和胚乳GA含量则比未处理时分别下降了6.52%和12.61%。

图3 不同处理的胚和胚乳中GA含量变化Fig.3 Changes of GA content under different treatments in embryo and endosperm

图4 不同处理的胚和胚乳中ZR含量变化Fig.4 Changes of ZR content under different treatments in embryo and endosperm
2.4 白花树种子内源激素ZR含量的变化
2种不同处理ZR含量的变化如图4所示。层积沙藏和低温干藏处理胚和胚乳ZR含量表现出先升后降的变化,且总体趋势两者一致。层积沙藏和低温干藏处理的ZR含量在30 d时达到最大值,然后含量逐渐降低,至60 d后含量基本保持不变。至层积沙藏处理结束,胚和胚乳ZR含量比未处理时分别下降了10.69%和13.30%;低温干藏处理结束,胚和胚乳ZR含量比未处理时分别下降了34.20%和36.91%。
2.5 IAA/ABA含量的变化
如图5所示,2种处理的白花树种子胚和胚乳IAA/ABA值都呈先上升后下降的趋势,且均在贮藏30 d时达到最大,30 d后,层积沙藏处理IAA/ABA值快速降低,至处理结束,胚和胚乳的IAA/ABA值比未处理分别下降了22.54%和17.74%;低温干藏处理IAA/ABA值平缓下降,至处理结束,胚和胚乳的IAA/ABA值比未处理时分别下降了64.90%和35.99%。
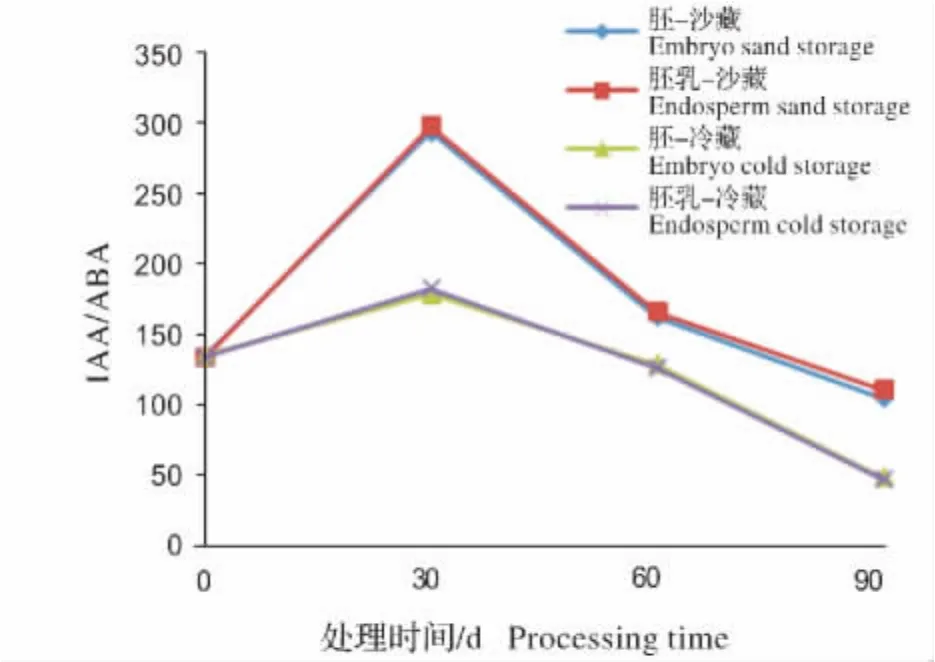
图5 不同处理的胚和胚乳中IAA/ABA含量变化Fig.5 Changes of IAA/ABA content under different treatments in embryo and endosperm

图6 不同处理的胚和胚乳中GA/ABA含量变化Fig.6 Changes of GA/ABA content under different treatments in embryo and endosperm
2.6 GA/ABA含量的变化
从图6中看出,随着处理时间的延长,2种不同处理的白花树种子胚和胚乳GA/ABA值变化有所不同。层积沙藏处理的胚和胚乳GA/ABA值在30 d时达到最大,而在30~60 d期间快速降低,60 d后又开始回升,总体呈上升趋势,90 d GA/ABA值比未处理分别增加了41.44%和51.74%。而低温干藏处理的GA/ABA值波动较为平缓,总体呈下降趋势。至试验结束,胚和胚乳GA/ABA值比未处理时分别下降了18.35%和21.49%。
2.7 ZR/ABA含量的变化
从图7中看出,随着处理时间的延长,2种不同处理的白花树种子胚和胚乳ZR/ABA值变化有所不同。层积沙藏处理的胚和胚乳ZR/ABA值出现较大的波动,在30 d时达到最大,胚和胚乳ZR/ABA值比未处理时分别增加了217.92%和230.16%,30 d后呈下降趋势。至试验结束,胚和胚乳ZR/ABA值比未处理时分别增加了7.44%和12.70%。低温干藏处理的胚和胚乳ZR/ABA值呈先上升后下降的趋势,但是变化幅度不大。至试验结束,胚和胚乳ZR/ABA值比未处理时分别下降了43.24%和 41.87%。

图7 不同处理的胚和胚乳中ZR/ABA含量变化Fig.7 Changes of ZR/ABA content under different treatments in embryo and endosperm
3 结论与讨论
3.1 ABA、GA、IAA、ZR 含量变化
ABA广泛存在于休眠种子中,使种子不能进行正常的代谢活动[10]。相关研究认为[11-12],层积沙藏处理可以打破由ABA造成的休眠。美国桂花(Osmanthus americanus)[13]种子属深休眠类型,种子中ABA含量约为180 ng/g。实验结果表明,白花树种子未处理前胚和胚乳的 ABA含量分别为282.94 ng/g和286.26 ng/g,ABA含量比美国桂花高57.2%和59.03%。至处理结束,层积沙藏处理的胚和胚乳ABA含量比未处理的分别下降了14.50%和11.32%。这说明该处理可以有效地降低种子ABA含量,可能是ABA的合成随着胚后熟完成而受阻,使ABA浓度降低。这种现象也发生在东北红豆杉(Taxus cuspidata)[14]、朝鲜冷杉(Abies koreana)[15]种子处理过程中。这进一步说明,ABA 含量与白花树种子休眠特性有较大的关联性。
种子休眠的解除总是与赤霉素类物质的积累相伴发生的。青钱柳(Cyclocarya paliurus)[11]、银杏(Ginkgo biloba)[16]、三尖杉(Cephalotaxus fortunei)[17]等物种在低温层积结束后,GA 含量都有明显的上升趋势。试验表明,至处理结束,层积沙藏处理的胚和胚乳GA含量比未处理时分别上升了12.64%和15.33%;低温干藏处理的胚和胚乳GA含量则变化不大。总体来看,层积沙藏处理更能激活种子内有关酶的活性,在整个处理过程中有助于解除休眠。高红兵等[14]在东北红豆杉层积过程中,认为少量IAA的增加是由于胚的生长造成的,IAA与其休眠和萌发关系不大。2种处理的白花树种子胚和胚乳中IAA含量随着层积时间的延长,总体上呈现先升后降趋势。可能是IAA在其种子休眠前期与其他激素相互作用,促进休眠解除。ZR具有抵消发芽抑制物质的作用,调控种子发育中的物质和能量代谢[18]。ZR含量在银杏[16]种子层积处理前期(胚分化和快速生长期)上升到较高水平,而后含量又下降。试验显示,2个处理白花树种子胚和胚乳在层积过程中,ZR含量均出现先升后降的趋势,在层积处理的30 d时出现峰值。说明在处理初期,ZR含量的上升有助于解除休眠,但并不是解除种子休眠的必需因子。
3.2 各激素含量之间比值的变化
Khan[19-20]论证了激素平衡学说,指出种子休眠和萌发还与各类激素之间的平衡有关。种子产生休眠不单是由于抑制物的存在,也可能是缺乏生长激素所导致的。GA虽然是主要的调节因素,但生长激素存在的必要性是以抑制物存在为前提的。吉九平[21]、陶俊[22]等对桃(Amygdalus persica)种子的研究认为,ABA和GA的平衡对种子的休眠和萌发起主导作用;如山楂(Crataegus pinnatifida)[23]种子中ABA含量降低,GA、IAA、ZR含量增加,以及比值增大,休眠解除。随着层积时间的增加,沙藏处理的白花树种子胚和胚乳GA/ABA的比值总体上呈现上升的趋势;而在处理过程前期,IAA/ABA、ZR/ABA的比值同样呈现出明显增加的趋势。实验结果进一步证实了GA是种子萌发的主要促进物质。同时,IAA、ZR的存在对打破种子休眠过程也有一定的影响。
[1]中国树木志编委会.中国树木志(第2册)[M].北京:中国林业出版社,1994:1602-1603.
[2]Kashio M,Johnson D V.Monograph on Benzo[M].Bangkok:RAP Publication,2001.
[3]黄椰林.不同地理与生态分布植物类群的系统发育[D].广州:中山大学,2004:55-57.
[4]骆昱春,杨桦,曾志光,等.东京野茉莉木材性质分析与利用[J].江西农业大学学报,2007,29(1):77-80.
[5]顾雁蕾.越南安息香种子成分分析及超声波提油研究[D].杭州:浙江大学,2011.
[6]欧乞碱,李代芳,喻长惠,等.中国植物油脂的研究Ⅰ[J].云南植物研究,1980,2(3):275-295.
[7]刘光斌,黄长干,刘苑秋,等.东京野茉莉油的提取及其制备生物柴油的初步研究[J].江西农业大学报,2007,29(4):685-689.
[8]国家药典委员会.中华人民共和国药典:2010年版(一部)[M].北京:中国医药科技出版社,2010,138-139.
[9]周庆年,巫金华,张珍秀.二十种热带亚热带药用植物种子的寿命及贮藏[J].中药材科技,1983(4):1-4.
[10]郑光华.种子生理研究[M].北京:科学出版社,2004:307.
[11]杨万霞,方升佐.青钱柳种子综合处理过程中内源激素的动态变化[J].南京林业大学学报:自然科学版,2008,32(5):85-88.
[12]张培玉,杨晓玲,项殿芳,等.山楂种子休眠、萌发与内源激素含量的变化[J].河北农业技术师范学院学报,1993,3(3):7-10.
[13]黄丹,许岳香,胡海波.美国桂花种子低温层积过程中内源激素的动态变化[J].林业科技开发,2010,24(1):53-56.
[14]高红兵,吴榜华,孙振良.东北红豆杉种子层积过程中内源生长素和脱落酸含量的变化[J].吉林林学院学报,1998,14(4):187-189.
[15]孙敬爽,贾桂霞.朝鲜冷杉种子层积过程中萌发特性和内源激素 ABA、IAA含量的变化[J].林业科学研究,2006,19(1):117-120.
[16]曹帮华,蔡春菊.银杏种子后熟生理与内源激素变化的研究[J].林业科学,2006,42(2):32-37.
[17]焦月玲,周志春,金国庆,等.低温引发处理过程中三尖杉种子生理变化及产地差异[J].浙江林学院学报,2007,24(2):173-178.
[18]王三根.细胞分裂素与植物种子发育和萌发[J].种子,1999,105(4):35 -37.
[19]Khan A A.种子休眠和萌发的生理生化[M].王沙生等,译.北京:农业出版社,1989.
[20]Khan A A.Primary preventive and permissive role of hormones in plant systems[J].Bot Rev,1975,41:391 -420.
[21]吉九平,王业遴.桃种子层积中激素的变化与破眠的关系[J].南京农业大学学报,1987,31(1):25-29.
[22]陶俊,陈去志.桃种子休眠与萌发研究:种皮的调控作用[J].果树科学,1996,13(4):233-236.
[23]李秉真,乌云,田瑞华,等.山楂种子休眠好后熟期间内源激素的变化[J].植物生理学通讯,1998,34(4):254-256.

