油桐β-酮脂酰-ACP还原酶(KAR)基因的克隆与序列分析
刘美兰,谭晓风,龙洪旭,张 琳,周俊琴,王建勇
(中南林业科技大学 经济林培育与保护教育部重点实验室,湖南 长沙 410004)
油桐(Vernicia fordii)是我国南方重要的木本油料经济树种[1]。油桐的种子含油率高(50% ~70%),它具有优异的防水、绝缘、防腐蚀性能,是重要的工业油料,还可做燃料及生物柴油[2,3]。目前,国内外对油桐的研究主要集中在栽培选优及丰产林改造方面,分子水平的研究报道较少,龙洪旭等[4-5]对个别基因进行了克隆,谭晓风等[6]构建了油桐种子EST文库构建。本文中以葡萄桐近成熟种子为材料,在转录组数据库的基础上,开展对油桐优质基因资源的分离克隆研究,为油脂合成进行遗传改良提供资源和技术基础。
β-酮脂酰-ACP还原酶(KAR)又名β-氧脂酰-ACP还原酶,,催化乙酰乙酰-ACP还原成β-羟脂酰-ACP,该酶的天然底物是乙酰乙酰-ACP,但同时也能利用酰基CoA和酰基半胱胺。在Ⅱ型脂肪酸合成途径中,KAR是唯一催化酮脂酰还原反应的酶[7-8]。根据与NADH不同的作用方式,植物β-酮脂酰-ACP还原酶分2种等位形式:一种是依赖NADPH的酶,已从油菜、大麦叶、菠菜叶,红花种子、眼虫和鳄梨中果皮中克隆出来,其中从油菜、鳄梨中分离的还原酶是NADHP特异的,它的N-端有细胞色素f结构域,内部还有1个类似NodG基因的产物,其编码基因已从拟南芥、油菜中克隆,它的N-端编码区编码1个可将多肽定位于质体基质的转运肽[9-10]。另一种是与NADH相联结的酶,催化β-酮脂酰-ACP还原,已从鳄梨中果皮的质体和眼虫纯化,至于在脂肪酸合成中的作用尚不清楚。Klein等[11]的杂交研究表明,在披针叶萼距花(CwpAea lanceolata)中β-酮脂酰-ACP还原酶由一个至少有两个基因的小基因家族编码,并且这个家庭的成员在根、叶、花和种子中都表达。两种等位形式的β-酮脂酰-ACP还原酶共同控制脂肪酸合成的第一个还原反应,对脂肪酸合成有极其重要的作用。因此,油桐KAR基因的克隆与生物学信息分析将为进一步调控油桐脂肪酸生物合成提供物质基础,并为油桐KAR基因的利用提供参考资料。
1 材料与方法
1.1 实验材料
1.1.1 植物材料 2012年8月底在湖南省永顺县青坪镇中南林业科技大学油桐试验基地,即国家油桐种质资源保存库采集葡萄桐近成熟种子为实验材料,保存于-80℃冰箱中备用。
1.1.2 实验试剂 实验所有试剂名称和来源如下表1。

表1 实验试剂名称和来源Tab.1 Experimental reagents name and origin
1.2 实验方法
1.2.1 总RNA的提取和cDNA的合成 采用Invitrogen公司的PureLinkTMRNA Mini Kit试剂盒、CTAB裂解和氯仿/异戊醇抽提的综合方法提取油桐种子内的总RNA。使用10 g/L的琼脂糖凝胶电泳检测RNA的提取效果。反转录反应根据TaKaRa公司cDNA合成试剂盒说明书完成,从而得到第一条链cDNA,以此为模板进行PCR扩增。
1.2.2 油桐KAR基因的克隆 从油桐种子转录组测序结果中获得KAR1和KAR2的全长序列,它们的开放阅读框长分别为993 bp和900 bp。依据2条Unigene序列利用Primer Premier 5软件设计引物(表2),以葡萄桐近成熟种子反转录的单链cDNA为模板,进行PCR扩增。反应体系及引物序列如表3。回收PCR产物并连入pEASY-Blunt Simple载体连接,转化大肠杆菌Trans-T1感受态细胞,在含有氨苄青霉素的LB培养基上进行阳性筛选,选择阳性克隆送北京六合华大基因公司测序。将获得的基因序列分别命名为Vf_KAR1和Vf_KAR2。

表2 油桐KAR全长引物序列Tab.2 Primer sequence of Vernicia fordii KAR
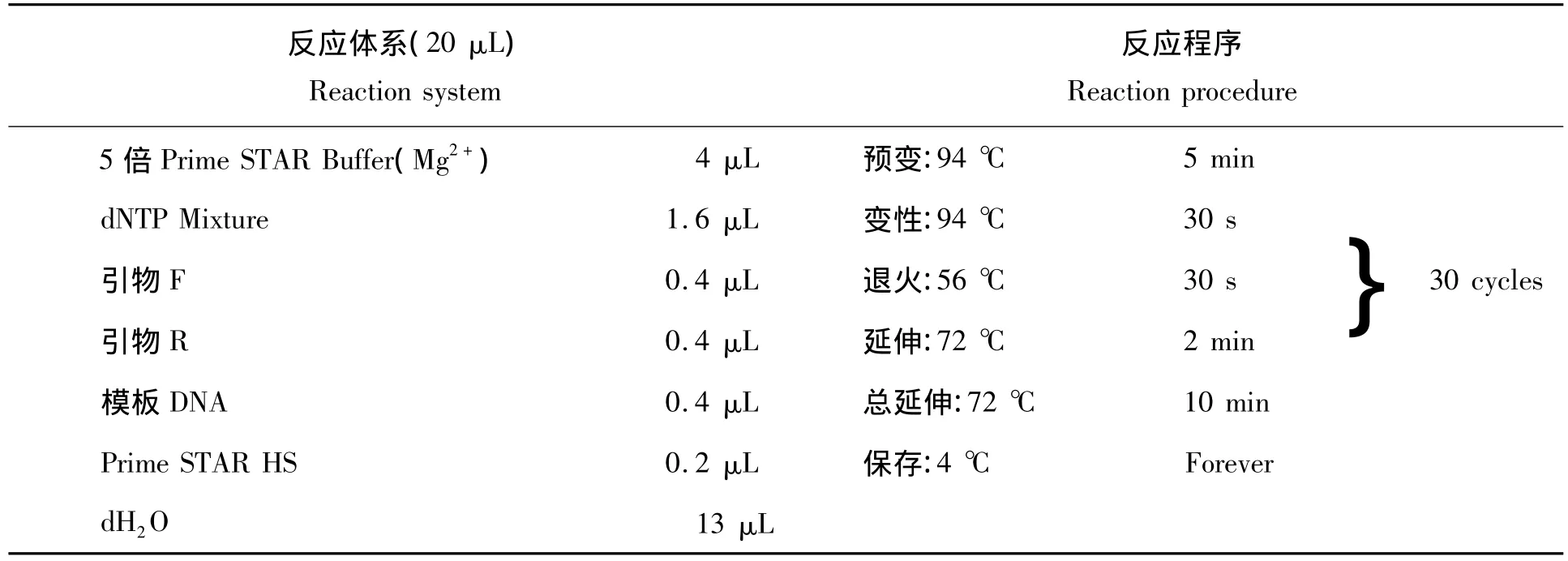
表3 油桐KAR全长扩增PCR反应体系和反程序列Tab.3 PCR amplification reaction and response procedures of Vernicia fordii KAR
1.2.3 生物信息学分析 通过 NCBI进行在线BLASTX分析,对克隆基因进行功能确定;用在线多工具Clustalw2、Vector NTI 10.3.0和GENDOC软件进行同源性分析,并用软件MEGA5.1构建Neighborjoining系统进化树;利用在线软件ProtParam、SignalP4.1和TargetP 1.1 Server对编码蛋白分别进行了理化性质分析、信号肽和导肽性分析;采用在线ProtScale、TMpred Server和Mobyle portal分别进行编码蛋白的疏水性、跨膜结构和跨膜区拓扑结构预测;同时,利用在线工具SOPMA和EsyPred3Dwebserver1.0分别进行二维结构和三维结构的预测,并利用本地软件UCSF Chimera对三维结构进行分析。
2 结果与分析
2.1 油桐Vf_KAR1和Vf_KAR2基因的克隆与序列分析
根据测序结果比对分析,Vf_KAR1(Unigene1369_All)全长为1 449 bp(图1-A),其中5'UTR长为128 bp,3'UTR长为328 bp,CDS长为993 bp,推测其编码331个氨基酸;Vf_KAR2(Unigene9987_All)全长为1 086 bp(图1-B),其中5'UTR长为17 bp,3'UTR长为3 bp,CDS长为900 bp,推测其编码300个氨基酸。将Vf_KAR1和Vf_KAR2进行BLASTX分析后共搜索到100多条相似度很高的KAR同源序列,因此可以判断Vf_KAR1和Vf_KAR2的CDS均为β-酮脂酰-ACP还原酶(KAR)基因。

图1 油桐KAR扩增结果Fig.1 Amplification results of Vernicia fordii KAR
利用在线工具Clustalw2将推导出的Vf_KAR1和Vf_KAR2氨基酸序列与其他物种的KAR氨基酸进行多重序列比对分析,结果显示这些基因所编码的氨基酸序列具有较高的相似性,各物种之间的同源性在62% ~82%,油桐Vf_KAR1和Vf_KAR2相似性仅有74%,Vf_KAR1与蓖麻的相似度最高,达82%;Vf_KAR2基因与花生、辣椒的相似度高达76%。通过GENDOC软件序列比对和在线Predictprotein序列分析结果还显示,各物种所编码的氨基酸都存在高度保守的“Ser-tyr-Lys”三联体催化中心(图2罗马数字Ⅲ),这是短链脱氢还原酶家族的主要特征之一。同时,在氨基酸序列中存较多的酰基化位点,此外还有糖基化位点、蛋白激酶C和酪蛋白激酶介导的磷酸化位点(图2)。用软件MEGA5.1构建进化树,发现Vf_KAR1与蓖麻处于同一进化枝上,进化关系最为接近,Vf_KAR2找不到与其同一进化枝的植物(图3)。

图2 不同物种KAR氨基酸序列比对结果Fig.2 Amino acid sequences alignment of KAR from different species
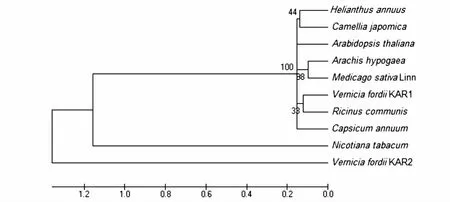
图3 不同物种KAR种系进化分析Fig.3 Phylogenetic analysis of KARs from different species
2.2 油桐Vf_KAR1和Vf_KAR2基因编码蛋白的理化性质分析
利用在线ProtParam对Vf_KAR1和Vf_KAR2基因编码的蛋白质进行了理化性质分析,结果表明:Vf_KAR1和Vf_KAR2所形成的蛋白分子量分别为35 kD和32 kD;等电点为9.28和9.11;理论推导半衰期都为30 h;编码蛋白的原子组成分别为C1536H2506N432O466S13和C1410H2289N393O421S13;不稳定系数是33.52和32.12,由此说明这两个蛋白是稳定性蛋白;脂肪系数为93.72和95.93,总平均亲水性分别为0.095和0.108,说明这两个蛋白的疏水性较弱。
2.3 信号肽和导肽的预测和分析
信号肽(signal peptide)常位于蛋白N端,由可被剪切的15~30个氨基酸的前导序列组成。当被转运的蛋白质肽链的合成在mRNA起始密码上启动后,首先合成带有信号肽的蛋白,信号肽被内质网膜上的受体蛋白所识别并相互结合,此时受体蛋白可聚合而产生膜内通道,信号肽引导蛋白经过通道进入内质网,随后信号肽被膜内侧的信号肽酶水解,蛋白质随之变为成熟蛋白质。导肽又称转运肽(transit peptide)或导向序列(targeting sequence),它是游离核糖体上合成的新生蛋白N端长约20~80个氨基酸残基的肽链,通常为带正电荷的碱性氨基酸,精氨酸和赖氨酸含量较为丰富,具有引导附着序列进入线粒体或叶绿体靶位点的功能,因此导肽的预测和分析对研究蛋白质的定位具有重要作用[12]。利用SignalP4.1对油桐Vf_KAR1和Vf_KAR2基因的氨基酸序列进行在线信号肽预测,综合各项指标表明两条序列都不含信号肽。使用在线TargetP 1.1 Server分析油桐Vf_KAR1和Vf_KAR2基因的氨基酸序列导肽性,结果分析表明两条序列都含有叶绿体转运肽的RC值分别为1和5。RC是可靠性等级,是一个衡量最高和第二得分最高输出之间的差异,较低的RC价值的预测更安全,因此,可推测油桐Vf_KAR1和Vf_KAR2都含有叶绿体转运肽。预测结果与报道的其他物种KAR基因((如油菜Brassicanopus)结构一致[12]。
2.4 油桐Vf_KAR1和Vf_KAR2基因编码蛋白的疏水性/亲水性的预测和分析
氨基酸序列决定蛋白质的功能,组成蛋白质的20种氨基酸各具特殊的侧链,当它们按照不同的序列关系组合时,就可形成多种多样的空间结构,使其具有不同生物学活性。疏水性是20种氨基酸都固有的特性,是影响蛋白质构象的重要因素,因此蛋白质疏水性/亲水性的预测和分析,对预测蛋白质生物学功能具有重要意义[13]。利用在线ProtScale分析预测Vf_KAR1和Vf_KAR2编码蛋白的疏水性,参照其数字文本格式分析发现Vf_KAR1和Vf_KAR2分别有161个和150个疏水性氨基酸残基,分别占各自总残基数的49.8%和51.4%,编码的氨基酸序列中亲水性氨基酸、疏水性都均匀分布在各个肽链中,综合Vf_KAR1和Vf_KAR2的脂肪系数与总平均亲水性来分析,可推测Vf_KAR1和Vf_KAR2基因编码的蛋白是疏水性蛋白,且Vf_KAR2比Vf_KAR1的疏水性较强。
2.5 Vf_KAR1和Vf_KAR2基因编码蛋白的跨膜结构与拓扑结构预测
利用在线TMpred Server和Mobyle portal对Vf_KAR1和Vf_KAR2进行跨膜结构和跨膜区拓扑结构预测结果(图4,图5)显示:Vf_KAR1仅有1个跨膜域和1个疑似跨膜域,Vf_KAR仅有2个疑似跨膜域。每个跨膜结构域由20个氨基酸残基组成的螺旋,同时两条序列的跨膜蛋白N端和C端都位于细胞膜胞质的同一侧。

图4 Vf_KAR1的跨膜拓扑结构预测Fig.4 Predicted transmembrane topology of Vf_KAR1

图5 Vf_KAR2的跨膜拓扑结构预测Fig.5 Predicted transmembrane topology of Vf_KAR2
2.6 油桐Vf_KAR1和Vf_KAR2基因编码蛋白二级结构及三级结构的预测
利用在线工具SOPMA软件预测Vf_KAR1和Vf_KAR2氨基酸序列的二级结构,结果显示Vf_KAR1蛋白残基组成为:α-螺旋(h)为40.79%、β-折叠(e)为21.75%、β-转角(t)为9.97%、随机卷曲(c)为27.49%;Vf_KAR2的 α-螺旋(h)为44.00%、β-折叠(e)为19.67%、β-转角(t)为9.33%、无规卷曲(c)为27.00%。通过比较分析,Vf_KAR1和Vf_KAR2氨基酸序列的二级结构较为相似。
根据PDBsum数据库,对Vf_KAR1和Vf_KAR2三维结构数据库搜索已知的蛋白分子模板,结果显示Vf_KAR1和Vf_KAR2与Brassica napus.Rape的晶体结构(pDB:1edoA)最为相似,相似度达85.2%和81.07%,E-value=1.19e-107 和5.20e-104(图 6)。

图6 预测的Vf_KAR1和Vf_KAR2三级结构模板Fig.6 Predicted tertiary structure template of Vf_KAR and Vf_KAR2
利用EsyPred3Dwebserver1.0在线软件对Vf_KAR1和Vf_KAR2进行三维结构预测,并利用本地软件UCSF Chimera进行结构分析显示:Vf_KAR1和Vf_KAR2单体结构呈现典型的Rossmann折叠特征(如图7)。预测的Vf_KAR1和Vf_KAR2单体三维结构基本相似,它们都由10个α螺旋和7个β折叠组成,其中7个缠绕平行的β折叠分布于10个α螺旋的两侧,它们的结构中心由两个右手螺旋的βαβαβmotif组成。从疏水表面立体图可以看到酶的整个轮廓(图8),其中橘黄色为α螺旋,占主要部分。这些结构与β-酮脂酰-ACP还原酶发挥催化作用有着密切的关系。

图7 Vf_KAR1和Vf_KAR2彩带立体图Fig.7 Ribbons stereogram of Vf_KAR1 and Vf_KAR2

图8 Vf_KAR1和Vf_KAR2疏水表面立体图Fig.8 Hydrophobic surface graphic model ofVf_KAR1 and Vf_KAR2
3 结论与讨论
β-酮脂酰-ACP还原酶是唯一催化酮脂酰还原反应的酶,在植物脂肪酸合成途径中起着极其重要的作用,目前对植物β-酮脂酰-ACP还原酶基因的研究较少。本文根据实验室构建的油桐3个时期转录组数据分析,以葡萄桐近成熟种子为材料,扩增克隆了2个β-酮脂酰-ACP还原酶基因,命名并在GenBank数据库中登录,分别为Vf_KAR1和Vf_KAR2。经生物信息学分析发现,本实验获得的2个β-酮脂酰-ACP还原酶均无信号肽,但都有叶绿体转运肽;它们都为疏水性蛋白,都有典型的活化中心三联体(Ser-Tyr-Lys);它们的三级结构都有典型的Rossmann折叠特征;此外,它们的理化特性、拓扑结构及其二级结构也极相似,因此,推测Vf_KAR1和Vf_KAR2为油桐β-酮脂酰-ACP还原酶基因家族的两个成员。β-酮脂酰-ACP还原酶基因在多种植物(B.rassican napus)[3]、细菌(M.tuberculosis等)[14-15]和顶复门原虫(P.falciparum)[16]等生物中也发现了。它们都属于短链脱氢还原酶(SDR)家族[17],SDR家族的酶有一个相当保守的α/β折叠,它以Rossman折叠的形式存在,此外它在催化必需的质子传递系统中存在ser-Tyr-Lys三联体活化位点,并且后期的结构信息解析中也揭示了ser-Tyr-Lys三联体活化位点对β-酮脂酰-ACP还原酶的功能是极其重要的[18]。但是油桐β-酮脂酰-ACP还原酶基因家族成员的数量以及各成员的具体功能仍然有待验证。下一步将继续克隆β-酮脂酰-ACP还原酶基因家族的成员,利用真核表达、原核表达或RNA干扰技术,来分析该基因在油桐植物体内的生理功能,这为进一步研究油桐脂肪酸的生物合成与代谢调控提供了候选的基因资源。
[1]谭晓风.油桐的生产现状及其发展建议[J].经济林研究,2006,24(3):62-64.
[2]何方,何柏,王承南,等.油桐产品质量等级标准制订说明[J].经济林研究,2005,23(4):118-122.
[3]孙颖,卢彰显,李建安.中国油桐栽培利用与应用基础研究进展[J].经济林研究,2007,25(2):84-87.
[4]李建安,孙颖,陈鸿鹏,等.油桐LEAFY同源基因片段的克隆与分析[J].中南林业科技大学学报,2008,28(4):21-26.
[5]龙洪旭,谭晓风,陈洪,等.油桐油体蛋白基因的克隆及序列分析[J].中南林业科技大学学报,2010,30(4):31-38.
[6]谭晓风,谢禄山,张琳,等.油桐种子EST文库构建及主要表达基因的分析[J].林业科学,2006,42(1):43-48.
[7]Fisher M,Moon J T M,Martindale W,et al.The X-ray structure of Brassica napus β -keto aeyl camerrier protein reduetase and its implications for substrate blnding and catalysis[J].Structure,2000,8:339-347.
[8]Priee A C,Zhang Y M,Roek C O.et al.Structure of β -ketoaeyl-[acyl camerrier protein]reduetase from Eseheriehia coli:negative cooperativity and its structural basis[J].Biochemistry,2001,40:12772-12781.
[9]Sheldon P S,Kekwick R G,Smith C G,et al.β -Oxoacyl-[ACP]reductase from oilseed rape(Brassica napus)[J].Biochim Biophys Acta,1992,1120(2):151-159.
[10]Sheldon P S,Kelwick R G,Sidebottom C.β -Oxoacyl-(acyl-carrier protein)reductase from avocado(Persea americana)fruit mesocarp[J].Biochem J,1990,271:713-720.
[11]Klein B,Pawlowski K,Höricke-Grandpierre C,et al.Isolation and characterization of a cDNA from Cuphea lanceolata encoding a beta-ketoacyl-ACP reductase[J].Mol Gen Genet,1992,233(1/2):122-8.
[12]薛永常.木质素合成酶 C3H基因的生物信息学分析[J].生物信息学,2009,7(3):1672-5565.
[13]Kachroo A,Lapchyk L,Fukushige H,et al.Plastidial fatty acid signaling modulates salicylic acid and jasmonic acid-mediated defense pathways in the Arabldopsis ssiz mutant[J].Plant Cell,2003,15:2952-2965.
[14]Patel M P,Liu W,West J,et al.Kinetic and chemical mechanisms of the fab Gemcode Streptococcus pneumoniae β -ketoaeyl-ACP reduetase[J].Biochemistry,2005,44:16753-16765.
[15]Rafael G S,Luiz P S.Mycobacterium tuberculosis β -ketoaeyl-acyl carrier protein(ACP)reductase:kinetic and chemical mechanisms[J].Biochemistry,2006,45(43):13064-16073.
[16]Pillai S,Rajagupal C,Kapoor M,et al.Functional characterization of β -ketoaeyl-ACP reduetase(FabG)from Plasmodium falciparum[J].Biochem Biophys Res Commun,2003,303:387-392.
[17]Oppermann U,Filling C,Hult M,et al.Short-chain dehydrogenases/reduetases(SDR):The 2002 update,Chem-Biol[J].Interact,2003:143-144,247-253.
[18]Cohen-Gonsaud M,Dueasse M,Hoh F,et al.Crystal strueture of MabA from Mycobaeterium tuberculosis,a reduetase involved in long-chain fatty acid biosynthesis[J].J Mol Biol,2002,320:249-261.

