甘蓝型油菜小孢子培养及技术简化研究
李书宇,陈伦林,邹小云,邹晓芬,张建模,熊 洁,彭小松,宋来强*
(1.江西省农业科学院 作物研究所/油料作物重点实验室,江西 南昌 330200;2.江西农业大学,江西 南昌 330045)
小孢子培养是指将植物的小孢子直接从花药中分离出来进行培养,诱导成胚,进而发育成完整植株的一种技术。该技术可广泛应用于杂优亲本培育、常规育种、遗传群体构建和转基因等研究[1]。1982年Lichter[2]首次通过甘蓝型油菜小孢子培养获得再生植株后,国内外许多学者对影响甘蓝型油菜小孢子培养的诸多因素进行了广泛的研究[3-6],小孢子胚的再生频率有了很大提高。尽管近年来油菜小孢子培养体系不断完善,但该技术在应用过程中仍存在以下问题:甘蓝型油菜小孢子培养供体材料大多植于大田,受基因型和环境影响较大,小孢子培养胚诱导频率总体偏低,且油菜花期相对集中,按照小孢子胚诱导及生长发育的速度,当观察到无法获得胚状体时,很可能已错过花期,无法再重新取样培养。
本试验对影响小孢子培养胚状体发生的因素进行深入研究,进一步优化培养体系,提高胚状体的发生频率;对甘蓝型油菜小孢子培养配方进行简化,研究热击培养1d后倒置显微镜下小孢子的培养反应与最终产胚率的关系,建立快速评估最终产胚率的参考指标,在有限花期内提高工作效率。通过以上研究,进一步优化培育技术、简化操作环节,提高工作效率,对于小孢子培养技术大规模应用于育种实践具有较大意义。
1 材料和方法
1.1 供试材料
试验所用64份甘蓝型油菜于2010、2011年秋季种植在江西省农业科学院试验基地,露地栽培,常规管理。在次年2、3月份油菜花期,分别取各材料的花蕾进行游离小孢子培养。
2011年:0L001,0L002,0L003,0L004,0L005,0L006,0L007,0L008,0L011,0L012,0L013,0L014,0L017,0L018,0L025,0L028,0L029,0L030,0L032,03161,03183,03196,03203,03207,03243,03250,03255,03297,01479,OC1200,AM052,88267,99B01,湘杂油 1613。
2012年:11075,11123,11140,11456,11471,11561,11568,11571,11573,11575,11576,11577,1L001,1L009,1L010,1L011,1L012,1L014,1L015,1L022,1L023,1L025,1L026,1L027,1L032,1L033,1L034,1L039,1L041,1L044。
以上所用材料除湘杂油1613由湖南农业大学提供以外,均为江西省农业科学院作物研究所的育种后代材料。其中,1L002、1L014、1L023、1L027用于低温预处理对产胚率影响的研究,0L003、0L013、0L028用于简化小孢子分离洗液配方的研究。
1.2 方法
1.2.1 小孢子胚状体的诱导 在油菜初花期从田间选取生长健壮的植株,从主花序或一次分枝花序上选取3 mm左右大小的花蕾,用84消毒液灭菌15 min,然后用无菌水冲洗3次,置于离心管中加适量B5-13%蔗糖溶液(蔗糖浓度为13%的B5液体培养基)磨碎,经双层尼龙网过滤到离心管中,1 100 r/min离心4 min,重复2次,将小孢子悬浮于NLN-13液体培养基(含50 mg/L秋水仙素)并分装在培养皿中(密度约1个花蕾/mL),置于32℃黑暗条件下热击培养2 d。之后再离心,重新收集小孢子,悬浮于不含秋水仙素的NLN-13液体培养基,25℃暗培养至肉眼可见的胚状体。随后移至50 r/min、25℃恒温摇床上继续进行暗培养直至形成子叶形胚状体。
1.2.2 低温预处理对产胚率的影响 在初花期选取主花序和上部一次分枝花序,置4℃冰箱中低温冷藏0 h,6 h,24 h,2 d,3 d,4 d,5 d,6 d 后,分离培养小孢子。调查产胚率,以低温处理0 h 为对照。比较不同低温处理时间对小孢子培养产胚率的影响。产胚率是指通过小孢子培养获得的胚的数量与所用的花蕾个数的比值,下同。
1.2.3 简化小孢子分离洗液配方 在捣碎花蕾、离心收集小孢子的过程中,分别使用两种分离培养液:B5-13%蔗糖溶液(蔗糖浓度为13%的B5液体培养基)和13%蔗糖溶液,重复2次,分析不同分离培养液处理下产胚率的差异。
1.2.4 分离培养24 h后倒置显微镜下小孢子培养反应与产胚的关系 32℃黑暗条件下热击培养1 d后,将装有小孢子的培养皿取出,在倒置显微镜下观察小孢子的培养反应。根据倒置显微镜下观察到的情况,将小孢子的培养反应分为3个等级:好、一般和无培养反应。培养反应好:在任意一个视野中都可以看得大量小孢子发生明显的体积膨大。培养反应一般:可以观察到有小孢子发生明显的体积膨大,但数量不多。无培养反应:没有观察到小孢子发生明显的体积膨大。之后将培养皿放回32℃黑暗条件下继续培养,1 d后重新收集小孢子,悬浮于不含秋水仙素的NLN-13液体培养基,25℃暗培养至肉眼可见的胚状体。随后移至50 r/min、25℃恒温摇床上继续进行暗培养直至形成子叶形胚状体。统计各个材料的产胚率,并分析倒置显微镜下小孢子培养反应与产胚的关系。
2 结果与分析
2.1 不同基因型材料出胚的差异
在2011—2012年的小孢子培养试验中,对64份甘蓝型油菜取样进行小孢子分离培养(图1),不同材料胚状体发生频率差异较大。基因型0L007,0L011,11568等材料,平均产胚率均超过20个/蕾,而有些基因型材料如03250,03255,和AM052等多次取样分离培养,均不能获得胚状体。这些结果表明在相同培养条件下,不同基因型之间的产胚率存在很大的差异。通过2011—2012两年的小孢子培养试验,筛选出7个在江西南昌气候条件下高成胚率基因型材料,它们平均最高产胚量大于20个/蕾,分别是:0L007,0L008,0L011,0L032,11568,1L023和1L027。可利用这些材料通过小孢子培养的手段进行诱变育种筛选和转基因等相关研究,有着重要的理论研究和应用价值。
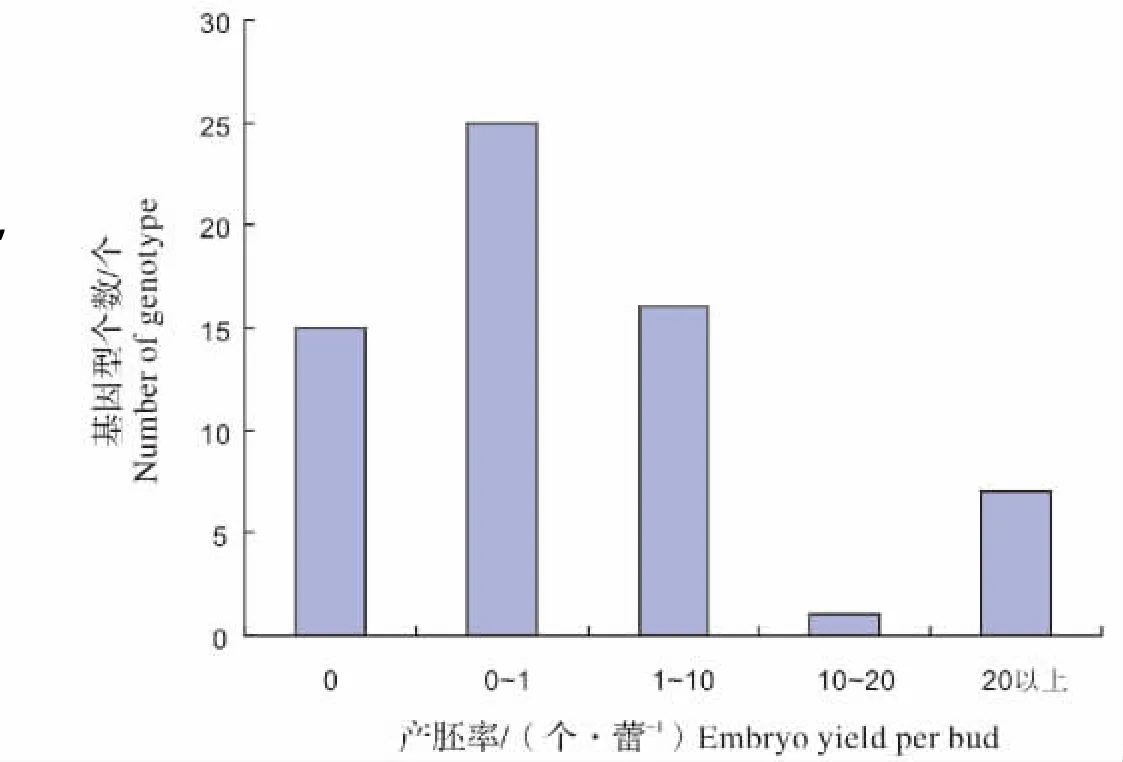
图1 2011—2012年不同基因型材料产胚率分布情况Fig.1 embryo yield among different genotypes in 2011 and 2012
2.2 低温预处理对产胚率的影响
由图2可知,花蕾低温预处理对4个基因型材料的产胚率都有影响,且随着预处理时间的延长,产胚率总体上呈先上升,后下降的规律,但不同基因型材料对低温预处理所需时间也不尽相同。如1L002的对照产胚率为3.93个/蕾,低温预处理6 h产胚率达到最高,为4.85个/蕾,而1L023基因型材料低温预处理24 h后,产胚率才达到最高,为30.75个/蕾。上述结果表明低温预处理可以提高小孢子胚诱导的频率,但不同基因型材料胚产量随预处理时间的变化规律也有差异,这可能表明不同基因型材料小孢子脱分化及胚胎发生对预处理的反应不同。
此外,不同基因型材料对低温预处理时间的耐受程度也不同,1L023和1L027耐受程度较高,低温预处理4 d后仍能保持较高的产胚率,分别为12.85个/蕾和23.40个/蕾,而1L002和1L014耐受程度则较低,超过2 d后产胚率就开始急剧下降。
2.3 简化小孢子B5分离洗液配方
在捣碎花蕾、离心收集小孢子的过程中,分别使用两种分离洗液:B5-13%蔗糖和13%蔗糖溶液,分析不同分离洗液处理下产胚率的差异。
方差分析结果表明(表1),不同洗液配方处理间差异未达到显著水平。因此在小孢子提取和分离过程中,不同分离洗液配方对后期产胚率没有显著影响。在分离洗液中蔗糖浓度影响渗透压,渗透压对小孢子的活力很重要,太高或太低都可能导致小孢子失水或膨胀,影响小孢子活力,因此保持一定的蔗糖浓度是必须的[7]。而在捣碎花蕾、离心收集小孢子的过程中因为时间相对较短,小孢子对养分的需求并不高,因此只需维持正常的渗透压,直接使用13%蔗糖溶液分离小孢子即可,不用再另外配制B5培养液,简化分离培养方法。

图2 低温预处理对产胚率的影响Fig.2 Effect of low temperature treatment on embryo yield

表1 不同分离洗液配方对产胚率的影响Tab.1 The effect of different separation lotion formula on embryo yields

图3 32℃热击培养1 d后小孢子培养反应Fig.3 Microspore culture response after one day’s heat shock culture
2.4 分离培养24 h后倒置显微镜下小孢子培养反应与产胚的关系
32℃热击培养1 d后,将装有小孢子的培养皿取出,在倒置显微镜下观察1.1中所列64份材料的小孢子培养反应。根据倒置显微镜下小孢子膨大反应情况,将小孢子的培养反应分为3个等级:好、一般和无培养反应。培养反应好(图3A):在任意一个视野中都可以看得大量小孢子发生明显的体积膨大、体积约为刚分离小孢子的2~4倍,并呈现透明状。培养反应一般(图3B):可以观察到有小孢子发生明显的体积膨大,但数量不多。无培养反应(图3C):没有观察到小孢子发生明显的体积膨大。观察记录完后将培养皿放回继续培养,统计各个材料的产胚率。通过分析发现以下规律(图4):①所有倒置显微镜下无培养反应的材料都没有出胚;②所有产胚率大于10个/蕾的材料在倒置显微镜下的培养反应等级都是好;③培养反应等级为一般的材料可能出胚也可能不出胚,但产胚率都不高。因此,可以在分离培养小孢子24 h后,根据倒置显微镜下观察小孢子的培养反应作出是否继续收集培养的判断,若发现培养反应不好或没有培养反应,可直接淘汰,无需再重新收集小孢子,转到不含秋水仙碱的NLN-13培养基中,以节省时间,也可重新取样分离培养,以免错过花期。

图4 分离培养24 h后小孢子培养反应与产胚的关系Fig.4 The relations between microspore culture response and embryo yield
3 讨论
本研究结果显示,在相同培养条件下,不同基因型之间甘蓝型油菜小孢子培养的产胚率存在很大差异。星晓蓉等[8]对22份春性甘蓝型油菜进行小孢子培养的结果也表明,不同组合平均每蕾产胚量在0-36.94个,出胚率差异比较大。余风群[9]、史庆馨等[10]也有类似报道。这都进一步说明基因型是决定胚状体发生的关键因素。在相同实验条件下,不同基因型材料小孢子培养反应的差异具体表现在出胚的难易,产胚的数量及胚状体的质量等方面。据报道,目前最易形成胚状体的两个材料是Topas和G231[11-12]。
Takahashi[13]曾报道低温预处理能明显提高油菜小孢子培养的胚状体发生频率。本实验延长了低温预处理的时间跨度,研究了不同基因型材料在不同低温预处理时间条件下的产胚率变化,结果也显示低温预处理能够提高小孢子培养的产胚率,且随着低温预处理时间的延长,产胚率总体呈先上升,后下降的规律。后期产胚率下降主要是由于长时间低温处理及新陈代谢,“体内”物质耗尽,影响了小孢子的正常发育,造成产胚率下降[14]。目前,关于低温预处理如何提高小孢子培养胚状体发生频率的作用机制并没有完全明确。有学者推测,通过低温预处理,改变了花药内源激素的含量或造成了花药中游离氨基酸总量的明显升高,而这种变化可以看作是花粉由配子体向孢子体发育的一种信号[15]。在我国,油菜小孢子培养的供体植株大多生长在大田环境下,容易受天气等因素影响,尤其对于中熟或中偏迟熟材料,初花期较迟,花期短,往往遇高温天气,导致小孢子发育时期趋于不一致,小孢子培养的脱分化启动及胚状体诱导均较困难。低温预处理不仅可作为一种有效措施,提高自然条件下的甘蓝型油菜小孢子胚状体发生频率[16],而且在温度升高前,提前集中取样,置于4℃条件下保存,在一定程度上可避免或减少高温天气对小孢子培养的不利影响。
捣碎花蕾、离心收集小孢子的过程时间相对较短,在短时间内维持小孢子的活力可能并不一定需要较多的营养物质,维持一定的渗透压即可。本实验结果表明,将分离洗液的配方由以前惯用的B5-13%蔗糖换成13%蔗糖溶液后,对小孢子培养的产胚率没有实质影响。因此,在配制小孢子培养所需药品时,可剔除B5营养成分,简化配方。
对于倒置显微镜下小孢子的培养反应与小孢子胚胎发生的关系,黄先群等[17]发现,热激培养2 d后小孢子的膨大率是衡量小孢子胚状体是否发生的一个有效指标。当小孢子的膨大比例超过50%时,胚状体发生出现质的转变,表现出集体效应。这种集体效应促使小孢子的发育转向孢子体发育途径。李华等[18]研究发现,茄子中离体小孢子的膨大率和活力可作为小孢子诱导胚状体发生潜能的早期指标,同时提出,可通过梯度离心等方式,对热击培养后发生膨大,有较高胚状体发生潜能的小孢子进行纯化,避免死亡的小孢子可能释放不利于细胞生长的物质,对小孢子造成毒害,从而提高小孢子的胚状体发生频率。国内甘蓝型油菜小孢子培养供体材料大多植于大田,小孢子培养通常集中在一定时期进行,按照小孢子胚诱导及生长发育的速度,当分离培养15 d左右观察到无法获得胚状体时,很可能已错过花期,无法再重新取样培养。本试验结果表明,可以在分离培养小孢子24 h后,根据倒置显微镜下观察小孢子的培养反应作出是否继续收集培养的判断,若发现培养反应不好或没有培养反应,可直接淘汰,无需再重新收集小孢子,转到不含秋水仙碱的NLN-13培养基中,以节省时间,也可重新取样分离培养,以免错过花期。
[1]梅德圣,李云昌,胡琼,等.油菜小孢子培养技术体系研究[J].农业生物技术科学,2005,21(12):72-76.
[2]Litchter R.Induction of haploid plants from isolated pollen of Brassica napus L.[J].ZPflanzenphysiol,1982,105(5):427-434.
[3]Ferrie A M R,Caswell K L.Isolated microspore culture techniques and recent progress for haploid and doubled haploid plant production[J].Plant Cell Tissue and Organ Culture,2011,104(3):301-309.
[4]Yadollahi A,Abdollahi M R,Moieni A,et al.Effects of carbon source,polyethylene glycol and abscisic acid on secondary embryo induction and maturation in rapeseed(Brassica napus L.)microspore-derived embryos[J].Acta Physiologiae Plantarum,2011,33(5):1905-1912.
[5]Pankaj B,Joan D,Patricia P,et al.A high throughput Brassica napus microspore culture system:influence of percoll gradient separation and bud selection on embryogenesis[J].Plant Cell Tissue and Organ Culture,2011,106(2):359-362.
[6]Mohammadi P P,Moieni A,Ebrahimi A,et al.Doubled haploid plants following colchicine treatment of microspore-derived embryos of oilseed rape(Brassica napus L.)[J].Plant Cell Tissue and Organ Culture,2011,108(2):251-256.
[7]祝师元.甘蓝型油菜Po1CMS恢复系小孢子培养后代的遗传变异[D].武汉:华中农业大学,2007.
[8]星晓蓉,杜德志,李秀萍.春性甘蓝型油菜小孢子培养技术研究[J].西北农业学报,2007,16(1):114-118.
[9]余凤群,刘后利.供体材料和培养基成分对甘蓝型油菜小孢子胚状体产量的影响[J].华中农业大学学报,1995,14(4):327-332.
[10]史庆馨.十字花科作物游离小孢子技术研究进展[J].北方园艺,2003(4):9-12.
[11]Ferrie A M R,Mollers C.Haploids and doubled haploids in Brassica spp.for genetic and genomic research[J].Plant Cell Tissue and Organ Culture,2011,104(3):375-386.
[12]Simmonds D H.Embryogenesis from microspores of embryogenic and nonembryogenic lines of Brassica napus[C].Proc8thIntern Rapeseed Cong,1991:306-311.
[13]Takahashi Y,Yokoi S,Takahata Y.Effects of genotypes and culture conditions on microspore embryogenesis and plant regeneration in several subspecies of Brassica rapa L.[J].Plant Biotechnology Reports,2012,6(4):297-304.
[14]李超.甘蓝型油菜DH系群体构建技术优化研究[D].重庆:西南大学,2009.
[15]黄剑华,陆瑞菊,王亦菲,等.低温预处理对大麦花药内源游离氨基酸和多胺水平的影响[J].中国农业科学,2001,34(6):626-631.
[16]郭世星,牛应泽,刘玉贞.低温预处理对甘蓝型油菜小孢子胚胎发生的影响[J].植物生理科学,2005,21(9):231-233.
[17]黄先群,毛堂芬,李丽,等.浅析几个因子对甘蓝型油菜游离小孢子胚胎发生的影响[J].种子,2008,27(2):33-39.
[18]李华,孙振英,连勇,等.茄子小孢子热激效应和发育潜能的细胞学分析[J].种子,2008,27(10):1-5.

