新城疫病毒Class I强毒株磷蛋白在细胞中的表达与定位
程靖华,孙英杰, 陈鸿军,仇旭升,宋翠萍 ,于圣青,吴艳涛,丁铲
(1.扬州大学兽医学院,扬州 225400;2.中国农业科学院上海兽医研究所,上海 200241)
新城疫病毒(Newcastle disease virus, NDV)是副黏病毒科、禽腮腺炎病毒属唯一成员,可以感染200余种禽类、鸟类和其他多种动物,一直是危害世界养禽业的最主要病患之一。根据系统发育进化树分析可将不同基因组长度的NDV分为两个群,即ClassⅠ(15198 nt)和ClassⅡ(15192 nt或15186 nt)[1,2]。目前已报道的大多数强毒分离株均属于ClassⅡ,而ClassⅠ中大部分是低致病力的弱毒株(loNDV)或无毒株,这些loNDV普遍存在于各种家禽和野鸟体内,因为NDV仅有一种血清型,因此,这些毒株与强毒株在血清学上根本无法区分[3]。也正是由于ClassⅠ毒株宿主具有高度迁徙的特点,极易导致NDV由野鸟或水禽向家禽中转移,进而演化为临床致病性强毒[4]。Yu等[5]研究发现一株从野生水禽分离到的非致病性NDV毒株,但当该病毒在SPF鸡体内经过9次气囊接种(9a)和5次脑内接种(5b)传代后,演变为速发型NDV,从而证实NDV弱毒株可以在鸡体内经传代后发生毒力变异。
NDV为单链负股RNA病毒,编码6种结构蛋白,即核衣壳蛋白(Nucleoprotein, NP)、磷蛋白(Phosphoprotein, P)、基质蛋白(Matrix proein, M)、融合蛋白(Fusion protein, F)、血凝素-神经氨酸酶(Hemagglutinin-neuraminidase protein, HN)和大分子蛋白(Large protein, L)[1]。其中,P蛋白可被高度磷酸化,P蛋白与L蛋白共同构成完整的RNA依赖的RNA聚合酶,对病毒RNA的转录、复制及修饰至关重要。本研究通过对P蛋白的表达、磷酸化水平检测和亚细胞动态定位情况分析,旨在为深入研究P蛋白磷酸化程度与功能关系、P蛋白参与病毒繁殖的具体机制奠定基础。
1 材料与方法
1.1 病毒 NDV Class I强毒分离株9a5b由中国农业科学院上海兽医研究所禽传染病实验室保存,其亲本毒株(Goose/Alaska/415/91)分离自一只已迁徙到阿拉斯加的野生水禽。将亲本毒株依次在鸡气囊中连续传代9次(9a),脑内传代5次(5b),获得第15代病毒,将纯化的第15代病毒命名为9a5b株。通过最小致死量致鸡胚平均死亡时间(mean death time, MDT)、1日龄雏鸡脑内接种致病指数(intracerebral pathogenicityintex, ICPI)和6周龄非免疫雏鸡静脉接种致病指数(intravenous pathgenicity index, IVPI)和全基因序列测定,均表明9a5b毒株完全具备强毒株特征。
1.2 实验动物及细胞系 SPF级BALB/c小鼠、昆明小鼠由莱克斯实验动物中心提供,SPF鸡胚由北京梅里亚维通实验动物有限公司提供,小鼠骨髓瘤细胞SP2/0由中国农业科学院上海兽医研究所禽传染病实验室保存,鸡0系成纤维细胞细胞系(chicken fibroblast cell line, DF1)由扬州大学秦爱建教授惠赠,培养液为含10%胎牛血清的RPMI 1640培养基。
1.3 载体和主要试剂 pCR2.1-T载体、Tirzol Reagents、Lipofectin Reagents和AccquireTaqPolymerase HF购自Invitrogen公司;凝胶回收试剂盒购自Qiagen公司;SalⅠ、EcoRⅠ、HindⅢ和XhoⅠ等限制性内切酶购自大连宝生物有限公司;pCI-neo真核表达载体、MLV Reverse Transcriptase和RNasin购自Promega公司;RPMI 1640培养基、澳洲源胎牛血清购自Gibco公司;辣根过氧化物酶(HRP)标记羊抗鼠IgG、FITC标记山羊抗鼠IgG、胰蛋白酶购自Sigma公司;ECL发光试剂盒购自Pierce公司;预染蛋白质Marker购自MBI公司;His-Band Resin Chromatography kit购自Novagen公司;β-actin单抗及显影液定影液试剂盒购自碧云天生物技术研究所;其他生化试剂均为分析纯。
1.4 P基因的克隆与原核表达
1.4.1 RT-PCR及亚克隆 将NDV分离株9a5b接种9~10日龄SPF鸡胚(购自北京梅里亚维通实验动物有限公司)尿囊腔扩增病毒,37 ℃培养24~96 h,分别收获尿囊液,10000×g离心10 min,收集上清液,测定病毒血凝价。取血凝价在27以上的尿囊液200 μL用于提取病毒RNA,提取方法按Invitrogen公司Tirzol Reagents操作手册进行。参照Promega公司Reverse Transcription System方法进行反转录,获得cDNA。根据GenBank NDV核苷酸序列设计并合成各种结构蛋白的引物(表1),引物由上海英骏生物技术公司合成。
RT-PCR扩增得到的特异性片段经1%琼脂糖凝胶电泳分离回收纯化后,与pCR2.1-T载体连接克隆于DH5α中,蓝白斑筛选,鉴定阳性克隆。取阳性克隆菌送至上海英骏公司测序。将正确的目的片段酶切后,与同样酶切的pET-32a(+)载体连接,转化BL21(DE3)感受态细胞,鉴定出阳性克隆,将阳性克隆进行诱导表达。

表1 本试验所用引物表Table1 Nucleotide sequences of primers used in the test
1.4.2 重组蛋白的表达与纯化 将阳性重组菌培养物于37℃振荡培养,至OD600达0.6~0.7时,用IPTG(终浓度0.5 mM)于37 ℃诱导4 h,超声波裂解后,进行SDS-PAGE电泳鉴定。并对重组菌的培养温度和诱导条件进行优化。利用纯化试剂盒对表达的P蛋白多肽进行纯化。
1.5 多抗血清和单抗的制备 将P蛋白的纯化产物按50 μg/只的量免疫BALB/c小鼠,4免后采血检测。对上述免疫反应为阳性的小鼠,加强免疫1次,在72 h时按刘秀梵[6]方法进行细胞融合。采用间接免疫荧光法(Indirect immunofluorescence, IFA)筛选阳性克隆,阳性克隆按有限稀释法亚克隆2次,最后挑选反应较强的单克隆扩大培养并作为建株细胞。按常规方法制备杂交瘤腹水[6]。
1.6 真核暂态表达检测 将全长的P基因亚克隆入pCI-neo真核表达载体中,将各质粒以无内毒素大提试剂盒纯化DNA后,按Lipofectin Reagents操作说明转染。简要步骤如下:取60 mm Dish,将飞片放入其中,接种DF1细胞,生长至50%~70%时,转染1μg DNA。待转染48 h 时,取1片飞片,以福尔马林∶ 甲醇液固定细胞,以单抗杂交瘤上清为一抗,FITC标记山羊抗鼠作为二抗,进行IFA鉴定实验;另取1片飞片刮取细胞,离心洗涤,用于Westernblot检测。
1.7 NDV感染细胞的动态监测 5 MOI NDV分离株9a5b感染DF1细胞,感染后每隔1 h 收集DF1细胞上清,测定TCID50,绘制生长曲线;并按常规方法[7]进行Western-blot检测和IFA检测。
IFA检测方法的简要步骤[7]:将DF1细胞接种到96孔细胞培养板中,加入含10% FBS的1640培养基在37 ℃中培养至70%左右时,病毒以5 MOI量感染DF1细胞单层,24 h 后以-20 ℃预冷的福尔马林液固定,置-20 ℃保存备用。
Western-blot检测方法的简要步骤:感染的DF-1细胞沉淀经BCA定量后,用2×上样缓冲液处理,进行SDS-PAGE电泳,按常规方法[7]进行免疫转印,5%脱脂乳封闭过夜,加入稀释度为1∶10 000的鼠源P蛋白特异性单抗腹水,37 ℃作用2 h,0.01M TBST洗涤10 min,加入HRP标记的山羊抗鼠IgG,稀释度为1∶10 000,37 ℃作用2 h,充分洗涤后以ECL增强显色试剂盒显色。
2 结果
2.1 P蛋白的原核表达与纯化 pET32a-P重组菌经0.05 mM IPTG诱导4 h 后超声波裂解,SDS-PAGE电泳结果发现:重组P蛋白存在于上清中,大量诱导后采用His-Band Resin Chromatography kit对上清进行纯化,SDS-PAGE电泳结果,见图1。

图1 纯化P蛋白SDS-PAGE电泳Fig.1 SDS-PAGE analysis of purif i ed P protein
2.2 P蛋白纯化产物的单抗特性 利用原核表达的P蛋白纯化产物作为免疫原,制备获得4株特异性单抗:1C4、1G5、3C10和3E4,通过IFA检测真核暂态表达的各结构蛋白,结果显示:1C4、1G5、3C10和3E4为P蛋白特异性单抗(图2)。

图2 IFA检测暂态表达的真核产物(×40)Fig.2 IFA test products of eukaryotic expression (×400)
2.3 NDV 9a5b毒株生长曲线 9a5b病毒按5 MOI量感染DF1细胞单层,每隔1 h 收集的DF1细胞上清,测定TCID50,结果显示:9a5b病毒感染1~8 h为对数生长期,至12~16 h达到生长平台期,病毒滴度为106.8TCID50/mL,36~48 h时病毒开始有少量的死亡,感染后36 h 的病毒滴度为106.5TCID50/mL,而感染后48 h 的病毒滴度降低为106TCID50/mL(图3)。这一结果符合新城疫病毒的感染特征。
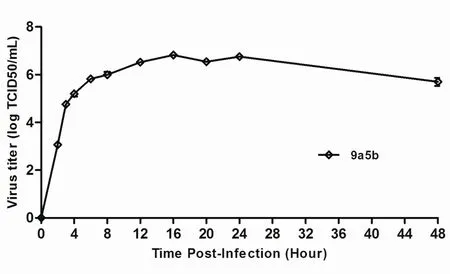
图3 NDV感染DF1细胞的生长曲线Fig.3 The growth curve of 9a5b virus infected with chicken embryo fi broblast (DF1) cells
2.4 P蛋白在不同感染时间点的细胞内分布 NDV 9a5b病毒按5 MOI感染量接种DF1单层细胞,理论上保证99%细胞均能被感染,经IFA检测结果显示:感染4 h 时P蛋白呈点状弥散分布于细胞浆内;6~8 h时,P蛋白聚集于细胞核周围;到感染后12h时,P蛋白呈单极化聚集于细胞核一侧;而当感染后16 h 开始形成合胞体时,P蛋白在单个细胞中仍呈现单极分布;当感染至48 h 时,细胞核已发生碎裂,荧光强度有所减弱(图4)。
Western-blot检测结果可见:以纯化P蛋白免疫小鼠后采集的血清为一抗,当P蛋白抗体的稀释度降低至1∶500,在感染9a5b后4 h 时,可通过免疫印迹检测出P蛋白已开始明显表达,随着时间延长,含量则不断增加(图5)。
3 讨论
NDV的P蛋白核苷酸序列含1185-1188个核苷酸(nucleotide, nt),编码395-396个氨基酸(amino acid, aa)。P蛋白与L蛋白一起构成病毒RNA聚合酶(P-L),对病毒RNA的合成起中心调节作用。P蛋白还能与未组装的NP蛋白前体NP结合,形成P-NP复合物,这种复合物既可以激活病毒基因组复制,也可以阻止NP与病毒RNA组装生成核衣壳[8,9]。本研究中P蛋白的出现略晚于NP蛋白,但两者在NDV感染过程中的定位呈现高度的一致性,包括早期的点状分布或是后期的单极分布[10],同时NP蛋白和P蛋白的真核表达产物也呈现一致的弥散性,这进一步证实了NP与P能够在感染过程中形成复合物促进病毒复制。

图4 不同感染时间P蛋白在细胞内的分布Fig.4 The distribution pattern of P protein in the course of infection

图5 不同感染时间P蛋白的Western-blot检测Fig.5 Western-blot analysis of the expression of P protein in the DF-1 cells infected with 9a5b virus
NDV的P基因在保守的484位编辑部位(3'-UUUUUCCC-模板链)通过聚合酶打滑机制,插入1个或2个非模板G(鸟嘌呤)残基,进行编辑。转录P mRNA(未编辑)翻译形成P蛋白。转录插入1个G残基的V mRNA(a+1移码新读框)翻译形成V蛋白。转录插入2个G残基的W mRNA(a+2移码新读框)翻译形成W蛋白[11,12]。有趣的是,我们通过NDV病毒感染后的Western-blot结果发现,病毒感染的中期(PI=12~14 h)在35 kDa左右出现了除了P蛋白之外的第二条蛋白,而在病毒感染晚期(PI=16~48 h)则在40 kDa左右出现了除了55,35 kDa之外的第三条蛋白,由于通过RNA编辑出现的V与W蛋白的N端与P蛋白序列一致,因此本实验制备的P蛋白单抗完全有可能与V和W蛋白发生交叉反应。本实验中病毒感染后期出现的P蛋白相关的三条带可以给出三种推论,第一,可能是上文提到的由RNA编辑形成的V和W蛋白,或者是可能存在类似麻疹病毒由于选择不同起始位点开始而在感染过程中出现的C蛋白[13];第二,由于N的P蛋白是一个磷酸化水平非常高的一个蛋白,因此出现的多条带可能是由P蛋白磷酸化水平的差异导致;第三,由以上病毒生长曲线以及荧光图片可以看出,细胞在感染后期发生一定程度的降解,病毒蛋白也伴随着一定程度的降解,因此55 KDa以下的小蛋白可能只是病毒P蛋白降解的产物。具体新出现的蛋白是由哪种机制导致的还有待于通过质谱等实验进一步证实。
Mebatsion T等[13]把NDV的P基因的编辑位点负义链的一个U(尿嘧啶)改变为C(胸嘧啶)构建了一个突变体(NDV-P1)。NDV-P1在9~11日龄鸡胚中传代2或3次病毒的增殖才可由HA试验检出,经5或6次卵传后的感染滴度各为每毫升6.7和7.1 Lg EID50,比父代病毒3次卵传后得到的滴度(9.2 Lg EID50/mL)低于100倍。蛋白印迹对稀释标本的分析显示,NDV-P1的V蛋白含量低于rNDV20倍。NDV-P1的毒力比其父代减弱至少106倍,即使剂量高达6 Lg EID50/mL也不能致死8日龄以后的SPF鸡胚。将NDV-P1接种18日龄SPF鸡胚,3.5 Lg EID50剂量的保护率达95%,4.3 Lg EID50和5.4 Lg EID50剂量时的保护率均达100%,所有对照鸡在攻毒3天内死亡。将NDV-P1应用于商业鸡胚的免疫,免疫胚的出雏率和雏鸡体重均与对照组没有差异,5.7 Lg EID50剂量保护率可达85%,证明NDV-P1具有突破母抗和提供保护的能力,是一个有前途的胚胎疫苗候选者。P基因编辑现象中,编辑位点的识别和G残基的插入可能是两个有区别的过程,它们联合实施调节P-基因mRNA编辑,对这种编辑的精确机制需进一步地研究揭示。
[1] Miller P J, Kim L M, Ip H S,et al.Evolutionary dynamics of Newcastle disease virus [J].Virology.2009, 391(1)∶64-72.
[2] Mia Kim L, Suarez D L, Afonso C L.Detection of a broad range of class I and II Newcastle disease viruses using a multiplex real-time reverse transcription polymerase chain reaction assay [J].J Vet Diagn Invest, 2008, 20 (4)∶414-425.
[3] Lee E K, Jeon W J, Kwon J H,et al.Molecular epidemiological investigation of Newcastle disease virus from domestic ducks in Korea [J].Vet microbiol, 2009,134(3-4)∶ 241-248.
[4] Zanetti F, Berinstein A, Carrillo E.Effect of host selective pressure on Newcastle disease virus virulence [J].Microbial pathogenesis, 2008, 44 (2)∶135-140.
[5] Y S Q, Kishida N, Ito H,et al.Generation of velogenic Newcastle disease viruses from a nonpathogenic waterfowl isolate by passaging in chickens [J].Virology,2002, 301 (2)∶206-211.
[6] 刘秀梵.单克隆抗体在农业上的应用[M].合肥∶ 安徽科学技术出版社, 1994∶ 11-50.
[7] Qiu Y, Shen Y, Li X,et al.Polyclonal antibody to porcine p53 protein∶ a new tool for studying the p53 pathway in a porcine model [J].Biochem Biophys Res Commun, 2008, 377(1)∶ 151-155.
[8] Errington W, Emmerson P T.Assembly of recombinant Newcastle disease virus nucleocapsid protein into nucleocapsid-like structures is inhibited by the phosphoprotein [J].J Gen Virol, 1997, 78 (9)∶ 2335-2339.
[9] Karlin D, Longhi S, Receveur V,et al.The N-terminal domain of the phosphoprotein of morbilliviruses belongs to the natively unfolded class of proteins [J].Virology,2002, 296 (2)∶ 251-262.
[10] 孙英杰,ClassⅠ新城疫病毒核衣壳蛋白在体外细胞感染过程中表达定位的检测 [J].中国预防兽医学报, 2011,33 (2)∶ 85-88.
[11] Lamb R A, Kolakofsky D.Paramyxoviridae∶ The viruses and their replication [M].In Fields Virology (Fields B N,Knipe D M, Howley P Met al.eds), 2001∶ 1305-1340.
[12] Steward M, Vipond I B, Millar N S,et al.RNA editing in Newcastle disease virus [J].J Gen Virol, 1993, 74 (12)∶2539-2547.
[13] Bellini W J, Englund G, Rozenblatt S,et al.Measles virus P gene codes for two proteins [J].J Virol, 1985, 53 (3)∶908-919.
[14] Mebatsion T.Extensive attenuation of rabies virus by simultaneously modifying the dynein light chain binding site in the P protein and replacing Arg333 in the G protein[J].J Virol, 2001, 75(23)∶ 11496-11502.
