6种新型香豆素类衍生物的拉曼光谱研究
刘婵,周吉,刘丽娜,任华华,叶勇
(湖北大学化学化工学院,湖北 武汉430062)
0 引言
我国拥有丰富的植物资源,其中香豆素类化合物由于合成相对简单、生物利用度高等优点,现已广泛应用于医药、食品、染料、光学材料及生物医学等方面[1].香豆素是具有苯并吡喃酮母核的一类天然化合物的总称,具有芳香气味.广泛分布在植物界,如芸香科、伞形科、木樨科、豆科、菊科以及茄科等植物中.在动物以及微生物代谢产物中也有存在[2].香豆素衍生物的结构类型多样,具有多种活性.研究表明,香豆素类化合物具有抗HIV、抗癌、降压、抗心律失常、抗骨质酥松、镇痛、平喘及抗菌等多方面的活性[3-5].由于其存在药效不高、利用度低等缺点,人们对香豆素进行了大量的结构改造工作,开发一些有特殊功能的香豆素.在确定分子结构的分子光谱中,红外和拉曼光谱技术都可以表征分子的特征光谱,其中拉曼光谱具有无损、无需制样、快速检测的优点,可以很好地进行化合物的成分分析和结构的表征.
本实验利用香豆素易与烯烃发生环加成反应,构建香豆素并环戊烯的三元稠环化合物,用以找出香豆素潜在的生物活性.采用拉曼光谱对其结构进行表征,对化合物的特征光谱进行了归属分析,讨论分子结构差异对拉曼光谱的影响.
1 仪器与试剂
1.1 仪器与试剂 中间体3-(4-甲基)苯甲酰基-2H-1-苯并吡喃-2-酮的合成试剂为水杨醛、对甲基苯甲酰乙酸乙酯、哌啶、乙酸.联烯的合成试剂为三苯基膦和溴乙酸乙酯、二氯甲烷、三乙烯二胺(DABCO)做催化剂.所有试剂均为分析纯.拉曼光谱测试选择法国Hobin Yvon公司生产的HR800显微共聚焦拉曼光谱仪.
1.2 实验方法
1.2.1 香豆素衍生物的合成 将水杨醛、对甲基苯甲酰乙酸乙酯、哌啶、醋酸装入圆底烧瓶中,冷凝回流析出白色固体.然后依次加入2-3联烯酸乙酯,0.2mol的DABCO做催化剂,二氯甲烷做溶剂,与联烯发生环加成反应,电磁搅拌下反应完全后,用石油醚将产物析出,得到白色固体,即形成了香豆素并吡喃的三元稠环香豆素衍生物[6-7].具体合成路线如图1所示.
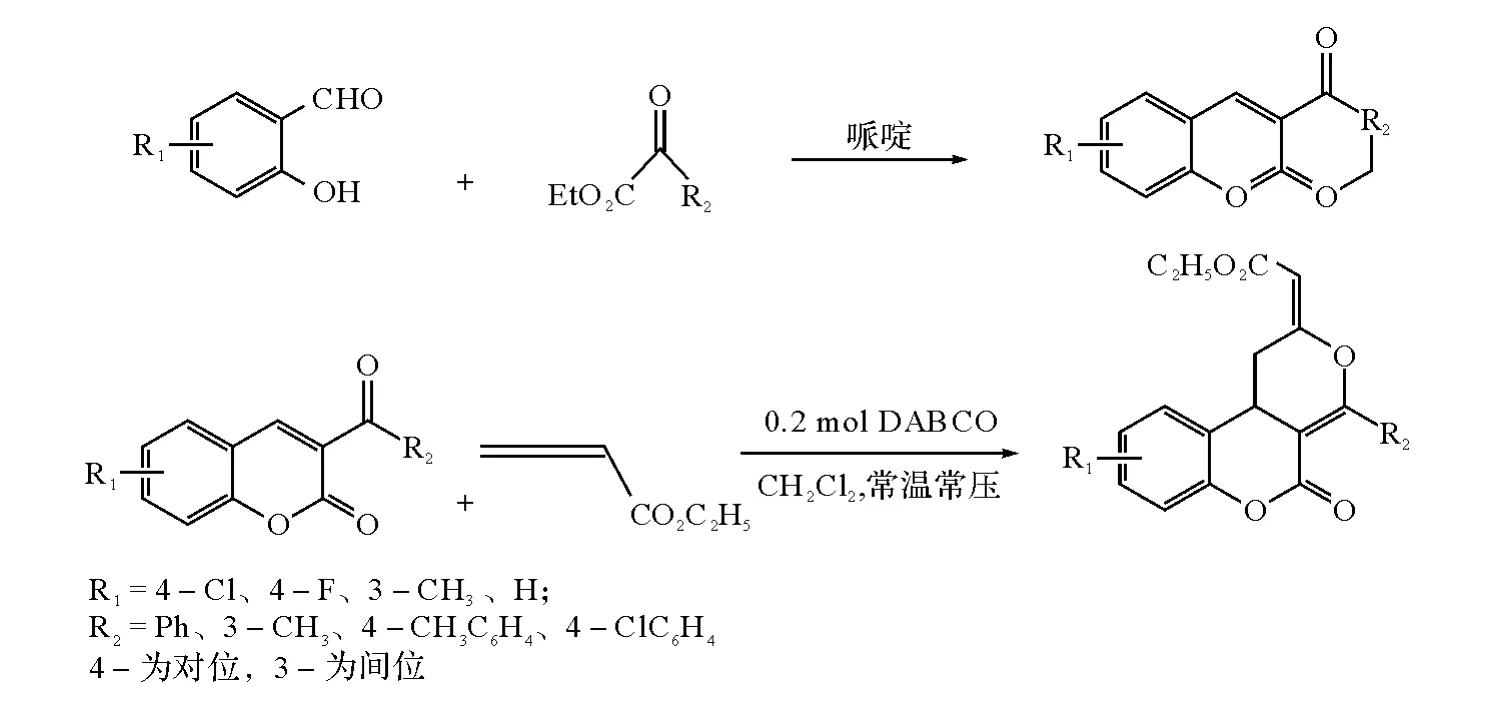
图1 香豆素衍生物的合成路线
化合物的编号如表1:
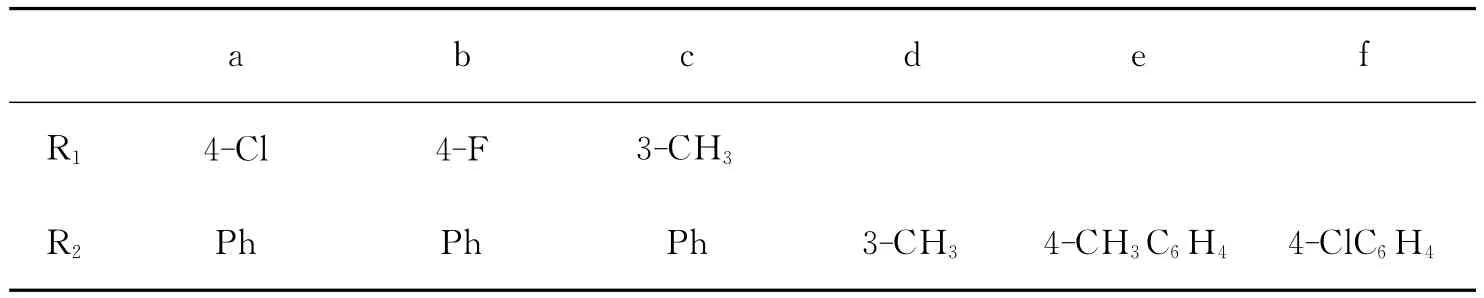
表1 取代基的编号
1.2.2 拉曼光谱测试 将样品放在载玻片上,置于拉曼光谱仪的显微镜载物台上进行检测.激发波长为633nm,激发时间为1s,扫描范围为200~1 800cm-1,所得的样品谱图见图2.
2 结果与讨论
我们对6种香豆素衍生物进行了拉曼测试,结果如图2a~f.
从拉曼图谱中来看,b、d、e、f的荧光信号较强,但可以分辨,不影响拉曼检测.从结构上来看,他们的分子骨架基本一致,6种香豆素衍生物表现出光谱共性.而由于它们的取代基团R1、R2的不同,在光谱中也表现了出明显的差异性,主要体现在:
1)在1 630cm-1附近的一个强而尖锐的吸收可归因于苯环的C═ C伸缩振动,很好的证实了所合成的化合物部分结构.而C═ C伸缩振动则由于R2取代基的共轭效应向低波数方向移动,在1 660 cm-1附近.
2)在1 740cm-1附近有两个峰,对应其化合物结构可以发现化合物中是有两类羰基,由于环张力,使位于支链处的酯的C═ O振动向低波数移动.
3)吡喃环中的C—O—C对称伸缩振动在1 120cm-1附近,峰形尖锐,强度较大.
4)C—H面内变形振动在1 030cm-1附近,并在1 002cm-1处出现很强的环呼吸振动谱带.
5)戊内酯中的C═ O振动由于与苯环相连,苯环上取代基的不同和取代位置的不同也对其振动产生影响.以化合物a、b、c为例,化合物a、b的C═ O振动波数比化合物c要高16~19cm-1,这可能是由于在苯环上的取代基不同,由于吸电子诱导效应C—F、C—Cl很强,使得C═ O上的电子云减少,使得化合物a、b向高波数移动最多,化合物c移动较少.
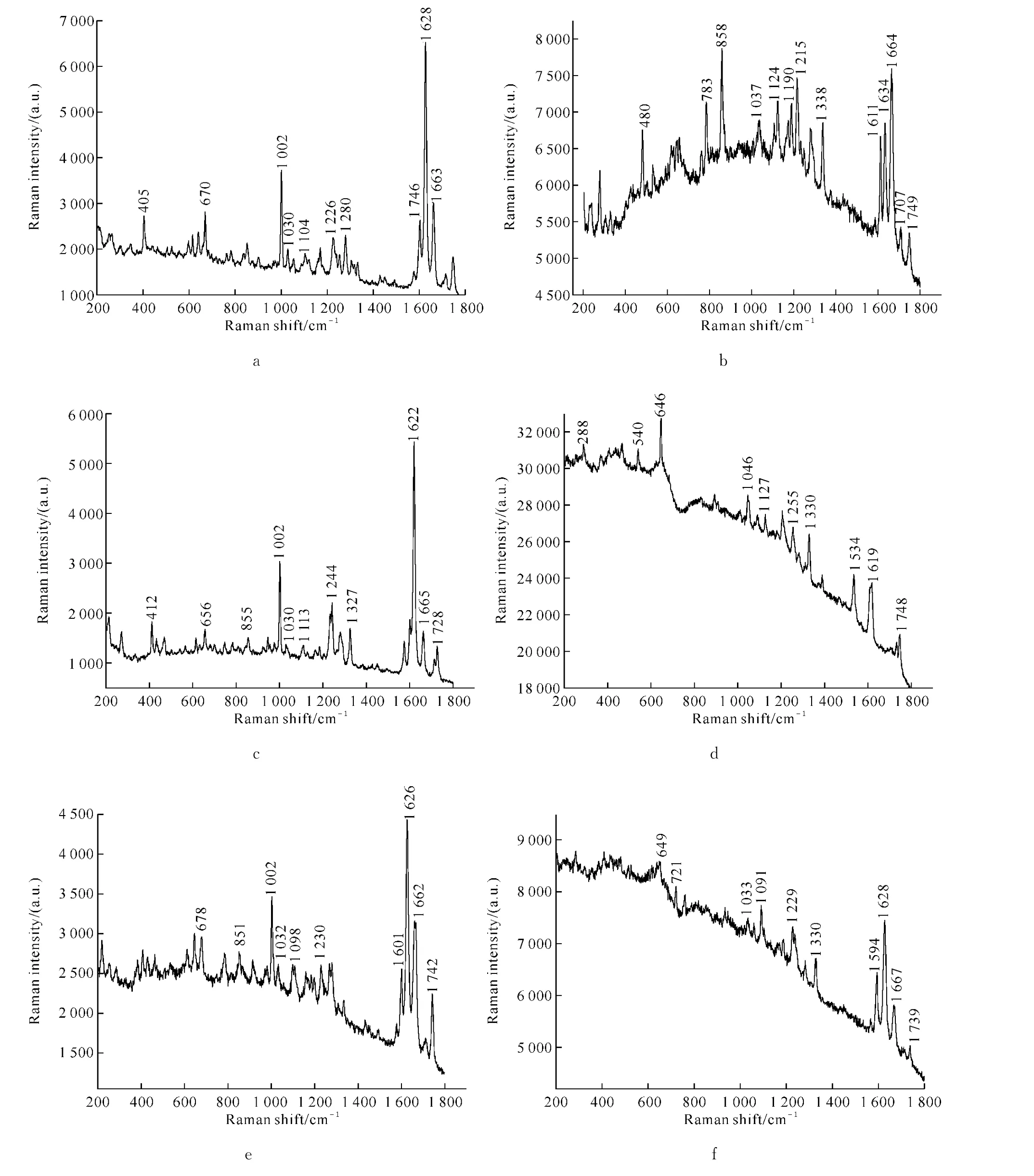
图2 6种香豆素衍生物的拉曼光谱图
对以上图谱进行归属[8-10],见表2.
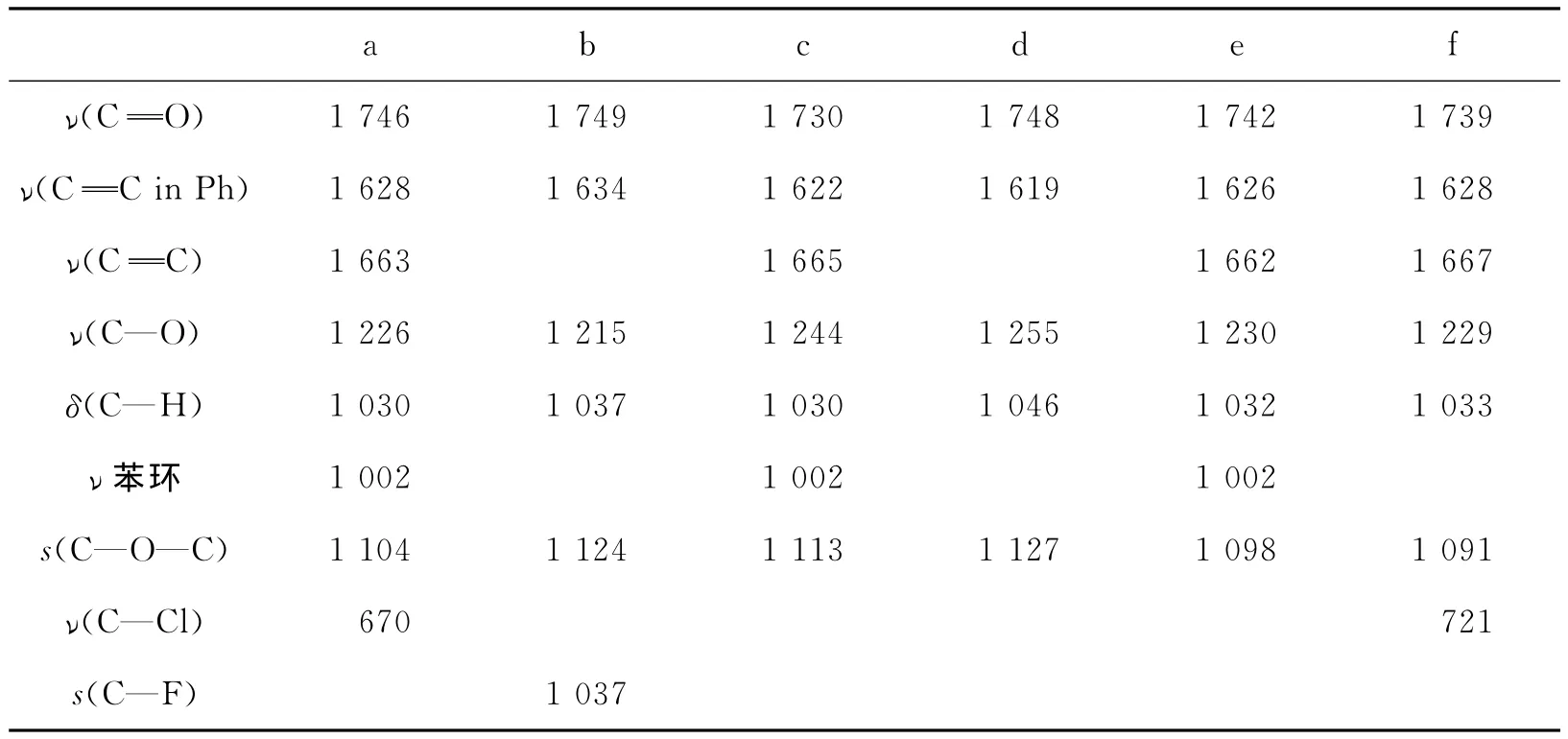
表2 拉曼光谱特征谱峰归属
表中的缩写:Ph,苯环;ν,伸缩振动;δ,弯曲振动;s,对称;ν苯环,苯环呼吸振动
3 结论
新合成了6种新型香豆素衍生物,测试了它们的拉曼光谱,对主要谱峰进行了归属,讨论了光谱与结构之间的关系,利用拉曼光谱研究此类分子振动光谱具有无损、无需制样等优势.对此类新型化合物的生物学活性进行进一步的研究,以期望能发现其潜在的生物学活性.
[1]袁明月,张冬暖,闫红飞,等.N-(4-取代苯基-噻唑-2-基)香豆素类亚胺化合物的合成及抑菌活性研究[J].有机化学,2011,31(011):1930-1933.
[2]张韶瑜,孟林,高文远,等.香豆素类化合物生物学活性研究进展[J].中国中药杂志,2005,30(6):410-414.
[3]Shikishima Y,Takaishi Y,Honda G,et al.Chemical constituents of prangos tschimganica;structure elucidation and absolute configuration of coumarin and furanocoumarin derivatives with anti-HIV activity[J].Chemical and Pharmaceutical Bulletin,2011,49(7):877-880.
[4]Marshall M,Conley D,Hollingsworth P,et al.Effects of coumarin(1,2-benzopyrone)on lymphocyte,natural killer cell,and monocyte functions in vitro[J].Journal of Biological Response Modifiers,1989,8(1):70-85.
[5]Periers A M,Laurin P,Ferroud D,et al.Coumarin inhibitors of gyrase B with N-propargyloxy-carbamate as an effective pyrrole bioisostere[J].Bioorganic & Medicinal Chemistry Letters,2000,10(2):161-165.
[6]Wang Y,Yu Z H,Zheng H F,et al.DABCO and Bu3P catalyzed[4+2]and[3+2]cycloadditions of 3-acyl-2hchromen-ones and ethyl 2,3-butadienoate[J].Organic & Biomolecular Chemistry,2012,10:7739-7746.
[7]Henry C E,Kwon O.Phosphine-catalyzed synthesis of highly functionalized coumarins[J].Organic Letters,2007,9(16):3069-3072.
[8]蔡萱,曹菲菲,胡利明,等.新型咪唑啉酮类化合物的拉曼光谱特性研究[J].分析科学学报,1995,21(5):500-503.
[9]胡继明,吴叶,刘石,等.四种新芳氧羧酸类除草剂的拉曼光谱研究[J].光谱学与光谱分析,2006,(6):1125-1128.
[10]施耀曾.有机化合物光谱和化学鉴定[M].南京:江苏科技大学出版社,1995:54-145.

