加味芪黄饮对高糖培养下大鼠肾小球系膜细胞细胞外基质成纤维连接蛋白(FN)及p12MAPK信号通路的影响
饶家珍 唐瑾秋 刘晓璇 蒙向欣 赵 威 于晓瑜 陈家湄 李 娟 俸 维
(广州市中医医院·510130)
糖尿病肾病(Diabetic Kidney Disease,DKD)是糖尿病患者主要死亡原因之一,是糖尿病常见微血管并发症之一,其病理变化包括:肾脏肥大,肾小球及肾小管基底膜增厚、肾小球基质增生,肾间质纤维化、硬化等,其中肾小球系膜细胞(mesangial cells,MCs)增生肥大和细胞外基质(extracellular matrix,ECM)积聚被认为与DN 发生发展密切相关[1]。因此抑制MCs 增生,减少ECM 积聚,对防治DN具有重要的临床价值。加味芪黄饮是饶家珍老师的经验方,由太子参、黄芪、生地、泽泻、山茱萸、山药、茯苓、丹皮、蝉蜕、溪黄草、白茅根组成。由六味地黄丸加减而来,以益气养肾,利尿摄精为法;六味地黄汤具有提高免疫功能,恢复损伤的肾功能,降低蛋白尿,尿素氮,并能抗氧化。近年来研究发现,加味芪黄饮可以减轻早期DN 肾小球、肾小管的损害,缓解肾功能损伤,有效阻止早期DN 的进展,减少早期DN 的肾脏结构和功能改变[2-3]。本研究观察加味芪黄饮对高糖培养的大鼠肾小球系膜细胞细胞外基质成分之一纤维连接蛋(fibronectin,FN)的影响,从p38 丝裂原活化蛋白激酶(p38mitogen-activated protein kinase,p38MAPK)信号通路方面探讨其可能的作用机制,初步探讨加味芪黄饮对糖尿病肾病的作用机理。
1 材料与方法
1.1 材料
1.1.1 实验动物 SD 大鼠100 只,雌雄各半,SPF 级,体重150~180g,由广东省医学实验动物中心提供,许可证号:SCXK(粤)2008-0002,动物质量合格证编号:0108386,用于加味芪黄饮中药含药血清制备。
1.1.2 细胞来源 大鼠肾小球系膜细胞系(HBZY-1),购自中国典型培养物保藏中心(CCTCC 中国武汉大学)。
1.1.3 实验药物、试剂、仪器 SB203580(p38MAPK 抑制剂,Sigma 公司);D2 甘露醇(超纯级,MBCHEM 公司);D2(+)2 葡萄糖(Sigma 公司纯度≥99.5%);胎牛血清(杭州四季青公司);MEM 培养基(Hyclone 公司)、抗鼠FN 一抗(Santa Cruz 公司);抗鼠磷酸化p38 一抗、抗鼠磷酸化CREB 一抗(Cell Signaling 公司);抗鼠二抗(Santa Cruz 公司)。pbs 液(上海双螺旋)、胰酶(中国医学科学院)纯水仪:美国Millipore 公司Q-Plus 电子分析天平:德国Sartorius,d=0.1mg 多功能酶标仪:瑞士TECAN 台式冷冻离心机:美国Beckman 细胞培养箱:日本SANYO 公司倒置显微镜:OLYMPUS,PM-10AD,超净工作台:哈尔滨东联电子技术发展有限公司,自动高压灭菌器:HVE-50,日本平山(Hirayama)公司。
1.2 方法
1.2.1 含药血清制 加味芪黄饮中药(太子参、黄芪、生地、泽泻、山茱萸、山药、茯苓、丹皮、蝉蜕、溪黄草、白茅根)生药由广州市中医医院提供,中药汤剂在实验室制备,药物水煎、过滤、浓缩至含生药2.5×103g.L-1,分装灭菌,4℃保存备用。100 只大鼠随机分为加味芪黄饮中药血清组,正常大鼠组,每组50 只,中药血清组大鼠按200mg/kg 加味芪黄饮方剂量每1g 中药,34g/kg 加味芪黄饮总方剂量,以成人剂量每kg 的12.1 倍,灌喂中药煎剂,正常大鼠组灌喂同等中药煎剂量的生理盐水;每日分2 次给药,连续给药3d,末次给药1h 后下腔静脉取血,无菌分离血清,两组血清各自合并后经56℃、30min 灭活,0.22μm 微孔滤膜过滤,置-70℃冰箱保存备用。
1.2.2 大鼠肾小球系膜细胞的培养与传代 大鼠肾小球系膜细胞株(HBZY21)常规培养于含20%胎牛血清的MEM 培养基中(加100ku·L-1青霉素,100mg·L-1链霉素),培养条件为37℃,饱和湿度5%CO2。每2~3d 用含0.04%EDTA 的胰酶消化传代,传代后第3~5 代的细胞用于实验。
1.2.3 实验分组与用药 用胰酶消化贴壁的系膜细胞,经离心,吹打,混匀,稀释成相应的密度(2.5×107·L-1)接种至60mm 培养皿中,常规培养,细胞生长近融合时,无血清培养24h 同步化后,按照不同实验要求,给予高糖(或甘露醇)和药物刺激24h,收集细胞用于Western blot 检测。实验分为6 组:(1)正常组:5.6mmol/L-1gluose;(2)甘露醇组,作为高渗对照组:5.6mmol/L-1glucose+24.4mmol/L-1mannito;(3) 高 糖 组:30mmol/L-1glucose;(4)SB203580 组:30mmol/L-1glucose+10μmol/L-SB203580;(5)加味芪黄饮低剂量组:30mmol/L-1glucose+10%含加味芪黄饮含药血清(0.5ml 含药血清+4.5ml 无血清MEM 培养基);加味芪黄饮高剂量组:30mmol/L-1glucose20%含加味芪黄饮含药血清(1ml含药血清+4ml 无血清MEM 培养基);各组均加入正常大鼠血清和MEM 培养基,使血清终浓度为20%。
1.2.4 Western blot 检测大鼠肾小球系膜细胞纤维连接蛋白、p38MAPK、p-CREB 蛋白表达水平 分组药物干预24h 后。终止培养,吸弃孔内培养基,用冷PBS 漂洗细胞1~2 次,空干后,加裂解液70μl/皿,用细胞刮子刮下培养皿底的细胞,收集细胞裂解液至1.5mlEP 管中,BCA 蛋白定量法测定各组蛋白质含量经12%SDS-PAGE 电泳分离蛋白质,每孔上样量40μg 总蛋白。用Bio-Rad 电转仪将凝胶中的蛋白质转移至PVDF 膜上。转移结束后,卸下电泳装置,把硝酸纤维素转移膜放入盛有5%脱脂奶粉封闭液中,封闭1h。封闭完毕后用PBST洗膜5次,每次间隔5分钟,加一抗(抗鼠FN一抗(1∶200)抗鼠p38MAPK 一抗(1 ∶2000)、抗鼠磷酸化CREB(1 ∶2000)),4°孵育过夜,次日洗膜3 次每次间隔5 分钟。加辣根过氧化物酶标记抗鼠二抗(1 ∶2000),室温孵育1h。洗膜5 次每次间隔5 分钟。洗膜后取ECL 荧光底物(Pierce 公司,货号:37071)A 液和B 液各1mL,混匀后,将PVDF 膜浸泡其中,室温孵育3-5 分钟后,用滤纸将PVDF 膜表面液体擦干,并将其置于暗室,取医用X 光底片覆盖,曝光1 分钟后,依次显影、定影。美国UVP 公司lab works4.5 凝胶蛋白分析软件对条带进行灰度分析。
1.2.5 统计学方法 本研究结果采用SPSS 17.0 统计软件处理,计量资料用±S 表示,组间比较采用单因素方差分析(one-way ANOVA),方差齐者采用LSD 法,方差不齐采用Tamhane’s T2 法,P<0.05 为差异有显著意义。
2 结果
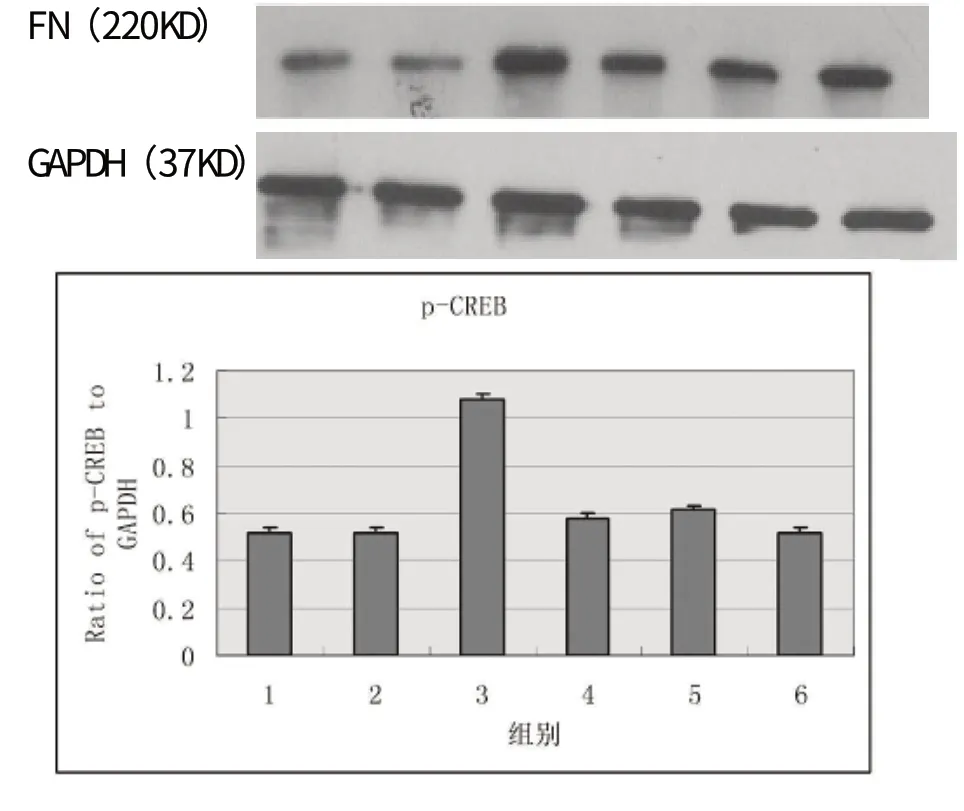
2.1 对高糖培养的大鼠肾小球系膜细胞FN 的影响
高糖组的FN 的表达与正常组相比明显增加(P<0.05)。与高糖组组相比较,sb203580 组和加味芪黄饮低剂量组、加味芪黄饮高剂量组的FN 表达均明显减少(P<0.05)。加味芪黄饮低剂量组与sb203580 组相比FN 的表达升高(P<0.05),加味芪黄饮高剂量组FN 表达的减少与sb203580 组相比差异无显著性(P>0.05),加味芪黄饮高剂量组与加味芪黄饮低剂量组相比FN 的表达降低(P<0.05)。甘露醇与正常组相比差异无显著性(P>0.05)。
2.2 对高糖培养的大鼠肾小球系膜细胞p38MAPK 蛋白的影响
高糖组的磷酸化p38MAPK 的表达水平与正常组相比明显升高(P<0.05)。与高糖组组相比较,sb203580 组和加味芪黄饮低剂量组、加味芪黄饮高剂量组的磷酸化p38MAPK 表达明显减少(P<0.05),sb203580 组、加味芪黄饮低剂量组、加味芪黄饮高剂量组组间差异有显著性(P<0.05),加味芪黄饮组较sb203580 组p38MAPK 的表达水平降低(P<0.05)。甘露醇与正常组相比差异无显著性(P>0.05)。

2.3 对高糖培养的大鼠肾小球系膜细胞磷酸化CREB 的影响
高糖组的磷酸化CREB 的表达与正常组相比明显增加(P<0.05)。与高糖组相比较,sb203580 组和加味芪黄饮低剂量组、加味芪黄饮低剂量组的磷酸化CREB 表达明显下调(P<0.05),加味芪黄饮低剂量组与sb203580 组组间差异无显著性(P>0.05),加味芪黄饮高剂量组与sb203580 组相比CREB 表达降低(P<0.05)。
加味芪黄饮高剂量组与加味芪黄饮低剂量组相比CREB 的表达降低(P<0.05)。
甘露醇与正常组相比差异无显著性(P>0.05)。

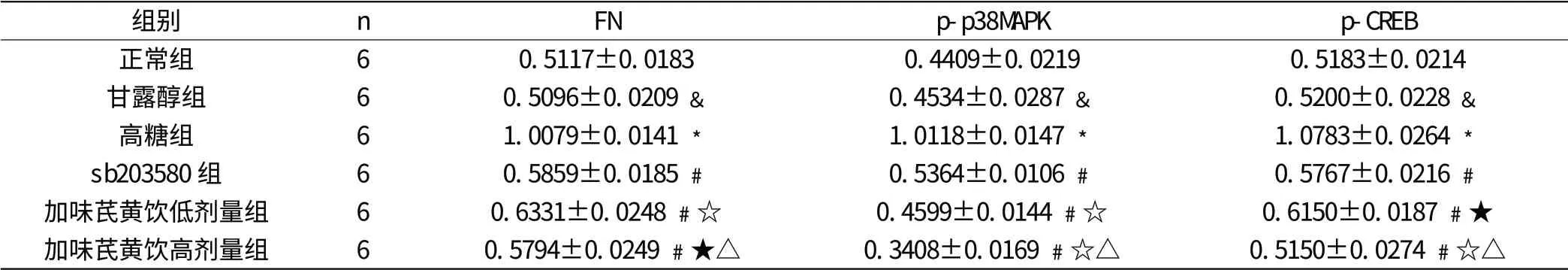
与正常组相比,﹡P < 0.05,﹠P > 0.05;与高糖组相比,﹟P < 0.05;与sb203580 组相比,☆P < 0.05,★P > 0.05;与加味芪黄饮低剂量组相比:△P < 0.05(其中加味芪黄饮低剂量组与sb203580 组相比FN 的表达升高P < 0.05)
3 讨论
祖国医学认为,DKD 的形成多因先天不足,五脏虚弱,病位在肺、脾、肾,以肾为主。我们认为DKD 为本虚标实之证,主要病机为气阴两虚、湿浊内蕴,气阴两虚气血运行不畅,湿浊久蕴体内,损伤机体经络,日久渐成微小癥积,发为本病。故拟益气养肾,利尿摄精为法。其中黄芪为补气要药,善补脾气,又具利水祛湿,能实土封堤,摄血藏精,为君药太子参补中益气,津生血复;生地黄与黄芪,太子参相配,互相促进,增其补益之功;山茱萸、山药滋补肝肾,涩精固脱共为臣药;山药尚健脾补虚;五药相配,滋养肝脾肾。茯苓补气健脾,泽泻利湿泄浊,二药为佐药;丹皮、溪黄草清热凉血、活血化瘀为使药。白茅根凉血止血,蝉蜕本为疏风之药,用在此处可降低蛋白尿。全方补泻兼顾,共奏益气养肾,利尿摄精之功,临床疗效颇佳。我们前期也做了一些相关的临床和实验研究,证明此方可延缓DKD 的发生发展[2,3]。
DKD 的发病机制复杂,目前尚未明确。目前多认为其发病与遗传因素,高血糖导致的一系列代谢紊乱[4],及血流动力学改变,肾小球功能异常,蛋白的非酶糖化,山梨醇代谢途径亢盛等因素有关,而且氧化应激和羧基应激损伤也参与了DKD 的发病过程,尤其与肾小球系膜细胞增殖、系膜增厚密切相关[5]。高血糖,胰岛素抵抗,是导致DKD 的主要原因,其中高血糖可由不同途径损害肾脏,这些损害可以累及肾脏所有结构。系膜细胞是肾小球内最活跃的固有细胞,具有产生细胞外基质、分泌细胞因子、吞噬和清除异物等多种功能,其功能异常与多种肾脏疾病的发生、发展有关。持续高血糖状态会促使肾小球系膜细胞增殖,并随时间的延长,细胞增殖越明显。DKD 是病理以肾脏肥大、细胞外基质积聚,肾小球和肾小管间质纤维化为特征的疾病。DKD 的主要病理改变是细胞外基质的积聚扩张伴随系膜细胞增殖而出现[6,7]。肾脏系膜细胞增殖、肥大、细胞外基质积聚扩张导致肾小球硬化、纤维化[8]。FN 主要由系膜细胞产生,是系膜基质的重要成分之一,多项体内、外实验均表明高糖可以诱导肾小球系膜细胞细胞外基质成分如纤维连接蛋白、胶原合成明显增加[9~12]。因此,抑制肾小球系膜细胞FN 的表达,有利于减少细胞外基质的积聚,阻止或延缓肾小球硬化的进程。
p38 丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)是细胞内重要的信号转导途径,研究研究提示,p38MAPK 是细胞信号传递的交汇点,多种糖尿病状态都能诱导p38MAPK 激活[13]。从而引起细胞生长、增殖、分化和凋亡,这可能是糖尿病血管并发症发生发展的共同通路。p38MAPK 主要表达在肾小球系膜细胞中,DN 患者p38MAPK阳性细胞的高表达虽然与肾小球损伤程度不相平行,但与肾间质损伤程度成正比[14]。研究发现在糖尿病肾病早期肾小球和高糖培养的系膜细胞中,p38MAPK 蛋白表达增加,磷酸化后活性增强[15]。一项研究发现[16]STZ 诱导的糖尿病大鼠肾小球p38MAPK 蛋白表达增加,磷酸化后活性增强,相应的转录因子CREB 活性增高和FN 蛋白表达增加。高浓度葡萄糖能够激活肾小球系膜细胞p38MAPK 和CREB,使其磷酸化水平明显增高,提示此信号途径可能参与了糖尿病肾病的发病过程[17]。在高糖培养的系膜细胞中,磷酸化p38MAPK 和磷酸化CREB 表达增加,FN表达增多,抑制p38MAPK后相应的CREB磷酸化水平降低,FN 表达减少,p38MAPK 信号通路介导了高糖诱导的细胞外基质成分——纤维连接蛋白的合成过程[18]。p38MAPK 与细胞外基质蛋白表达增强、细胞外基质进行性积聚等病理过程密切相关,p38MAPK 信号通路的激活在糖尿病肾病早期肥大和细胞外基质积聚的病变过程中发挥着重要的作用。一旦p38MAPK被激活将使其下游转录因子CREB 上的丝氨酸和苏氨酸残基发生磷酸化,CREB 磷酸化后进入胞核与cAMP 反应元件(CRE)结合,从而启动促纤维化细胞因子和细胞外基质蛋白相关基因表达[19]。在细胞外基质的重要成分FN 启动子-170bp 处含有1 个CRE,激活后的CREB 就能与该部位的CRE 结合、启动纤维连接蛋白mRNA 的表达[20,21]。阻断p38MAPK 的活性有助于阻断DKD 的发生和发展[22]。加味芪黄饮干预后发现加味芪黄饮能抑制p38MAPK 磷酸化水平,相应地CREB 磷酸化减少和FN蛋白表达明显减少,提示加味芪黄饮减少高糖培养的肾小球系膜细胞细胞外基质成分——纤维连接蛋白的作用与其降低p38MAPK 及其转录因子CREB 磷酸化水平从而抑制p38MAPK 信号通路激活密切相关。
综上所述,高糖能诱导大鼠肾小球p38MAPK 蛋白表达增加,磷酸化后活性增强,相应的转录因子CREB 活性增高和FN 蛋白表达增加;p38MAPK 特异性阻断剂SB203580 能抑制p38MAPK 磷酸化水平,相应地CREB 磷酸化减少和FN 蛋白表达明显减少;加味芪黄饮高剂量组对细胞外基质FN 的蛋白表达水平、p38MAPK、CREB 的磷酸化水平下调作用优于加味芪黄饮低剂量组;加味芪黄饮对p38MAPK、CREB 的磷酸化水平下调作用优于SB203580。加味芪黄饮可能是通过下调p38MAPK 信号通路的表达及减少细胞外基质成分FN 的积聚,产生相应的肾脏保护作用,从而达到对糖尿病肾病的治疗作用。
[1] Soldatos M,Cooper E. Diabetic nephropathy: Important pathophysiologicchanisms[J]. Diabetes Research and Clinical Practice,2008,82(1):75-79.
[2] 饶家珍,俸维.加味芪黄饮治疗早期糖尿病肾病视黄醇结合蛋白的临床研究[D].广州中医药大学,2011,08-17.
[3] 饶家珍,刘利.加味芪黄饮对早期糖尿病肾病血清胱抑素影响的临床研究[D].广州中医药大学,2011,08-17.
[4] ParkHK,AhnCW,LeeGT,et a.l Polymorph ism of aldose reduc-tase gene and d iabet ic m icrovascu lar comp licat ions in type 2 diabetesmellitus[ J ].D iab etes Res Clin P rac,t 2002,55(2):151-157.
[5] 李青,孙林,等.现代肾脏病治疗学[M].南昌:江西科学技术出版社,2000,378-380.
[6] 张浩军,赵静波,李平.糖尿病肾病动物模型研究进展[J].中国药理学通报,2008,27(7):845-8.
[7] 余敏,周宏灏,刘昭前.糖尿病肾病相关基因研究进展[J].中国药理学通报,2008,24(11):1419-22.
[8] 袁亮,吴永贵,郝丽,等.白芍总苷对糖尿病大鼠肾脏保护作用及部分机制[J].中国药理学通报,2007,23(6):821-6.
[9] 许艳芳,吴异兰,万建新,等.BMP-27 对TGF-β1 诱导人肾小管上皮细胞外基质表达的影响[J].中国药理学通报,2008,24(11):1453-7.
[10] Ayo S H,Radnik R A,Garoni J A,et al.High glucose causes an increase in extracellular matrix proteins in cultured mesangial cells[J].Am J Pathol,1990,136(6):1339-48.
[11] 周书琴,闻萍,高雯,等.重组人红细胞生成素影响系膜细胞生长与纤维连接蛋白表达的实验研究[J].中国药理学通报,2009,25(1):60–4
[12] 王全胜,张丽晓,刘建国,等.血竭素高氯酸盐对早期糖尿病肾病肾脏损伤防治作用的研究[J].中国药理学通报,2008,24(10):1331-4.
[13] Shanmugam N,Reddy MA,Guha M High glucose- induced expression of proinflammatory cytokine and chemokine genes in monocytic cells[J].Diabetes,2003,52(5):1256-1264.
[14] Tomlinson D R Mitogen-activated protein kinase as glucose trans-dcers for diabetic comp lications [J].D- iabetologia,1999,42(11) : 1271 - 81.
[15] KangM J,Wu X,Ly H,et al.Effect of glucose on stress-activa-ted protein kinase activity in mesangial cells and diabetic glomeruli[J].Kidney Int,1999,55(6): 2203-14.。
[16] Wang J,Huang H,Liu P,et al.Inhibition of phosphorylation of p38 MAPK involved in the protection of nephropathy by emodin in diabetic rats[J].Eur J Pharm acol,,2006,553(1-3):297-303.
[17] 王丽晖,吴广礼,张丽霞,等.氟伐他汀对高糖培养的大鼠肾小球系膜细胞外基质p38MAPK 表达的影响[J].药学学报,2009,44(2):121-125.
[18] 覃肇源,刘慰华,黄河清.黄连素对高糖培养的大鼠肾小球系膜细胞FN 及p38MAPK 信号通路的影响[J].中国药理学通报,2009,25(9)1201-1204.
[19] Singh L P,Andy J,Anyamale V,etal.Hexosamine-induced fibronectin protein synthesis in mesangial cell is associated with in-crease in cAMP responsive clement binding(CREB)phosphoryla-tion and nuclear CREB[J].D iabetes,2001,50(10):2355-2362.
[20] Bowlus C L,McQuillan J J,Dean D C.Characterization of three different elements in the 5’-flanking region of the fibronectin gene which mediate a transcrip tional response to cAMP [J].J B iol Chem ,1991,266(2): 1122-1127.
[21] Nahman S N J r,Rothe K L,Falkenhain M E,et al.Angiotensin induction of fibronectin synthesis in cultured human mesangial cells: Association with CREB transcription factor activation[J].J Lab Clin M ed,1996,127(6):599–611.
[22] 金洁娜,郑景晨,倪连松,等.阻断p38 MAPK 信号通路对高糖培养大鼠肾小球系膜细胞增殖和氧化应激的影响[J].浙江医学,2007,29(6):545-547.

