远航对舰艇人员脂质过氧化水平的影响
袁 媛,邱 霞
机体脂质过氧化水平与身体健康状况相关。舰艇人员远航时训练强度和生活环境与平时有很大不同,了解舰艇人员在远航前后抗氧化能力的变化,对保障舰艇人员远航时的身体健康有重要意义。本次研究采集远航前后舰艇人员的血样,并在体外条件下加入氧化剂和抗氧化剂的方法,对其脂质过氧化水平进行了研究。
1 对象与方法
1.1 测试对象
选择某部远航舰艇人员80人,均为男性,年龄20~35岁,身体健康,排除心脏病、肝炎、糖尿病等疾病,对本次实验均知情同意,受试人员在实验期间正常工作和生活。
1.2 测试指标与方法
每人于远航前1 d和远航归来后次日清晨抽空腹静脉血4 ml,肝素抗凝后检测。
1.2.1 血浆谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、丙二醛(MDA)测定 取血浆,分别用南京建成生物工程研究所提供的GSH-Px、SOD和MDA测试盒检测。
1.2.2 淋巴细胞增殖活性(MTT法)测定 取外周血淋巴细胞,制成细胞浓度为1×106/ml的悬液接种于96孔板,每孔100 μl,分为不加入H2O2的对照组、加入H2O2(终浓度为100 mmol/L)的 H2O2组、加入H2O2(终浓度为100 mmol/L)后再加入维生素 C(VC,终浓度为50 mg/L)的VC+H2O2组3种处理,各设3个平行孔。置37℃,5%CO2培养箱内培养24 h,用酶标仪测定细胞光吸收(OD)值。各组淋巴细胞增殖活性用平均OD值表示。
1.3 统计学处理
2 结果
2.1 远航前后GSH-Px、SOD和MDA测定结果
远航后舰艇人员GSH-Px和SOD值较远航前降低,MDA含量升高,差异均有统计学意义(P<0.05),见表1。
表1 舰艇人员远航前后GSH-Px、SOD和MDA测定结果

表1 舰艇人员远航前后GSH-Px、SOD和MDA测定结果
注:与远航前比较aP<0.05
2.2 淋巴细胞增殖活性
远航前后舰艇人员淋巴细胞增殖活性差异无统计学意义(P>0.05),加入H2O2诱导氧化损伤后差异有统计学意义(P<0.05)。各处理方法的OD值见表2。
表2 远航前后淋巴细胞增殖活性OD值
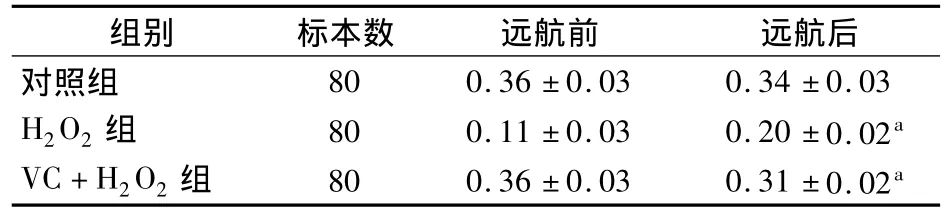
表2 远航前后淋巴细胞增殖活性OD值
注:与远航前比较aP<0.05
3 讨论
活性氧自由基产生于有机体的需氧代谢,生理条件下,在抗氧化酶和抗氧化剂的协同作用下可使自由基维持在低水平。当其生成超出机体的清除和修复能力时,血浆含有的高浓度活性氧簇可直接氧化、攻击和破坏抗氧化酶,使酶的活性降低或丧失;氧自由基攻击生物膜中的多不饱和脂肪酸,发生脂质过氧化反应,形成脂质过氧化终产物[1],引起氧化损伤,导致机体组织的损伤和器官的病变。
GSH-Px是一种重要的过氧化物分解酶,能催化两分子还原型谷胱甘肽(GSH)变为一分子氧化型谷胱甘肽,使有毒的过氧化物还原成无毒的羟基化合物,同时促进H2O2的分解,避免细胞受到过氧化损伤,并防止过氧化物水解产生有害物质MDA。SOD是有效清除超氧化物阴离子自由基的一类重要的抗氧化酶,可催化超氧阴离子(O2-)歧化为 H2O∶和O2,再经过氧化氢酶的催化生成水,从而消除自由基的损害[2]。GSH-Px和SOD可协同防止氧自由基的堆积[3]。MDA是脂质过氧化反应链式终止阶段产生的小分子产物,脂过氧化物形成环状内过氧化物可断裂形成烯醛丙二醛[4]。本研究发现,远航训练后舰艇人员的GSH-Px和SOD值较远航前降低,MDA含量则升高,其原因可能由于舰艇人员远航时处于摇摆、振动、噪声、电离辐射和密闭空间等特殊的工作生活环境,其饮食与战备值勤任务也与陆地不同,导致消除体内自由基的酶的抗氧化酶活力降低,而增加脂质过氧化产物的产生,最终使舰艇人员的脂质过氧化水平较远航前增高。
淋巴细胞增殖活性水平是反映细胞生命力强弱的一个重要指标,当细胞受到氧化损伤时,首先表现出增殖活性的降低。VC是细胞外液的主要抗氧化剂。人体内血浆遭受脂质过氧化损伤时,它构成第一道抗氧化防线。许多研究结果显示补充VC具有明显的抗脂质过氧化作用[5]。本次体外实验结果显示,远航前后舰艇人员淋巴细胞增殖活性无明显差异,而加入H2O2诱导氧化损伤后测定的远航后舰艇人员的淋巴细胞增殖活性低于远航前,说明远航增强了舰艇人员脂质过氧化水平,使机体抵抗外界氧化损伤的能力降低。加入VC使淋巴细胞增殖活性增加,说明VC对H2O2诱导的氧化损伤有一定的保护作用。
本结果提示,远航训练后舰艇人员的脂质过氧化水平增强,机体抗氧化力下降。体外实验证明抗氧化营养素(VC)可提高抗氧化水平,但是否需要服用抗氧化制剂以提高远航舰艇人员的抗脂质过氧化水平,还需进一步探讨。
[1]Marian V,Dieter L.Free radicals and antioxidants in normal physiological functions and human disease[J].Inter J Biochem Cell Biol,2007,39(1):44-84.
[2]李英哲,黄连珍,周丽玲.维生素A缺乏对大鼠脂质过氧化和抗氧化系统的影响[J].营养学报,2001,23(1):1.
[3]李忠浩,孔丽娟,杜庆华,等.不同温湿指数下荷斯坦奶牛外周血抗氧化指标的变化及其与淋巴细胞凋亡的关系[J].福建农林大学学报,2008,37(3):280-285.
[4]张春生,彭珊茁.抗氧化物质在辐射防护中的作用[J].中国工业医学杂志,2003,8(3):222-224.
[5]Devi SA,Vani R,Subramanyam MV,et al.Intermittent hypobaric hypoxia-induced oxidative stress in rat erythrocytes:protective effects of vitamin E,vitamin C,and camitine[J].Cell Biochem Funct,2007,25(2):221-231.

