不同植被恢复措施下剖面根系与SOC的分布特征
王彦丽
(内蒙古鄂尔多斯市环境保护中心监测站,内蒙古 鄂尔多斯017000)
水土流失伴随着SOC的流失[1],特别是在地形破碎、沟壑纵横的黄土高原地区,严重的土壤侵蚀导致该地区的SOC密度和储量均处于全国最低水平,甚至SOC含量与母质没有差异[2]。水土流失治理可显著提高SOC含量,据估计,全球水土流失治理的固碳潜力为1.47~3.04PgC/a[3]。植被恢复是治理水土流失的根本措施,一方面,植物根系通过对土壤的穿插、缠绕、网络以及固结作用,增加了土壤的抗蚀性、抗冲性以及固定作用[4-5];另一方面,植物根系主要通过影响有机物向土壤中的归还量[6-7]及其本身性质的差异[8]最终导致SOC的差异。根系作为联系生态系统地上过程和地下过程的枢纽[9],影响着土壤中养分向植物体的输送以及养分在土壤中的运移[10]。根系分布影响土壤剖面中碳的位置,而植被的地上地下部分的分配影响碳在剖面内的相对数量[11]。目前,大量的研究关注植被恢复措施(根系)在水土流失中的作用,但水土流失治理(植被恢复措施)后,根系生物量与SOC的剖面分布及二者的关系研究相对较少。
近年来,通过植被重建,治理水土流失、提高区域碳汇能力进而改善生态环境成为黄土高原地区生态环境建设的主要目标,但剖面内根系与SOC的分布特征以及二者的关系研究很少。因此,本研究基于黄土丘陵沟壑区典型小流域,在同一地形上(梁峁坡),选取不同的植被恢复措施,研究剖面内SOC与细根生物量的分布特征,以期为揭示根系对SOC影响的机理提供数据支持。
1 材料与方法
1.1 流域概况
燕沟流域(36°28′—36°32′N,109°20′—109°35′E)位于陕西省延安市宝塔区,主沟长8.6km,呈东南—西北流向,总面积约48km2,海拔986~1 425m,以梁峁地貌为主,沟壑密度为4.8km/km2,属于典型的黄土丘陵沟壑区。研究区为暖温带半湿润向半干旱过渡区,年平均气温9.8℃,多年平均降雨量约558 mm。土壤为半熟化状态的黄绵土(约占90%以上),肥力较低。治理前(1997年以前)流域水土流失面积42.55km2,占总面积的88.65%,土壤侵蚀模数为9 000t/(km2·a),属于强度水土流失地区[12]。
该区植被类型多样,属暖温带阔叶林向温带草原过渡地带。人工草被主要为紫花苜蓿(MedicagosativaL),分布较少;人工灌木林主要为柠条(Caraganakorshinskii)、沙棘(Hippophaerhamnoides)、杠柳(PeriplocasepiumBge);人工乔木主要为刺槐(Robiniapseudoacacia)、山杨(Pobulusdavidiana)、油松(Pinustabulaeformis)、仁用杏(Prnuusarmeniacsibirica)、侧柏(Biotaorientalis)。天然草被主要为铁杆 蒿 (Artemisiagmelinii)、长 芒 草 (Stipa bungeana)、白羊草(Bothriochloaischaemum)、狗尾草(SetariaviridisL.)、黄蒿(Artemisiascoparia);天然灌木林主要为黄刺玫(Rosaxanthina)、狼牙刺(S.viciifdia)、虎榛子 (OstryopsisDavidianaDcne)、灰栒子(CotoneasteracutifoliusTurcz)、北京丁香(SyringapekinensisRupr);天然乔木林主要为辽东 栎 (Queccusliaotungensis)、白 桦 (Betula platyphylla)、天然小乔木鼠李(Rhamnusdavurica)。其中,灌木林分布最广。
1997年以来,在流域南部、中部、北部配置了不同的水土流失治理措施,南部主要以涵养水源的天然次生林为主,中部以人工水土保持植被为主,北部以农田和经济林为主。
1.2 试验设计与样品采集
于2009年6月植被生长旺盛期进行野外样品的采集,采样深度定为1m,共采集了10个植被群落(表1),包括草本、灌木和乔木,分析其剖面内根系生物量(细根)和SOC的差异。为排除其他立地因子的干扰,所选样地都在峁坡上,并保证其他环境因子基本一致。采样时利用GPS进行定位,并记录每个样点的海拔、经纬度、地形地貌、植被特征、坡向、采样点重复次数、采样深度等信息。
每个样地的土壤样品各采3次重复,用直径为3 cm的土钻(根样采5次重复,用直径为9cm的根钻)从地表竖直向下分别采集0—10,10—20,20—40,40—60,60—80,80—100cm土层的样品。土壤样品用自封袋收集,根样用塑料袋收集,所有样品带回室内进行分析。

表1 燕沟流域样地信息
1.3 室内分析
新鲜土样混合均匀后置于阴凉处自然风干,风干样磨细过0.25mm筛,测定SOC(H2SO4—K2Cr2O7外加热法)[13]含量。挑出土壤中的所有根系,按处理和重复编号后放于塑封袋中,用水清洗干净后,按直径Φ≤2mm(细根)和Φ>2mm(粗根)分为两级。将直径小于2mm的根系用小纸袋装好置于鼓风干燥箱中70~80℃烘干至恒重,再分别称重和记录。
1.4 数据处理与统计分析
利用Excel软件进行数据的预处理;使用统计软件SAS进行方差分析(Proc GLM程序包),当F检验显著时再进行各样地均值间的比较(Duncan法),用软件Sigmaplot 10.0作图。
2 结果与分析
2.1 不同治理措施下SOC和根系的分布
表2显示了不同植被治理措施下SOC和细根密度的变化状况。在0—100cm剖面内,不同治理措施下的SOC呈现出灌木>乔木>灌草>草本的趋势(p<0.05)。以草本治理措施为对照,在0—10cm土层,灌 木 (12.13g/kg)、乔 木 (14.01g/kg)、灌 草(10.54g/kg)治理措施的SOC分别是草本治理措施(9.08g/kg)的1.34,1.56,1.16倍;在10—20cm土层,灌木(9.50g/kg)、乔木(8.30g/kg)、灌草(8.53 g/kg)治理措施的SOC分别是草本治理措施(7.57 g/kg)的1.26,1.10,1.13倍;在20—100cm土层,灌木(4.01~6.78g/kg)、乔木(3.76~6.43g/kg)、灌草(3.13~6.92g/kg)治理措施的SOC分别是草本治理措施(2.15~2.97g/kg)的1.56~2.28,1.47~2.16,1.45~2.33倍。
在0—100cm剖面内,不同治理措施下的细根密度呈现出乔木>灌木>灌草>草本的趋势(p<0.05)。以草本治理措施为对照,在0—10cm土层,灌木 (1.78mg/cm3)、乔 木 (1.92mg/cm3)、灌 草(1.03mg/cm3)治理措施的细根密度分别是草本治理措施(1.30mg/cm3)的1.37,1.48,0.79倍;在10—20 cm土层,灌木(1.57mg/cm3)、乔木(1.95mg/cm3)、灌草(1.06mg/cm3)治理措施的细根密度分别是草本治理措施(0.33mg/cm3)的4.76,5.91,3.21倍;在20—100cm土层,灌木(0.18~1.08mg/cm3)、乔木(0.33~0.89mg/cm3)、灌草(0.16~0.57mg/cm3)治理措施的细根密度分别是草本治理措施(0.04~0.17mg/cm3)的1.96~7.09,4.00~8.13,1.45~5.00倍。
2.2 不同治理措施下SOC和根系的垂直分异
表2给出了不同治理措施下植被群落的SOC和细根密度在1m土层范围内的垂直分布情况。SOC和细根生物量都随土层深度的增加呈对数递减趋势(图1),但同一土层SOC和细根生物量的分布不一致。

图1 SOC和根系密度与土层深度的关系
在剖面内,以40—100cm土层的SOC和细根生物量为对照,在0—10cm土层,灌木、乔木、灌草和草本治理措施的SOC和细根生物量分别为底层(40—100cm)的2.69倍和2.00倍、3.40倍和1.55倍、2.72倍和1.50倍以及3.59倍和5.91倍;在10—20 cm土层,灌木、乔木、灌草和草本治理措施的SOC和细根生物量分别为底层(40—100cm)的2.11倍和1.76倍、2.02倍和1.58倍、2.20倍和1.55倍以及2.99倍和1.50倍;在20—40cm土层,灌木、乔木、灌草和草本治理措施的SOC和细根生物量分别为底层(40—100cm)的1.50倍和1.21倍、1.56倍和0.72倍、1.78倍和0.82倍以及1.17倍和0.77倍。
在0—10cm土层,灌木、乔木、灌草和草本治理措施的SOC和细根生物量分别占整个剖面的29%和33%,34%和32%,28%和31%以及38%和64%;在10—20cm土层,灌木、乔木、灌草和草本治理措施的SOC和细根生物量分别占整个剖面的23%和30%,20%和33%,23%和32%以及28%和16%;在20—40cm土层,灌木、乔木、灌草和草本治理措施的SOC和细根生物量分别占整个剖面的16%和20%,16%和15%,18%和17%以及11%和8%;但在40—100 cm土层,灌木、乔木、灌草和草本治理措施的SOC和细根生物量分别占整个剖面的32%和17%,30%和21%,31%和21%以及28%和11%。
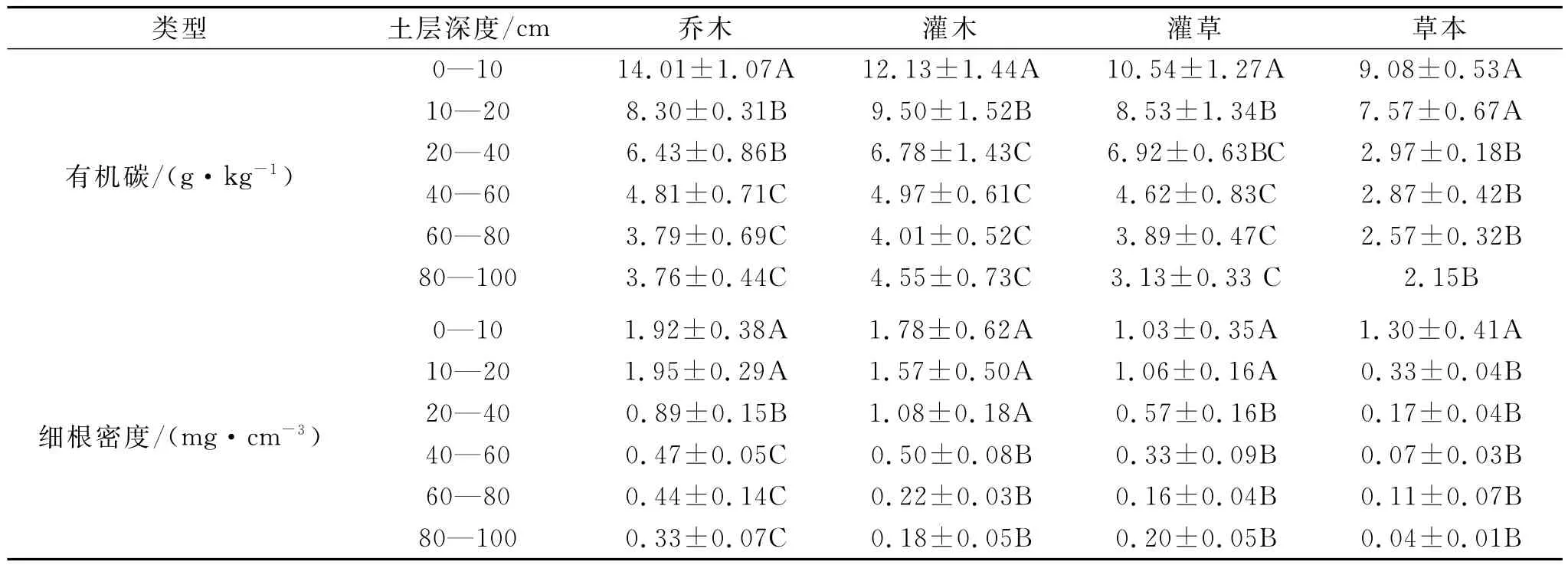
表2 不同土层有机碳和根系的差异
3 讨 论
3.1 根系生物量对土壤有机碳的影响
植被根系一方面能减少水土流失[14-15],另一方面显著地影响土壤中有机碳的累积,根系对SOC的影响主要表现在:不同植被治理措施归还到土壤中的根系生物量不同,在0—100cm剖面内,灌木、乔木以及灌草恢复措施的根系生物量分别是草本恢复措施根系生物量的4.3倍、5.2倍以及3.1倍(表2),这与已有的研究结果类似[6-7];不同根系的生物化学性状不同,从而使得有机物的分解速率不同[16-17]。例如,林草地根系的降解性要难于农田,因为凋落物分解的难易程度与自身的C∶N呈反相关[16];地下根系的生化特征会因植被类型的改变而发生显著的变化,例如,玉米根系中的纤维素和木质数含量分别为49%和12%,黑麦草中则分别为30%和9%[17]。根系分泌物和细根的周转是SOC的主要来源[16,18],但不是唯一的来源,同时土壤中的有机碳的累积还受其他环境因素和生物因素的制约,这可以从根系生物量与SOC的对数关系得到验证(图2)[19],即随着根系密度的增加土壤有机碳呈对数增加趋势,但不同植被恢复措施的增加程度不同,且呈现出乔木措施(单位根系密度的转化系数为4.38)>灌草措施(单位根系密度的转化系数3.91)>灌木措施(单位根系密度的转化系数为2.87)>草本措施(单位根系密度的转化系数2.33)的趋势。随着根系输入到土壤中的有机物质增加,SOC不断积累,越利于植被的生长,从而能更有效地减少水土流失和改善生态环境,特别在水土流失严重和生态环境恶化的黄土高原地区显得尤为重要。
3.2 土壤有机碳和根系的垂直分异
根系作为SOC的主要来源[18],其在剖面的分布及数量决定着SOC的分布以及数量,但根系生物量不是决定SOC分布以及数量的唯一因素,因而研究发现SOC和根系在剖面的分布并不一致(表1),例如,Weaver等[20]发现,在0—15cm的土层中有机质含量占整个剖面(0—100cm)的40%,但相应土层中的根系生物量却占整个剖面生物量的70%;同时Gill[21]研究也发现,在0—100cm 的剖面中,根系生物量的75%处于0—15cm处,而相应的有机质却只占23%;尽管根系与SOC在剖面的分布并不一致,但王一冬[19]在我国内蒙古地区研究得出,在0—300cm的土壤剖面中,根系生物量密度与SOC含量呈正的线性相关(R2=0.62),但与SIC呈负的指数相关;但也有学者研究得出土壤有机碳在剖面内的分布不仅决定着根系的分布[20],植被类型的自身性质或者降水也可以决定其分布[19]。已有的研究表明植被的根系分布比土壤有机碳的分布浅[13]。
无论是SOC还是根系生物量,均呈现出上层(0—20cm)大于下层(20—100cm)的趋势,这与许多研究者得出的结论一致[22],这可能与剖面内微生物的分布、数量、结构有关,还有可能与剖面内土壤中的养分状况以及水分可利用性密切相关,但具体原因有待进一步研究。

图2 SOC和根系密度的关系
根系生物量和SOC在不同植被治理措施下呈现出明显差异,无论是根系生物量还是SOC均呈现出表层大于深层的趋势,且均随土层深度的增加呈对数递减趋势;SOC和根系在剖面的分布不一致,并且根系比SOC的分布浅,但二者呈对数增加趋势。
[1] 毕银丽,王百群.黄土丘陵区坝地系统土壤养分特征及其及侵蚀环境的关系:Ⅰ.坝地土壤的理化性状及其数值分析[J].土壤侵蚀与水土保持学报,1997,3(3):1-9.
[2] 杨文治,余存祖.黄土高原区域治理与评价[J].北京:科学出版社,1992.
[3] Lal R.Global soil erosion by water and carbon dynamics[M]∥Lal R,Klmbkle J,Levine E.Soil and Global Change.Boca Raton F L:Lewis Publishers,1995.
[4] 毛瑢,孟广涛,周跃.植物根系对土壤侵蚀控制机理的研究[J].水土保持研究,2006,13(2):241-243.
[5] 李鹏,李占斌,郑良勇.植被保持水土有效性研究进展[J].水土保持研究,2002,9(1):76-80.
[6] French N R,Steinhorst R K,Swift D M.Grassland biomass trophic pyramids[J].Perspectives in Grassland Ecology,Ecol.,Studies,1979,32:59-87.
[7] 沈善敏.无机氮对土壤氮矿化与固定的影响:兼论土壤氮的“激发效应”[J].土壤学报,1986,23(1):10-16.
[8] Rovira P,Vallejo V R.Labile and recalcitrant pools of carbon and nitrogen in organic matter decomposing at different depths in soil:An acid hydrolysis approach[J].Geoderma,2002,107(1):109-141.
[9] Trumbore S E,Gaudinski J B.The secret lives of roots[J].Science,2003,302(5649):1344-1345.
[10] 韩凤朋,郑纪勇,张兴昌.黄土退耕坡地植物根系分布特征及其对土壤养分的影响[J].农业工程学报,2009,25(2):50-55.
[11] Davidson E A,Savage K,Bostad P,et al.Belowground carbon allocation in forests estimated from litterfall and IRGA-based soil respiration measurements[J].Agricultural and Forest Meteorology,2002,113:39-51.
[12] Schenk H J,Jackson R B.Rooting depths,lateral root spreads and below-ground/above-ground allometries of plants in water-limited ecosystems[J].Journal of Ecology,2002,90(3):480-494.
[13] Jobbagy E G,Jackson R B.The vertical distribution of soil organic carbon and its relation to climate and vegetation[J].Ecological Applications,2000,10(2):423-436.
[14] 胡海波,魏勇,仇才楼.苏北沿海防护林土壤可蚀性的研究[J].水土保持研究,2001,8(1):150-154.
[15] 杨永红,刘淑珍,王成华,等.含根量与土壤抗剪强度增加值关系的试验研究[J].水土保持研究,2007,14(3):287-289.
[16] Szanser M,Ilieva-Makulec K,Kajak A,et al.Impact of litter species diversity on decomposition processes and communities of soil organisms[J].Soil Biology &Biochemistry,2011,43(1):9-19.
[17] Fernandez I,Mahieu N,Cadisch G.Carbon isotopic fractionation during decomposition of plant materials of different quality[J].Global Biogeochemical Cycles,2003,17(3):1-9.
[18] Matamala R,Gonzàlez-Meler M A,Jastrow J D,et al.Impacts of fine root turnover on forest NPP and soil C sequestration potential[J].Science,2003,302(5649):1385-1387.
[19] Wang Y G,Li Y,Ye X H,et al.Profile storage of organic/inorganic carbon in soil:From forest to desert[J].Science of the Total Environment,2010,408(8):1925-1931.
[20] Weaver J E,Hougen V H,Weldon M D.Relation of root distribution to organic matter in prairie soil[J].Botanical Gazette,1934,96(3):389-420.
[21] Gill R,Burke I C,Milchunas D G,et al.Relationship between root biomass and soil organic matter pools in the shortgrass steppe of eastern Colorado[J].Ecosystems,1999,2(3):226-236.
[22] 赵忠,李鹏.渭北黄土高原主要造林树种根系分布特征及抗旱性研究[J].水土保持学报,2002,16(1):96-99.
——工程地质勘察中,一种做交叉剖面的新方法

