化学链高温空分制氧性能评价
赵亚仙 向文国 陈时熠
(东南大学能源与环境学院,南京 210096)
氧气是世界第二大化学品,氧气的全球需求量在逐年增长.目前空分制氧主要有深冷法、膜分离法和变压吸附法3种方式.深冷法是当前唯一大规模商业运行的制氧方法,该法历史悠久,技术成熟,产物含氧量可达99%以上,但操作繁琐,控制严格,维修复杂[1].变压吸附制氧法具有基建投资小、水电消耗少、经营成本低、安全性能好、操作维修简单、启动供氧快、自动化程度高、用工少等优点;缺点是不能制得纯氧,目前还没有特大型制氧装置的实例[1].膜分离法具有设备紧凑、流程简单、无运转部件和投资费用较低的优点,但只适用于小规模制氧,产物含氧量较低,而且有对膜性能依赖强、膜易于损坏、原料气净化要求高等缺点[2].
Moghtaderi[3]已对基于水蒸气的化学链高温空分制氧性能进行了研究,结果表明,将Mn3O4-Mn2O3和CoO-Co3O4以质量比为1∶1混合作为载氧体时制氧性能较好,制氧能耗为0.031 kW·h/kg,约为传统低温空分制氧能耗的11%.梅道峰等[4]对Cu/Co/Mn基载氧体释氧动力学及机理研究表明,Mn基载体的释氧反应最容易发生,铜基载氧体最难释氧,而钴基载氧体释氧难易适中.本文对Co/Mn基为载氧体的化学链高温空分制氧进行了研究,并对其作出评价.
1 化学链高温空分制氧原理及热力学分析
1.1 化学链高温空分制氧原理
化学链空分制氧(chemical looping air separation,CLAS)原理如图 1 所示.以 MexOy/MexOy-2载氧体为例,在高温条件下,氧化反应器中,由于氧分压较高,空气可将 MexOy-2氧化为 MexOy,即
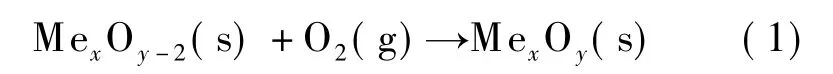
在分解反应器中,由于氧分压较低,水蒸气气氛下,MexOy可分解为MexOy-2,并释放出氧分子,即
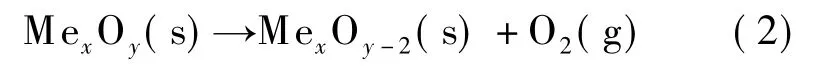
反应结束冷凝后即为纯氧.
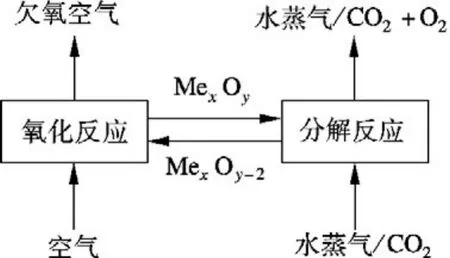
图1 化学链制氧流程图
氧化反应(1)是放热反应,分解反应(2)是吸热反应,理论上通过载氧体的一次循环,总反应热为零,实现了将空气中的氧转移到水蒸气中.理论上,CLAS过程没有能量消耗,热/电能耗可能会低于低温深冷分离系统的能耗,因而具有低能耗空气制氧的潜力.
1.2 热力学分析
吉布斯自由能定义为
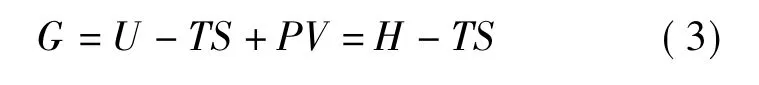
式中,U为系统的内能;T为温度;S为熵;P为压强;V为体积;H为焓.
对于一个独立的反应体系,其Gibbs自由能可以根据以下通式计算:

式中,∑(niΔGi,f)pro为产物生成的 Gibbs自由能总和;∑(niΔGi,f)rea为反应物生成的 Gibbs自由能总和.
对于分解反应(2),载氧体的分解条件为吉布斯自由能增量ΔGr≤0,即由反应条件(如温度、压力、氧分压等)决定,吉布斯自由能最小时所对应的氧分压叫做平衡氧分压.在一定的压力下,平衡氧分压与温度之间存在热力学平衡线,即对应某一温度,当氧分压低于平衡氧分压时,分解反应(2)趋于发生;当氧分压高于平衡氧分压时,氧化反应(1)趋于发生.本文仅对2种金属载氧体(Mn3O4-Mn2O3和CoO-Co3O4)下的化学链制氧系统进行研究,得到图2所示的平衡氧分压与温度的关系.
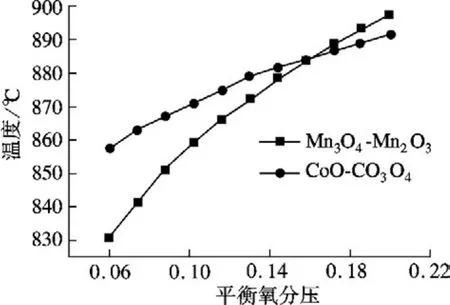
图2 2种载氧体下平衡氧分压与温度关系
2 制氧能耗定义

式中,W为压缩机功耗,kW;Q为热耗,kW;η为热电效率,取值为 0.38;m 为制氧量,kg/h.
制氧能耗用E表示,定义为
3 化学链制氧流程及分析
3.1 工艺流程
3.1.1 流程描述
图3为制取纯氧的流程图.凝结水和补充水经预热、气化、过热后,进入分解反应器,促进载氧体的分解释氧,载氧体分解为低价态载氧体,氧气和水蒸气混合物经余热利用、冷凝为纯氧;新鲜空气通过空气预热器利用来自氧化反应器欠氧空气中的热量,预热后进入氧化反应器,将低价态载氧体氧化再生.来自分解反应器的氧气和水蒸气混合物经二级蒸发器后增压,提高水蒸气分压.水蒸气对应的冷凝温度提高,促进水蒸气在一级蒸发器中与入口冷水之间的换热过程,回收水蒸气在冷凝时释放的汽化潜热.在冷凝器中水蒸气冷凝为液态水,氧气与液态水分离,获得纯净的氧气.液态水通过水预热器、一级蒸发器、二级蒸发器和过热器与氧气和水蒸气混合气体发生换热,再由加热器补充加热至分解反应温度,进入分解反应器参与反应.
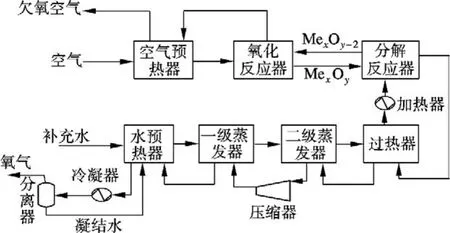
图3 制取纯氧流程
设定空气预热器欠氧空气出口温度为50℃,空气进口温度为25℃,补充冷水进口温度为50℃,冷凝器温度为50℃.根据各载氧体平衡氧分压与温度的关系,得到载氧体为Mn3O4-Mn2O3和CoO-Co3O4时对应的氧化反应温度变化范围均为850~890℃.氧化反应器和分解反应器的压力为101.3 kPa.选择氧化铝作为惰性载体,氧化铝不参与化学反应,氧化铝一方面作为载氧体的载体保证载氧体的机械性能,另一方面可作为热载体将氧化反应器释放的热量以固体显热的形式带入分解(释氧)反应器.
3.1.2 结果分析与讨论
图4为基于平衡氧分压,产生每克氧气所需的水流量和空气流量.
由图4(a)可知,2种载氧体的水蒸气流量都随着分解温度的升高而减少,氧气产物中含少量水蒸气,每一个循环都要补充一部分冷水.而水蒸气流量越小意味着系统对水的加热量要求越小,对应能耗也越小.由图4(b)可知,2种载氧体的空气流量都随着氧化温度的升高而增大,由于空气的热值不大,所以流量的增加对能耗影响相对不是很大.
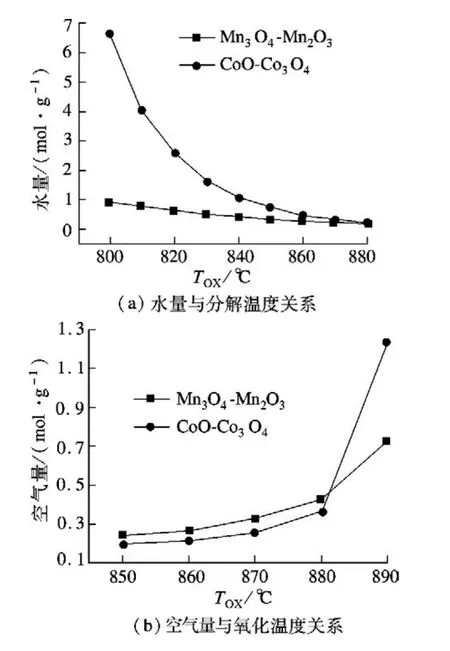
图4 载氧体基于氧分压所需水量和空气量与温度关系

图5 制取纯氧的能耗E与氧化分解反应温度的关系
氧化反应温度恒定时,分解反应温度升高,空气量不变,水量减小,制氧能耗减小.从图5可看出,在载氧体为Mn3O4-Mn2O3时,制氧能耗值均随分解反应温度(TDEC)增加呈下降趋势,对于某一氧化反应温度(TOX),当分解反应温度与其相差10℃时,制氧能耗较小,此时将氧化分解反应温度同时同幅度升高,水量减小,空气量增加,由于空气量的增加相比于压缩功而言对能耗影响较小,故总能耗减小.在载氧体为CoO-Co3O4时,当氧化反应温度达到890℃时空气量的增幅较大,导致对应能耗增加.所以载氧体为Mn3O4-Mn2O3时,制氧能耗随氧化分解反应温度的升高而减小(见图5(a)),载氧体为CoO-Co3O4时的制氧能耗随氧化分解反应温度升高而呈先减小后增大的趋势(见图5(b)).
载氧体为Mn3O4-Mn2O3、氧化反应温度和分解反应温度分别为890和880℃时,制氧能耗达最低值0.353 kW·h/kg.由图6可见,该工况下进水侧与氧气和蒸汽混合物侧的换热过程可分为4个阶段:0-1段为过热器段,分解反应器出口的氧气和蒸汽混合气体冷却至c点(214.3℃),进水侧饱和蒸汽(100℃)加热至过热状态(851.5℃);1-2段为二级蒸发器段,饱和蒸汽被加热,氧气和蒸汽混合气体冷凝至a点(102℃);2-3段为一级蒸发器段,进水侧饱和蒸汽被加热,氧气和蒸汽混合气体经压缩机增压至b点(188.3℃)后继续放热冷凝至d点(102℃);3-4段为水预热器段,进水侧冷水预热至97℃,氧气和蒸汽混合气体冷凝至96℃.

图6 进水侧与氧气和蒸汽混合物侧的换热过程
载氧体为CoO-Co3O4、氧化反应温度和分解反应温度分别为880和870℃时,制氧能耗达最低值0.402 kW·h/kg.由上可知,2种载氧体中,载氧体Mn3O4-Mn2O3制取纯氧性能较好.
化学链高温空分制氧能耗与传统制氧能耗经验数据0.246 kW·h/kg[5]相比,不具有明显优势,但是,通过将化学链高温空分制取纯氧与煤气化过程集成[6-7],即可取代传统低温空分制氧单元,可实现能量的梯级利用,具有一定的节能潜力,但有待进一步研究.
3.2 制取O2和CO2混合气体
3.2.1 流程描述
制取O2和CO2混合气体的流程如图7所示.载氧体为 Mn3O4-Mn2O3和 CoO-Co3O4,反应条件和参数设定与制取纯氧相同.
3.2.2 结果分析与讨论
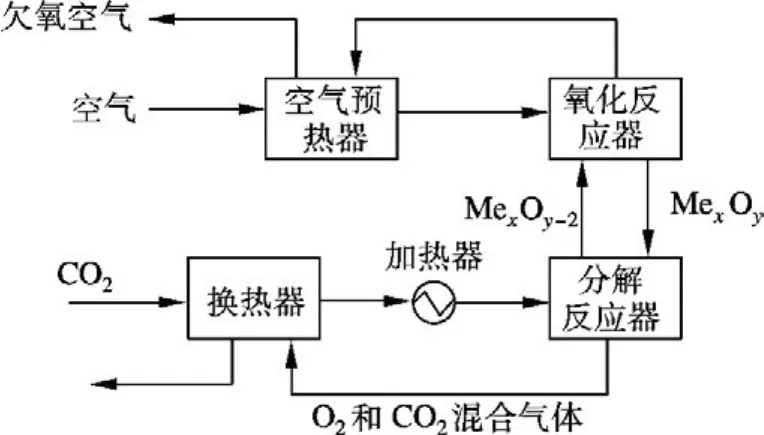
图7 制取氧气和CO2混合气体的流程图
在载氧体为Mn3O4-Mn2O3和CoO-Co3O4时,CO2量与相应的制取纯氧时水量相同,空气量与相应的制取纯氧时空气量相同.
与制取纯氧相比,由于CO2换热过程中无相变,制取氧气和CO2混合气体的过程中无压缩功耗,即W=0,因此制氧能耗主要是加热反应所需空气和CO2的热耗.图8是2种载氧体下制氧能耗随氧化反应温度、分解反应温度变化的趋势图.2种载氧体下,氧化反应温度恒定时,分解反应温度增加,空气量不变,CO2量减小,制氧能耗减小.从图8可看出,制氧能耗值均随分解反应温度增加呈下降趋势.故对于某一氧化反应温度,当分解反应温度与其相差10℃时,制氧能耗较小.此时将氧化分解反应温度同时同幅度升高,CO2量减小,且热耗减小幅度降低,对应热耗减小且减小幅度降低;而空气量增加,且增加幅度升高,对应热耗增加且增加幅度升高.综合两者关系可得,制氧热耗随着氧化分解反应温度的升高而升高.产物中氧气含量(体积分数)如表1所示.
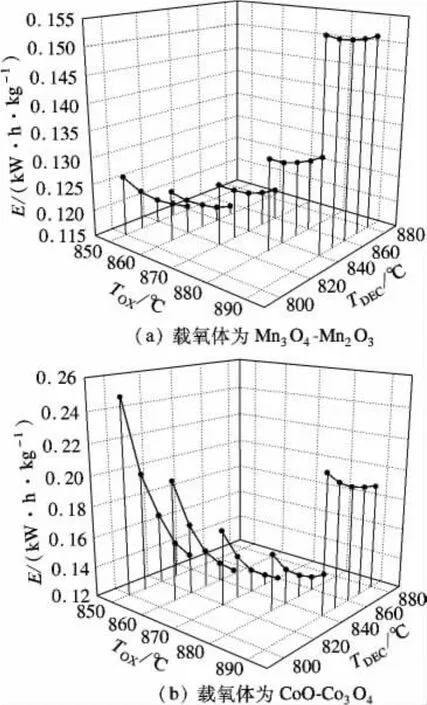
图8 制取O2和CO2的能耗E与TOX,TDEC的关系
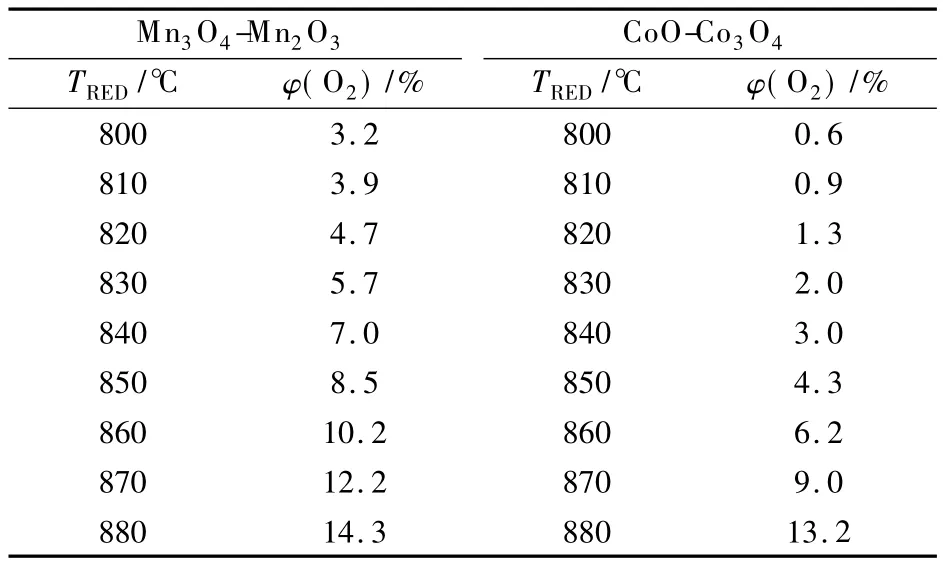
表1 2种载氧体下产气中氧气含量
载氧体为Mn3O4-Mn2O3、氧化反应温度和分解反应温度分别为890和880℃时,制氧能耗为0.151 kW·h/kg,氧气含量为 14.3%.载氧体为CoO-Co3O4、氧化反应温度和分解反应温度分别为890和880℃时,制氧能耗为0.19 kW·h/kg,氧气含量为 13.2%.由此可以得出,载氧体为Mn3O4-Mn2O3时制取的O2和CO2混合气体性能较好.
化学链高温空分制氧能耗与传统制氧能耗经验数据0.246 kW·h/kg相比,具有潜在的应用前景;通过将化学链高温空分制取O2和CO2混合气体与O2/CO2循环燃烧集成[8-10],取代传统低温空分制氧单元,可降低制氧能耗,提高系统效率.
4 结语
化学链高温空分制氧方法制取纯氧,载氧体为Mn3O4-Mn2O3时制取纯氧的性能较好,能耗为0.353 kW·h/kg;与传统制氧能耗经验数据0.246 kW·h/kg相比,化学链高温空分制氧能耗并不具有明显优势;因而可考虑与煤气化过程集成,取代原有的低温空分制氧单元.
化学链高温空分制氧方法制取O2和CO2混合气体,在载氧体为Mn3O4-Mn2O3时制取的O2和CO2混合气体性能较好,能耗为0.151 kW·h/kg,氧气含量14.3%;与传统制氧能耗经验数据0.246 kW·h/kg相比,化学链高温空分制氧能耗具有潜在应用前景,因而可考虑与O2/CO2循环燃烧集成[8-10],以取代原有的低温空分制氧单元.
References)
[1]刘汉钊,王华金,杨书春.变压吸附制氧法与深冷法的比较[J].冶金动力,2003,20(2):26-29.Liu Hanzhao,Wang Huajin,Yang Shuchun.A comparison between the transformation adsorption oxygen making method and the deep cooling method[J].Metallurgical Power,2003,20(2):26-29.(in Chinese)
[2]黄美荣,李新贵,董志清.大规模法空气分离技术应用进展[J].现代化工,2002,22(9):10-15.Huang Meirong,Li Xingui,Dong Zhiqing.Application of large-scale air separation by membranes[J].Modern Chemical Industry,2002,22(9):10-15.(in Chinese)
[3]Moghtaderi B.Application of chemical looping concept for air separation at high temperatures[J].Energy Fuels,2010,24(1):190-198.
[4]梅道峰,赵海波,马兆军.Cu/Co/Mn基氧载体释氧动力学及机理研究[J].燃料化学学报,2013,41(2):235-242.Mei Daofeng,Zhao Haibo,Ma Zhaojun.Oxygen release kinetics and mechanism study or Cu-,Co-,Mnbased oxygen carrier[J].Journal of Fuel Chemistry and Technology,2013,41(2):235-242.(in Chinese)
[5]王宝群.IGCC系统控制CO2的过程机理与一体化集成[D].北京:中国科学院工程热物理研究所,2004.
[6]Mattisson T,Lyngfelt A,Leion H.Chemical-looping with oxygen uncoupling for combustion of solid fuels[J].International Journal of Greenhouse Gas Control,2008,3(1):11-19.
[7]Adanez J,Abad A,Garcia-Labiano F,et al.Progress in chemical-looping combustion and reforming technologies[J].Progress in Energy and Combustion Science,2012,38(2):215-282.
[8]Figueroa J,Fout T,Plasynski S,et al.Advances in CO2capture technology—the U.S.department of energy's carbon sequestration program[J].International Journal of Greenhouse Gas Control,2008,2(1):9-20.
[9]Hossain M,de Lasa H.Chemical-looping combustion(CLC)for inherent CO2separations—a review[J].Chemical Engineering Science,2008,63(18):4433-4451.
[10]Li Zhenshan,Zhang Teng,Cai Ningsheng.Experimental study of O2-CO2production for the oxyfuel combustion using a Co-based oxygen carrier[J].Industrial &Engineering Chemistry Research,2008,47(19):7147-7153.

