碳纳米管修饰电极测定对乙酰氨基酚和抗坏血酸的研究
王月红,刘慧宏
(武汉纺织大学化学与化工学院,湖北 武汉 430073)
对乙酰氨基酚(paracetamol,PA) 是一种常见的乙酰苯胺类解热镇痛药。抗坏血酸(AA)能提高人体的免疫力,提高机体的应急能力。二者是常用感冒药的主要成分[1]。体内过量的PA 和AA 有一定的毒副作用,因此建立对PA 和AA 的灵敏检测方法是非常必要的。常用的分析方法主要有滴定法、分光光度法、化学发光法、液相色谱法、毛细管电泳法、电化学方法等,其中电化学方法具有操作简单,成本低廉,检测限低等优点[2~3]。
PA 和AA 在常用电极表面的氧化反应较慢,其氧化峰相互重叠,难以同时测定。而碳纳米管(CNT)具有优良的电催化性能,能加快PA 和AA 的氧化反应。本文报道用混酸处理过的碳纳米管修饰电极同时检测PA 和AA,结果满意。
1 实验部分
1.1 仪器与试剂
仪器:CH660A 电化学工作站,DELTA 320PH酸度计,KQ2200 超声波清洗器,电子分析天平,781型磁力加热搅拌器。
试剂:多壁碳纳米管(MWCNT,SWNT 经化学气相沉积法制备,外径<2nm,纯度>95%),使用前用混酸处理[4]。对乙酰氨基酚和抗坏血酸,用时现配制溶液。其它试剂均为分析纯。各种pH 值的磷酸盐缓冲溶液(PBS)由0.05mol·L-1KH2PO4和0.05mol·L-1Na2HPO4配制而成。样品为维生素C 片、复方氨酚烷胺片和维C 银翘片,按《中华人民共和国药典》(2010年版)方法配制溶液。
1.2 碳纳米管修饰电极的制备
玻碳电极(GCE,φ=4mm)用6#砂纸细磨后,再用0.05μM 粒度的α-Al2O3悬浊液在人造毛上抛光,洗去表面的污物,并在水中超声清洗3 次,每次2~3min,再用移液枪取5μL 的多壁碳纳米管溶液均匀涂布在新处理的玻碳电极表面,空气干燥约2~3h。制备好的修饰电极可以用SWCNT/GC 表示。
1.3 电化学测量
电化学测试为三电极系统:GCE 或MWCNT/GCE 为工作电极,饱和甘汞电极为参比电极,铂电极为辅助电极。取5mL pH=7.0 的PBS 缓冲溶液于电解池中,将处理好的电极放入,连接好各电极。在-0.2~0.7V 电位范围内扫描,待循环伏安(CV)曲线稳定,加入适量的抗坏血酸和对乙酰氨基酚,记录循环伏安(CV)曲线,线性扫描伏安(LSV)曲线及电流-时间(I-t)曲线。
2 结果与讨论
2.1 PA 和AA 的电化学性质
图1 是0.1mol·L-1PBS 缓冲溶液(pH=7)为支持电解质,PA 和AA 混合溶液在GCE(a)和MWCNT/GCE(b)上的循环伏安图,扫描速度为20mV·s-1。从图中可以看出,PA 和AA 在GCE 上的氧化电位分别为EPA=0.415V 和EAA=0.121V。由于AA 和PA 在GCE 上的反应速度均较慢,所以两者的氧化峰难以分开。而在MWCNT/GCE 上的氧化电位分别为EPA=0.303V 和EAA=-0.041V。由于MWCNT 的催化作用,AA 的氧化电位负移了0.126V,电流增大了4 倍。PA 的氧化电位负移了0.113V,电流增大了3 倍。PA与AA 氧化峰电位差为344mV,循环伏安图显示出2个明显独立的氧化峰。
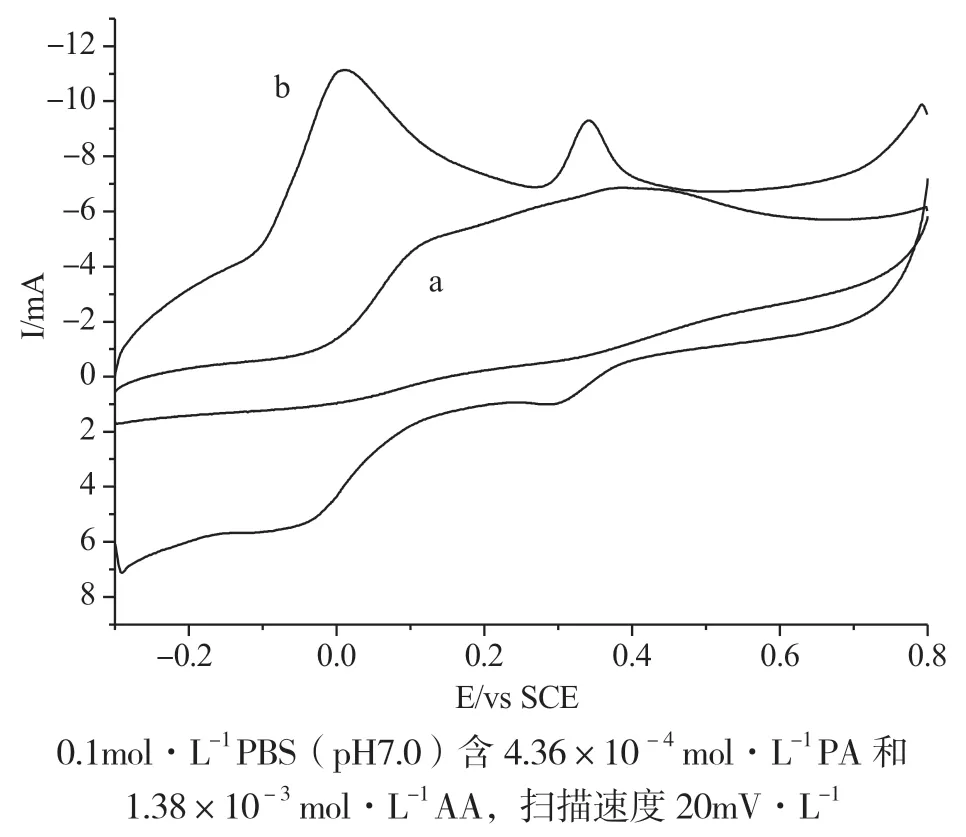
图1 PA 和AA 在GCE(a)和MWCNT/GCE(b)上的循环伏安图
在扫描速度0.01~0.1V·s-1范围内,PA 和AA的电流均与扫描速度的平方根呈线性关系,线性回归方程分别为IPA/μA=-0.90+0.46υ1/2(R2=0.9929,n=10)和IAA/μA=3.17+0.40υ1/2(R2=0.9938,n=10),说明PA 和AA 的电化学反应受扩散控制。而在GCE 上,随着电极扫描次数的增加,PA 和AA 的氧化峰电流会逐渐降低,说明PA 和AA 吸附在电极表面,从而阻碍PA 和AA 在电极表面的电化学反应。功能化后的MWCNT 表面有含氧基团,由于静电作用,能有效地防止PA 和AA 吸附在电极表面。
PA 和AA 的氧化还原反应伴随着质子转移,因此溶液的pH 值会影响氧化峰电位与电流。在pH 3.0~9.0 范围内,随着溶液pH 的逐渐增大,电位发生负移,且与pH 的改变呈线性变化,回归线性方程分别 为:EPA/V=0.77-0.056 pH(R2=0.9968,n=7) 和EAA/V=0.28-0.048 pH (R2=0.9937,n=7)。线性方程斜率的绝对值分别56mV/pH 和48mV/pH,表明参与该过程的质子转移数与电子转移数相等,这与文献报道的电极反应机理相符[5]。
2.2 PA 和AA 的测定
2.2.1 线性扫描伏安法同时测定PA 和AA
图2 是在 pH=7.0 的磷酸盐缓冲液中,PA和AA 在MWCNT/GCE 上的线性扫描的伏安图。随着PA 和AA 的浓度增加,电流线性增加。PA 浓 度 在2.48×10-5~1.31 ×10-4mol·L-1范围内,氧化峰电流与浓度呈良好的线性关系,线性 回 归 方 程 为:I/μA=1.53+0.51C (μmol·L-1),R2=0.9963,检出限为1.01×10-6mol·L-1。AA 浓 度在8.48×10-4~6.45×10-3mol·L-1范围内,氧化峰电流与浓度呈良好的线性关系,线性回归方程为:I/μA=1.12+0.34 C (μmol·L-1),R2=0.9902,检 出 限为2.46×10-5mol·L-1。
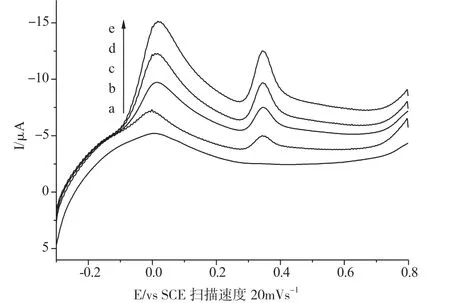
图2 测定PA 和AA 的线性扫描伏安曲线
2.2.2 恒电位计时电流法(I-t 曲线)
线性扫描伏安法测定PA 和AA 时,电流受极限扩散的影响。采用恒电位计时电流法,在磁力搅拌作用下,溶液对流,可以降低检测下限。图3 是分别测定PA 和AA 时记录的I-t 曲线。测定PA 时,电位控制在+0.35V,测定AA 时,电位为0V。随着PA 和AA的逐渐增加,电流也均匀增加,并且呈阶梯状。PA 的氧化峰电流与其浓度在 4.35×10-7~2.12×10-6mol·L-1范围内呈良好的线性关系,线性回归方程为:Ipa/μA=-0.42 +2.16 C (μmol·L-1),R2=0.9994,检 出 限为1.22×10-7mol·L-1。AA 的氧化峰电流与其浓度在2.53×10-6~1.37×10-5mol·L-1范 围 内 呈 良 好 的线性关系,线性回归方程为:Ipa/μA=1.01 +0.60C(μmol·L-1),R2=0.9966,检出限为6.76×10-5mol·L-1。
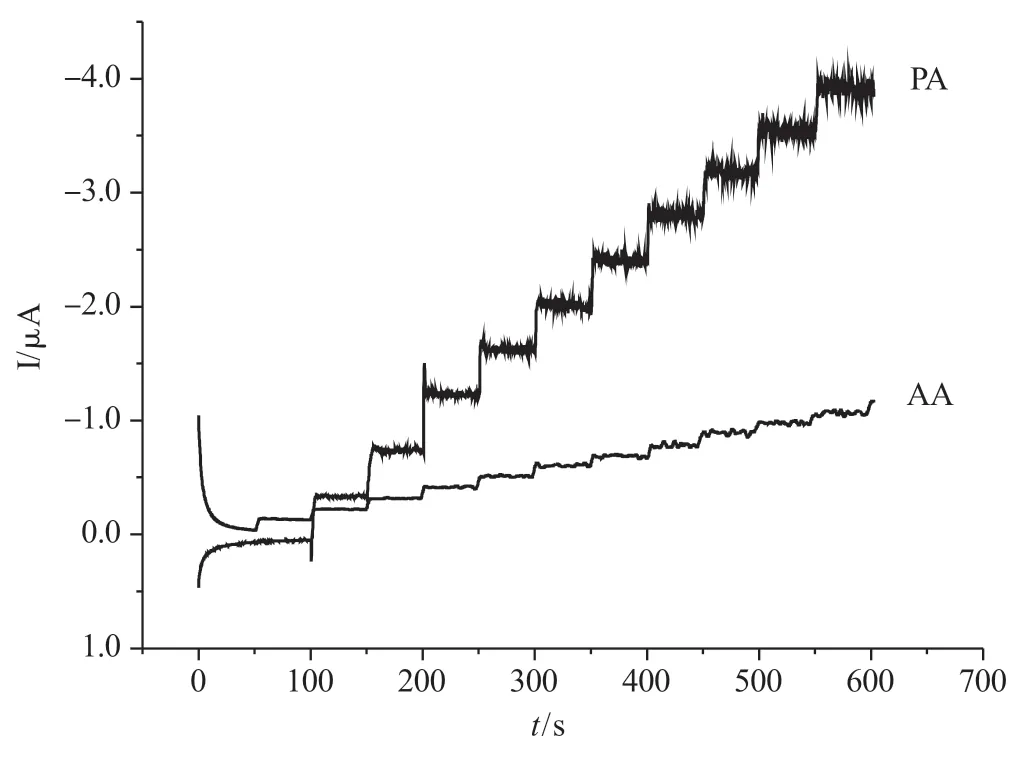
图3 测定PA 和AA 的I-t 曲线
2.3 样品测定及回收率
按实验步骤对样品进行了5 次平行测定,并进行了加标回收率的测定,结果见表1。
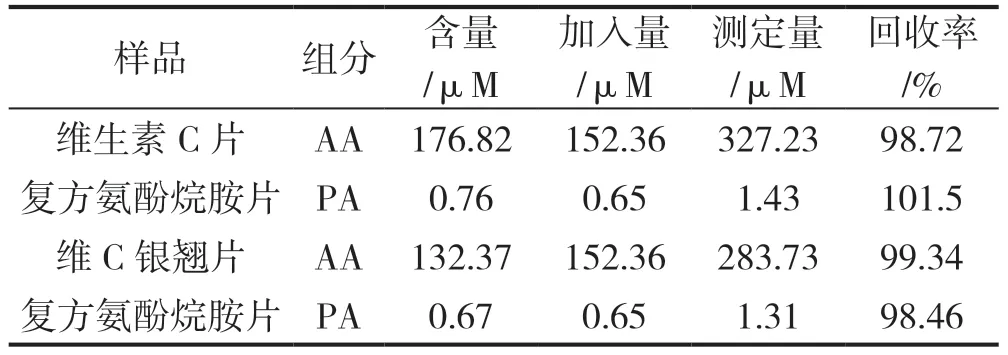
表1 样品测定及回收率结果
3 结论
本文的研究结果表明,碳纳米管修饰电极对PA和AA 具有较高的催化效率,PA 和AA 的氧化速度大幅度提高,氧化峰电位也负移达100mV 以上,PA和AA 氧化峰具有较大的电位差,能够同时测定PA和AA。该电极具有较高的灵敏度和选择性及较低的检测限,应用于药品的测定,结果满意。
[1]Dalmasso P.R.,Pedano M.L.,Rivas G.A.Electrochemical determination of ascorbic acid and paracetamol in pharmaceutical formulations using a glassy carbon electrode modified with multi-wall carbon nanotubes dispersed in polyhistidine[J].Sensors and Actuators B,2012(173):732-736.
[2]Havensa N.,Trihna P.,Kimb D.et al.Redox polymer covalently modified multiwalled carbon nanotube based sensors for sensitive acetaminophen and ascorbic acid detection [J].Electrochim.Acta.,2010(55):2186-2190.
[3]Radovan C.,Cofan C.,Cinghita D.Simultaneous Determination of Acetaminophen and Ascorbic Acid at an Unmodified Boron-Doped Diamond Electrode by Differential Pulse Voltammetry in Buffered Media[J].Electroanalysis,2008(20):1346-1353.
[4]Yang D.,Liu H.Poly(brilliant cresyl blue)-carbonnanotube modified electrodes for determination of NADH and fabrication of ethanol dehydrogenase-based biosensor[J].Biosen.Bioelectron.,2009(25):733-738.
[5]Pournaghi-Azar M.H.,Kheradmandi S.,Saadatirad A.Simultaneous voltammetry of paracetamol,ascorbic acid,and codeine on a palladium-plated aluminum electrode:oxidation pathway and kinetics[J].J.Soli.State Electrochem,2010,(14):1689-1695.

