高纯氢氧化镁非均相合成与表征
王景峰,周莹莹,胡 宏,张 勇
(1.瓮福(集团)有限责任公司,贵州 福泉 550501;2.武汉工程大学材料科学与工程学院,武汉 湖北 430073)
氢氧化镁是一种重要的化工产品,广泛用于聚合物的绿色阻燃、中和废酸废液、烟气脱硫、制药等领域[1~2]。氢氧化镁作为阻燃、抑烟、无毒、热稳定性高的无机阻燃剂正日益引起关注,尤其适合与加工温度较高的聚合物配合使用,制备各种阻燃型复合材料。阻燃型氢氧化镁要求颗粒均匀、形貌规则、分散性好[3~5]。沉淀法具有生产工艺简单、生产成本低、易于大规模化生产等特点而备受研究者的重视。沉淀法是向含Mg2+的溶液中加入碱性沉淀剂(或沉淀剂前驱物),使Mg2+以氢氧化镁的形式沉淀析出。目前,常用的氢氧化镁阻燃剂的生产方法有氨法、氢氧化钠法、石灰乳法和氧化镁水化法等[6],但是这些工艺存在过滤困难,工艺复杂,可控性差,能耗大等特点,一些科研人员对以上方法进行了改进[7~13],取得了一定的研究成果。老工艺导致氢氧化镁价格较高,且在阻燃剂市场所占有市场份额很少,因此一种经济且工艺简单的合成方法为市场所期待。
有鉴于此,本文提出一种新的氢氧化镁非均相合成方法,利用二正丁胺沉淀镁离子制备了氢氧化镁,并对该方法的动力学和热力学基础进行了研究。该方法与现有的沉淀法相比,加工路线短,能耗低,胺损小,可一步制备粒度小,纯度较高的片状氢氧化镁。目前,该合成方法还未见相关文献报道。
1 实验
1.1 实验药品
二正丁胺,六水硝酸镁(均为分析纯)。
1.2 实验过程
氢氧化镁合成实验:将六水硝酸镁配制为1mol·L-1的水溶液,向溶液中缓慢加入过量10%的二正丁胺,搅拌均匀,在室温条件下反应0.5h 至pH值等于10,过滤、洗涤、干燥,得氢氧化镁粉体备用。
氢氧化镁合成热力学实验:向1mol·L-1硝酸镁溶液滴加不同量的二正丁胺,反应条件与氢氧化镁合成实验相同,过滤,测定滤液中镁离子的含量。
氢氧化镁合成动力学实验:将硝酸镁溶液配制为起始浓度1.65mol·L-1,下一个样品浓度为上一个样品浓度的一半,最后样品浓度为0.00625mol·L-1等一系列样品,分别放置于等直径的量筒中,然后向溶液中滴加1mL 的二正丁胺,静置记录油水界面产生沉淀的时间。
1.3 测试与表征
使用NETZSCH STA 409 PC/PG 型热分析仪,在静态空气中以20℃·min-1的升温速度,测定氢氧化镁热分析曲线。以KBr 压片法在NICOLETSXB型傅里叶变换仪上,于4000~300cm-1范围内测定氢氧化镁红外光谱图。使用XD-5AX 射线衍射仪测定氢氧化镁的晶体结构。使用JSM-5510LV 扫描电子显微镜记录氢氧化镁的SEM 图。
2 结果与讨论
2.1 氢氧化镁粉体的表征
图1 为氢氧化镁热分析曲线,曲线1 为热重曲线,曲线2 为热重微分曲线。从图上可以看到氢氧化镁开始分解温度为300.8℃,与文献报道一致,热重微分曲线显示分解过程为一步分解,显然为氢氧化镁的失水过程。如氢氧化镁固相中残留有硝酸镁或二正丁胺,在600℃条件下应完全分解,因此最后残留物应为氧化镁,根据失水反应:Mg(OH)2=MgO+H2O,理论热失重率为30.9%,而实际失重率为31.7%,可知氢氧化镁固相中有挥发性杂质,由残留的氧化镁可计算合成氢氧化镁平均分子量为59,可计算得氢氧化镁的纯度为99%。

图1 氢氧化镁热重曲线Fig.1 TG/DTA of Mg(OH)2
图2 为氢氧化镁红外光谱图,3701cm-1处的振动峰为游离OH-的伸缩振动峰,430 为Mg-O 的伸缩振动峰,图中并无CO32-、NO3-以及二正丁胺的特征振动峰,可见氢氧化镁固相中的挥发性杂质主要为游离水。

图2 氢氧化镁粉体红外光谱图Fig.2 IR spectra of Mg(OH)2
图3 为氢氧化镁的XRD 谱图,从图上可以看到粉体具有良好的结晶性,各衍射指标化数据如图所示,与PDF#44-182 所标记的氢氧化镁相态一致,为六方晶系,谱图中未见其他相态的衍射峰。

图3 氢氧化镁XRD谱图Fig.3 XRD of Mg(OH)2
2.2 氢氧化镁合成的热力学研究
二正丁胺的标准酸离解常数pKa=11.25,标准状态下水溶解度为0.031mol·L-1,在水溶液中存在如下电离平衡:

由此可计算二正丁胺饱和水溶液的近似pH 值为11.87。
在标准状态下,氢氧化镁的溶度积为pKsp=11.74,饱和氢氧化镁水溶液的近似pH 值为8.12,由此可见二正丁胺可以用于沉淀水溶液中的镁离子以制备氢氧化镁,如下式:

忽略水的电离平衡,考虑胺和氢氧化镁的电离平衡:

在合成氢氧化镁时,保持液面上有浮胺,则水溶液中胺为饱和状态,可得:
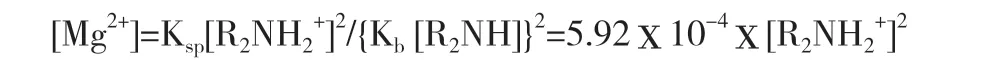
当[R2NH2+]=2mol·L-1时,即[Mg2+]初始浓度为1mol·L-1,反应完成后,[Mg2+]=5.92×10-4mol·L-1,镁沉淀效率接近100%,而胺理论最小用量与镁离子的摩尔比仅为2.031:1,此时溶液近似pH 值为9.74。与氨沉淀镁离子相比,胺的用量更小,沉淀效率更高。
图4 为100mL 的1mol·L-1硝酸镁溶液用二正丁胺沉淀,镁离子回收率与胺用量的关系曲线。从图上可以看出,当胺用量为理论用量105%时,溶液中镁离子已接近100%沉淀。
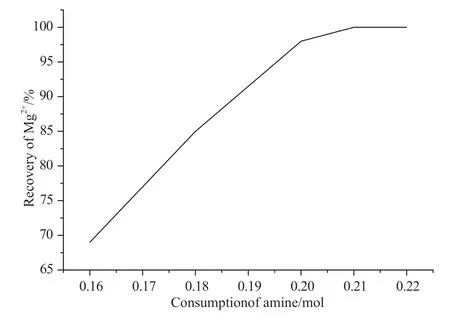
图4 镁离子回收率与胺用量的关系曲线Fig.4 the recovery of Mg2+ at different quantity amine
2.3 氢氧化镁合成的动力学研究
二正丁胺沉淀镁离子分为3个过程:胺溶解过程、胺电离过程及镁离子沉淀过程。显然后两个过程要比第一个过程快很多,氢氧化镁合成由胺溶解过程控制。假设胺溶解过程为一扩散过程,由于合成过程中胺与水都是大量的,并不形成油包水或水包油的结构,这一扩散过程可近似为平板扩散,根据菲克扩散定律:
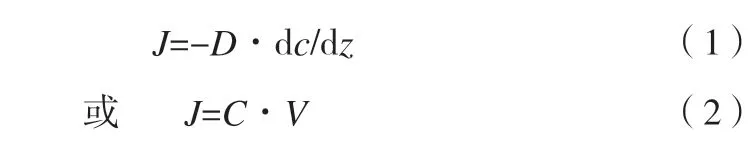
式中:D-扩散系数;
C-扩散界面附近胺的浓度;
Z-扩散距离;
V-扩散速率。
将(1)上下同除以dt,并假定扩散系数与扩散速率是恒定的(水溶液中Mg2+能迅速消耗OH-促进胺电离,在Mg2+未消耗完之前使水相中的[R2NH]非常小,所以假设是合理的),可得:

式中:t-时间;k-常数。
积分可得:

胺在扩散界面胺一侧的百分比浓度可近似为1,在水相一侧的浓度由镁离子控制,当水相中胺达到一定浓度C1时所需时间为:

使一定浓度镁离子发生沉淀的胺的浓度为C2:
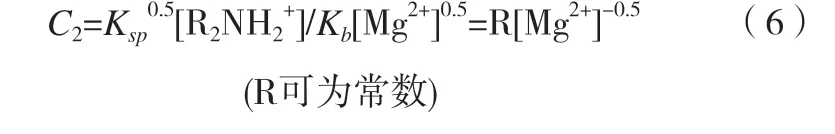
将(6)带入(5)可得出现氢氧化镁沉淀的时间:

则不同浓度的镁离子溶液出现沉淀的时间差与镁离子浓度的对数值成正比:
(t2-t1)/(t3-t2)=(ln[Mg2+]1-ln[Mg2+]2)/(ln[Mg2+]2-ln[Mg2+]3)
图5 为不同浓度硝酸镁溶液浓度与出现沉淀时间的关系曲线,1.65mol·L-1样品出现沉淀时间为5s,与下一个样品出现沉淀时间差为0。

图5 不同浓度硝酸镁溶液浓度与出现沉淀时间的关系曲线Fig.5 Effect of precipitation time and different concentrations ratios
从图5 可以看到,随着样品浓度的进一步降低,在高浓度阶段,2个样品出现沉淀的时间差Δt 与样品浓度Δln[Mg2+]之间呈现良好的线性关系,与动力学模型符合,可见这一阶段是由胺扩散控制,在低浓度阶段,使镁离子产生沉淀所需要的胺的量远大于高浓度所需胺量,此时[R2NH2+]不能作为常数处理,但过程控制仍为扩散控制。
2.4 氢氧化镁的粒度与形貌
图6 为氢氧化镁SEM 图片,从图上可以看到氢氧化镁为片状结晶,但晶体形状并不完整,片晶直径在0.2~1.8μm 之间,片与片之间团聚程度较高。显然用二正丁胺沉淀镁离子制备氢氧化镁,由于受胺的扩散控制,反应比直接用可溶性碱要慢很多,因此也给氢氧化镁晶体的生长提供了时间,从而使所合成的氢氧化镁能生长成片晶。

图6 氢氧化镁SEM 图Fig.6 SEM of Mg(OH)2
3 结论
本文使用二正丁胺法沉淀镁离子制备了高纯度氢氧化镁粉体,并对其进行了表征。热力学的研究表明,二正丁胺沉淀镁离子效率高,胺用量少,与现有的氨法相比具有明显的优势。动力学研究表明二正丁胺沉淀镁离子具有良好的可控制性,即使在高浓度镁离子溶液中,其出现沉淀时间可在5s 以内,从而保障了氢氧化镁晶体的生长时间,在保障过滤性能的前提下大大提高了生产效率。本文所合成的氢氧化镁具有纯度高、结晶度高、粒度小等优点,在温和条件下就可得到片状晶体,为氢氧化镁的合成提供了一种可行性高、工艺简单、条件温和的绿色化学方法。二正丁胺法制备高纯度氢氧化镁动力学过程有待进一步研究,为工业化设计提供基础。
[1]Booster J L,Sandwijk A v,Reuter M A.Miner.Eng.,2003(16):273.
[2]Richard H T,Witkowski A,Hollingbery L.Polymer Degradation and Stability.,2011,96(8):1462-1469.
[3]Hornsby P R.Int Mater Rev,2001(46):199.
[4]Ding Y S,Wang P,Wang Z l,et al.Polymer Engineering &Science,2011,51(8):1519-1524.
[5]Gul R,Islam A,Yasin T.Journal of Applied Polymer Science.,2011,121(5):2772-2777.
[6]胡庆福.镁化合物生产与应用[M].北京:化学工业出版社,2004.315-337.
[7]李歌,马鸿文,姜晓谦,等.白云石酸浸液氨化制备纳米氢氧化镁的实验研究[J].人工晶体学报,2011,40(2):510-516.
[8]陈建铭,张兆震,宋云华.水热反应条件对氢氧化镁晶体微观内应变的影响[J].人工晶体学报,2011,40(2):396-399.
[9]Fellner,P,Hives,J,Khandl,V,et al.Chemical Papers,2011,65(4):454-459.
[10]XU,Jianzhong,TANG,Tingting,Qu,Hongqiang.Advanced Materials Research,2011,194-196.
[12]ZHAO,J H,LAI Y P.Materials Science Forum,2011,675-677.
[13]Tan Junjun,Wang Jun,Wang Liya,et al.Journal of Colloid and Interface Science.,2011,359(1):155-162.
[17]CHEN Xue Gang,Lu Shuang Shuang,LI Xiu Ti.Journal of Inorganic Materials.,2011,26(2):214-218.

