基于超临界流体抗溶剂原理的造粒技术及其装置研究进展
康永强 ,陈爱政,2 ,王士斌,2,刘源岗,2
(1 华侨大学化工学院,福建 厦门 361021;2 华侨大学生物材料与组织工程研究所,福建 厦门 361021)
药物运输体系(drug delivery systems,DDS)可以实现药物的靶向和缓释功能,在人类疾病治疗方面具有非常重要的意义。近年来,药物运输体系得到了快速的发展,越来越多的学者致力于DDS的研究[1-2]。DDS的研究主要包括两个方面:第一,药物的微细化,获得粒径较小的颗粒,以提高其溶解度、生物利用度和生物分布等,达到提高治疗效果的目的;第二,将药物与聚合物载体结合,形成复合微粒,实现药物的靶向和缓控释功能[3]。聚合物载体可以防止不稳定药物过早地分解,协助药物到达病灶部位,同时扮演药物储库的角色[4],控制药物在较长的时间内稳定缓慢地释放。
在DDS的研究中,传统的制备方法有研磨法、喷雾干燥法、冷冻干燥法和乳化法等。这些方法存在有机溶剂残留多、颗粒的粒径分布不均、复合微粒载药量和包封率低以及温度高易使药物活性成分失活等问题,限制了其在药物运输体系中的应用。相比传统方法,超临界技术是一种新型且环保的造粒技术,具有巨大的优势,如操作条件温和、有机溶剂残留少、制得的微粒粒径和形态可控等[5-6],其中超临界二氧化碳(supercritical carbon dioxide,SCCO2)的临界点(Tc=304.1 K,Pc=7.38 MPa)容易实现,而成为超临界技术中最常用的流体介质。超临界造粒技术的出现,克服了传统造粒方法的缺点,为微粒的制备提供了一条新途径,也为超临界流体的应用开辟了一个新领域,逐步地被应用于微细化药物和制备载药微粒的研究当中。
超临界造粒技术中,最常用的有两种:超临界溶液快速膨胀法(rapid expansion of supercritical solution,RESS)和超临界抗溶剂法(supercritical antisolvent,SAS)。在RESS 中,超临界二氧化碳起溶剂的作用,其原理是超临界二氧化碳将溶质溶解,经喷嘴喷出快速膨胀,引起温度和压力的下降,二氧化碳对溶质的溶解能力急剧下降,导致溶质以细小颗粒的形式在常压釜或者能承受较低压力的收集器(压力可控)中沉析。但由于极性物质、大分子和大部分聚合物往往不溶于超临界二氧化碳中[7],大大地限制了RESS的应用范围,这使得更多的研究转向了SAS[8]。SAS 应用于微细微粒的制备,需要满足两个条件:第一,溶质微溶或不溶于超临界二氧化碳;第二,有机溶剂在超临界二氧化碳中的溶解度较大,能被超临界二氧化碳溶胀并萃取带走。1989年,Gallagher等[9]首次提出了利用气体抗溶剂技术制备微粒。经过几十年的发展,SAS 造粒技术的应用范围大大地增加。
许多学者在将SAS 应用于制备DDS 这方面进行了很多研究,不断在前人的基础上进行了改进和创新,让SAS 得以在制备超细颗粒和复合微粒中不断地发展和进步。本文作者对基于SAS 原理的造粒技术及其装置的研究进展进行综述,并对目前其存在的问题提出了可能的解决方案,最后对其未来发展方向进行了展望。
1 SAS 造粒技术
1.1 SAS 原理和装置组成
SAS 是基于超临界流体影响溶质在有机溶剂中的溶解度基础上发展起来的,其原理是将溶质溶于合适的有机溶剂中形成溶液,在与超临界流体接触时,发生快速的相互扩散和强烈的传质过程,溶剂被溶胀,密度下降,从而使得有机溶剂对溶质的溶解能力下降,产生较高的过饱和度,最终形成溶质微粒。SAS 装置主要是由输送溶液的高压泵、输送液体二氧化碳的隔膜高压泵、高压釜和调节气流的背压阀组成的。其中高压釜是超临界抗溶剂反应和微粒收集的装置,可根据实验的需要设置进气进液喷嘴、可视窗口、超声探头和搅拌[10]等部件,其中进气进液喷嘴可为分开式、双通道同轴式和多通道同轴式。
1.2 SAS 造粒装置概况
SAS 造粒技术是利用超临界流体为抗溶剂,制备药物颗粒、聚合物颗粒和载药聚合物微粒的一类技术的统称。随着SAS 应用的不断深入,越来越多不同的SAS 造粒装置涌现出来。其中气体抗溶剂法(gas antisolvent,GAS)和气凝胶溶剂萃取系统法(aerosol solvent extraction system,ASES)是SAS造粒装置最初的两种形式[11]。如图1所示,GAS 过程是首先将溶质溶于相应的溶剂中形成溶液,置于高压釜内,然后将超临界二氧化碳从底部注入高压釜内,这样可使溶剂和抗溶剂之间较好地混合,溶剂被溶胀,对溶质的溶解能力下降,导致溶质在溶液中达到过饱和析出。相比传统方法,该方法大大提高了结晶的纯度,但也存在问题:该过程为间歇式,生产能力不高,总产量低;产品、超临界流体和溶剂三者的分离需要引入其它操作单元,步骤繁琐。ASES 是一种改进的SAS 过程,结构如图2所示,是先将高压气体通入高压釜内,当釜内的温度和压力达到设定值后,溶液经喷嘴以液滴的形式喷入釜内,在超临界流体流动相中得到分散,溶剂被溶胀,对溶质的溶解能力下降,从而形成均匀的微粒。通过调节与高压釜相连的背压阀,可实现产品的分离,下游的降压罐可实现CO2气体和有机溶剂的分离。溶液喷射结束后,继续通入SCCO2以去除颗粒残留的有机溶剂。由于ASES 利用了小孔喷嘴加强分散溶液的特点,使得溶液在离开喷嘴后,与超临界流体接触前能够分散成微小的雾滴,从而形成微细颗粒。Bleich等[12]首次提出ASES 造粒技术,用4 种聚合物(PDLA、PLGA、PLA和PHB)测试该造粒技术的应用,所得到的颗粒粒径在1~10 μm,并将其应用于制备载药PLA 微粒[13]和脂质体微粒[14]。该造粒装置所制得的颗粒有机溶剂残留少,颗粒形态较好。因此对SAS 造粒技术及其装置进行改进,有利于解决SAS 中存在的问题和扩大其应用范围。目前的研究主要从技术发展、喷嘴改进、技术结合、产品收集等方面对SAS 造粒技术及其装置进行改进,成功研制出一系列新型的SAS 造粒技术及其装置。
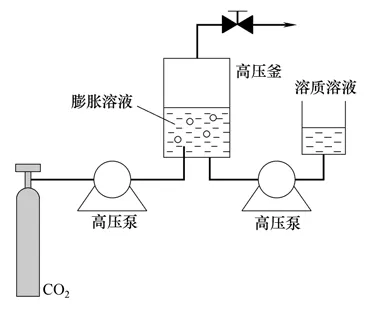
图1 GAS 装置示意图
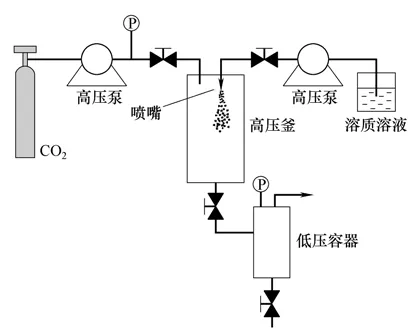
图2 ASES 装置示意图
2 SAS 造粒技术的改进及新型装置
2.1 技术的改进
2.1.1 非溶剂的使用
颗粒的粒径和粒径分布受到溶液浓度和其它工艺参数(温度、压力、溶液流速和CO2流速)的影响,其中溶液的浓度对颗粒粒径及其粒径分布具有显著的影响。已报道的大部分研究[15-18]表明,溶液浓度越高,得到的颗粒的平均粒径和粒径分布都将增大。该现象涉及造粒过程中成核和晶体生长二者谁占主导地位的问题:浓度低时,溶液较晚达到饱和,成核过程占主导地位,得到较小的颗粒;浓度高时,溶液较早达到饱和,晶体生长过程占主导地位,得到较大的颗粒。此外,高浓度的溶液具有较大的黏度和表面张力,会导致SAS 过程中较大液滴的形成,得到大粒径颗粒。但是也有研究[19-20]报道,高浓度的溶液,能得到较小的颗粒。对该现象的解释[20]为根据经典的结晶原理,溶液的过饱和程度影响颗粒的沉淀,高浓度溶液能较快地达到过饱和,从而具有较快的成核速率,产生小粒径颗粒。因此,溶液浓度对粒径和粒径分布的影响具有两面性,若在SAS 过程中使用低浓度、高过饱和度的溶液,理论上能得到粒径小且粒径分布窄的颗粒。基于以上假设,本文作者课题组将有机非溶剂应用于葛根素纳米粒的制备中[21-22],发现非溶剂/溶剂对颗粒的粒径和粒径分布具有显著影响,有机非溶剂的加入成功制得了粒径小、粒径分布窄、球形度较好的颗粒。
2.1.2 超临界流体强制分散悬浮液(suspensionenhanced dispersion by supercritical fluids,SpEDS)
将药物和聚合物溶解于一种有机溶剂或者混合溶剂中形成均匀的溶液,经过SAS 过程后,药物和聚合物一起析出形成微粒,此为共沉淀法。由于聚合物和药物之间的亲和性差会使聚合物与药物相分离,以及共沉淀法无法起到包埋的作用,部分药物会沉淀在颗粒表面,最终导致制得的微粒的包封率低,无缓释效果[23-24]。Wang等[25]提出了一种制备复合微粒的新方法,即包埋沉淀法,将作为核心的二氧化硅粒子和丙烯酸树脂的丙酮溶液混合,在超声下形成悬浮液。然后通过喷嘴喷入高压釜的SCCO2流体中,造成溶液过饱和,丙烯酸树脂在二氧化硅颗粒表面析出。此后,包埋法在诸多研究中得到应用:PLGA 包埋二氧化硅颗粒[26]、氧化铝包埋钛酸钡纳米粒[27]、PLGA 包埋氢化可的松微粒,成功制备了药物为核、聚合物为壳的复合微粒,具有较高的包封率和较好的缓释效果[28]。
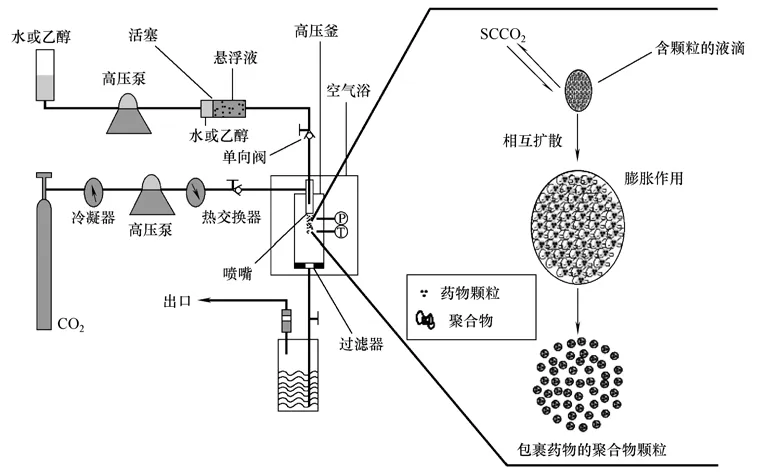
图3 SpEDS 装置示意图
超临界包埋沉淀法虽然应用广泛,但也存在问题:由于溶液中颗粒的存在,容易导致高压泵单向阀无法密封,损坏高压泵。针对上述问题,本文作者课题组改进并建立了SpEDS 技术[29-33],即在高效液相泵和喷嘴之间设置了一个工作原理类似注射器的不锈钢圆柱形活塞容器,用于颗粒悬浮液的运输。圆筒容器内的活塞将其分为两部分,高压液相泵把水或乙醇泵入圆柱形容器中并推动活塞,将颗粒悬浮液推送进入高压釜内,实验装置如图3所示。该悬浮液输送装置的引入很好地避免了颗粒对高压单向阀的损坏,也方便了溶液输送管道的清洗,较大限度地防止了批次间的溶液污染。此外,Toropainen等[34]利用三通管道改进SEDS 装置的进液方式,使得SCCO2首先与布地奈德溶液接触,随后再与环糊精溶液混合,从而制得了载布地奈德的环糊精微粒。该方法理论上可实现一步法制备核壳型复合微粒。
2.2 喷嘴的改进
2.2.1 双通道同轴喷嘴
为了加强超临界流体与溶液间的传质速率,从而得到粒径较小的粒子,Hanna等[35]首先提出了超临界流体强制分散溶液(solution-enhanced dispersion by supercritical fluids,SEDS)工艺。SEDS工艺装置的核心部分是一个特别设计的耐高压同轴喷嘴,如图4所示。这是一个具有双层同心结构的喷嘴,SCCO2和溶质的溶液流经不同的环隙而进入高压釜:内层为溶质溶液,外层为超临界二氧化碳。在SEDS 中,SCCO2扮演着抗溶剂和雾化强化剂两种角色。当溶质溶液和SCCO2从喷嘴喷出时,由于喷出速度的差异,导致溶质溶液被快速的SCCO2流体雾化成细小和均匀的液滴,这样既加强了溶液的雾化效果,也有利于溶质溶液与SCCO2之间的传质作用和速率。该装置所制得的颗粒粒径小,粒度分布窄,可实现颗粒粒径和粒径分布的可控,从而使得SEDS 被广泛地应用于医药领域中药物[36]、聚合物[37]及其复合微粒[38]的制备。
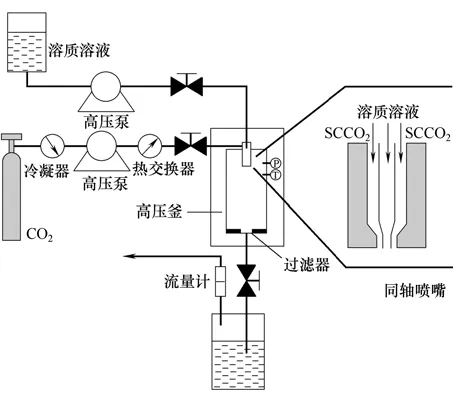
图4 SEDS 装置示意图
在SEDS 中同轴喷嘴改进的基础上,He等[39-40]提出了超临界流体强制分散预膜(solution-enhanced dispersion by supercritical fluids with prefilming atomizer,SEDS-PA)装置。该方法是将预膜双流体雾化器应用于超临界强制分散溶液法的双通道同轴喷嘴中制备麻黄素颗粒[39]和载类胡萝卜素的PEG微粒[40],其结构如图5所示。溶液在外层中经过螺旋槽,形成薄的漩涡液体膜,其所在的位置与雾化器的中心轴成45°。SCCO2通过内层毛细管进入喷嘴,形成高速的注射流,与45°的薄膜撞击,在其表面施加剪切力。因此,薄膜就被雾化成细小的液滴,提高了其与SCCO2的传质作用。SEDS-PA 虽然能制得小粒径的颗粒,但是所得到的颗粒球形度不够好。
2.2.2 三通道同轴喷嘴
由于超临界二氧化碳和水不相溶,因此传统的SAS 装置不适合于水溶性药物(如蛋白质和多肽类)载药体系的制备。在现有的用SAS 制备载水溶性药物微粒的研究方法中,水溶性药物和聚合物溶于同一溶液体系中,可能导致水溶性药物的失活。针对该问题,张严之等[41-42]从喷嘴改进的角度出发,在高压釜内设计了一个三通道同轴喷嘴,用于同时输送药物的水溶液,聚合物的有机溶液和改性后的SCCO2。改进后的三通道喷嘴如图6所示。该喷嘴克服了SCCO2和溶剂水不能共混的缺陷,且避免了活性物质与有机溶剂长时间直接接触而失活,从而可以制备水溶性药物缓释微粒。此外,在高压釜前加了一个混合容器,用于乙醇和CO2的预混合,从而对SCCO2进行改性。虽然利用该装置所制得包载吗啡的PLLA 微粒的包封率较低(1.83%±0.05%),但这已使SAS的应用范围不再局限于对脂溶性药物和聚合物的加工,具有较大的应用潜力。
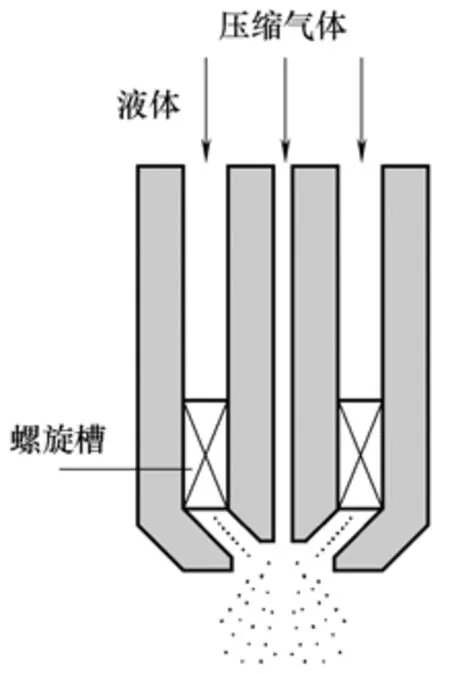
图5 预膜喷嘴示意图
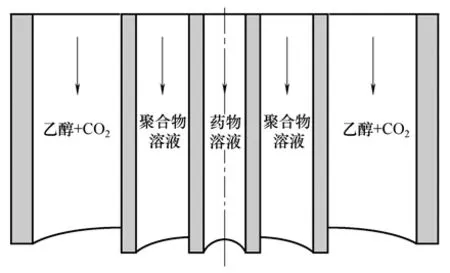
图6 三通道喷嘴示意图
2.2.3 组合喷嘴
李志义等[43]在高压釜内设计了内喷嘴和外喷嘴的组合,内喷嘴腔壁上设计有穿透性直喷孔,这样就能在内喷嘴的外表面和外喷嘴的内表面间形成一个超临界流体环形流道。该釜能将溶液在超临界流体中均匀分散成细小的液滴,从而制备粒径小且粒径分布窄的超细粉体。刘燕等[44]设计了一种超临界流体纳微米材料制备用组合喷嘴,是由端盖、内混盘、外混盘、喷口盘、结晶器和调节螺母等组成。该组合喷嘴是一种轴向组合型可调环隙的喷嘴,可以较好地解决目前超临界纳米材料制备用喷嘴中普遍存在的微孔难以加工,孔径不能够调节,喷嘴容易阻塞等问题。在SAS 装置以后的发展过程中,喷嘴的设计和改进依然相当重要,对喷嘴的研究和优化也将继续受到研究者的重视。
2.3 强化传质
在医药领域中,提高药物的生物利用度和疗效,除了使用聚合物载体外,另一种方法就是将药物微细化,因为药物的溶解能力和溶解速度与微粒的粒径大小和比表面积有关[45-46]。若要制得粒径更小、比表面积更大的颗粒,在SAS 过程中增强溶液的雾化效果是关键,所以往往与其它技术联用,因此这也成为研究者的研究热点和改进SAS 造粒技术装置的出发点之一。
2.3.1 强化传质超临界抗溶剂(supercritical antisolvent with enhanced mass transform,SAS-EM)
Chattopadhyay等[47]将超声波振动器应用于超临界抗溶剂过程,制备抗菌素纳米粒。其结构如图7所示。该实验装置中,H为带有直径为1.25 cm 尖端的钛角,用以提供雾化所需的超声区域和振动表面。溶液通过一个直径为75 μm的毛细管运送到超声振动器焊头尖端。通过压电式转换器改变电源功率来改变其振幅大小,从而加强SAS 过程中溶液与SCCO2之间的传质作用。实验过程中通过调节传感器的功率,可以控制纳米粒的粒径。该装置制得的四环素纳米粒粒径比传统的SAS 方法制得的颗粒小了8倍。而且,在有超声的条件下,四环素纳米粒的分子结构没有发生改变。应用该装置制备蛋白质颗粒,粒径也减小了近10倍[48]。
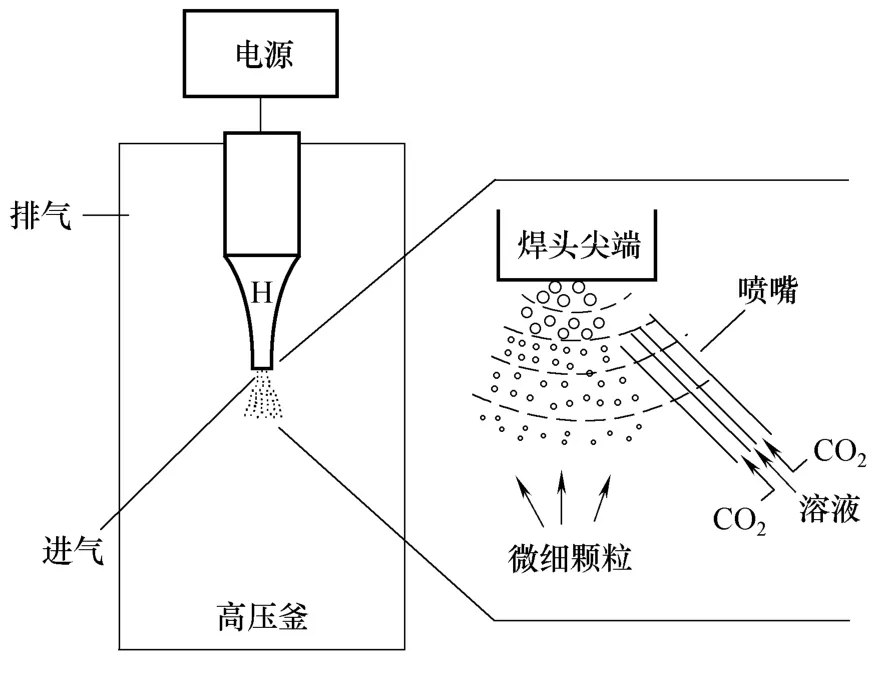
图7 SAS-EM(SEDS-EM)装置示意图
Jin等[49]在前人的基础上,将超声分散技术进一步应用到SEDS 中,提出了强化传质超临界强制分散法(solution-enhanced dispersion by supercritical fluids with enhanced mass transform,SEDS-EM)。实验装置如图7所示。该装置的原理与SAS-EM 类似,都是在高压釜内设计一个超声波发生器。当溶液与超临界二氧化碳通过同轴喷嘴进入高压釜时,溶液首先被SCCO2雾化分散成小液滴,随后在超声发生器焊头尖端被细化为更小的液滴,因此使得溶液小液滴更加充分地与SCCO2接触,促使纳米粒在高压釜中析出。该研究将SEDS、SEDS-EM和SAS-EM三个过程制备得到的颗粒粒径进行了比较:SEDS(2685 nm)>SAS-EM(565 nm)>SEDS-EM(110 nm)。这是因为在雾化溶液成细小的液滴时,超声波的作用比同轴喷嘴更加强烈[36,48]。
2.3.2 冲击射流超临界抗溶剂(supercritical antisolvent with impinging jets,SAS-IJ)
SAS 装置中,有机溶液和SCCO2的引入方式对微粒的形成有着重要的影响。SEDS、SAS-EM和SEDS-EM 都能一定程度上加强溶剂和SCCO2之间的传质作用,从而制得粒径更小的微粒。同样地,基于冲击射流技术的设备,也可以增强传质作用和控制微粒粒径。因此,Calvignac等[50]将冲击射流技术应用于SAS 装置中,以灰黄霉素为模型药物,制备其药物颗粒。其原理是将两个喷嘴相对,让两股气流之间发生冲击,从而加强气流之间的传质。SAS-IJ 装置如图8所示,该装置有3个管道(内直径为127 μm)分布于高压釜上,正中间的管道用于输送SCCO2,高压釜内相对摆设的两个管道(间距为8 mm)分别输送SCCO2和有机溶液。利用该装置分别制备L-PLA和灰黄霉素颗粒[51],并与其它SAS 造粒装置的结果进行对比。所制得的L-PLA 颗粒粒径(1.44~2.14 μm)与其它SAS 造粒装置相近,而制得的灰黄霉素颗粒粒径(26.1~50.9 μm)是GAS和ASES的一半,但大于SAS-EM(0.1~0.5 μm)。虽然如此,但SAS-IJ 装置相对其它装置而言,比较复杂,冲击射流过程的可重复性不高,而且该装置比SEDS 装置多了一个泵,耗能大。此外,颗粒可能会在冲击射流管壁上析出,不方便收集。
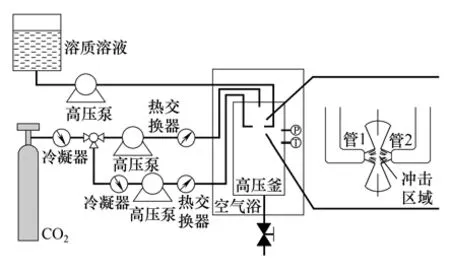
图8 SAS-IJ 装置示意图
2.4 其它改进
2.4.1 技术结合由于大部分聚合物在80℃以下不溶于超临界二氧化碳,因此使用RESS 制备聚合物纳米粒时存在困难[7,52],同时SAS 是一个间歇式过程,难以实现规模化。而对于在SCCO2中部分可溶的聚合物而言,SAS 制备聚合物颗粒产量低,甚至收集不到产品。基于以上分析和考虑,本文作者课题组提出了将SAS和RESS 过程结合起来,形成一个连续式的超临界溶液快速膨胀(a continuous RESS)过程[53-54]。实验装置如图9所示,实验选取PLA-PEGPLA为聚合物模型,以SEDS 作为基于超临界抗溶剂原理的具体造粒装置,在其下端安装一个常压容器作为RESS 发生装置。当PLA-PEG-PLA的浓度小时,在SEDS的高压釜中收集不到产品。提高PLA-PEG-PLA的浓度,可在高压釜底部收集到产量很低的聚合物膜,大部分聚合物颗粒出现在下端的常压容器中。针对SAS 制备在SCCO2部分可溶的药物颗粒时存在的问题,Tozuka等[55]将SEDS 与超临界溶液快速膨胀到液体溶液(rapid expansion from supercritical to aqueous solution,RESAS)[56]结合起来,制备消炎痛微粒,以另一种方式成功解决了消炎痛在SCCO2中部分可溶导致在一定条件下无颗粒产生的问题。目前SAS 造粒技术制得的微粒依然存在粒径大、粒径分布宽和颗粒团聚等问题[57],Chattopadhyay等[58]将乳液技术与超临界流体萃取相结合,提出了超临界微乳萃取(supercritical fluid extraction of emulsions,SFEE)技术,并以单批式和连续式两种形式制备粒径均匀、分散性好的包载吲哚美辛和酮洛芬的PLGA 微球,解决了上述问题。SFEE 技术是SCCO2在制备DDS 中一个新的发展,应用范围进一步扩大,并成功制备了包载基因[59]和乳酸菌[60]微球。同时在制备多孔微球方面,有望解决传统方法中存在的问题,并展现出一定的优势[61]。
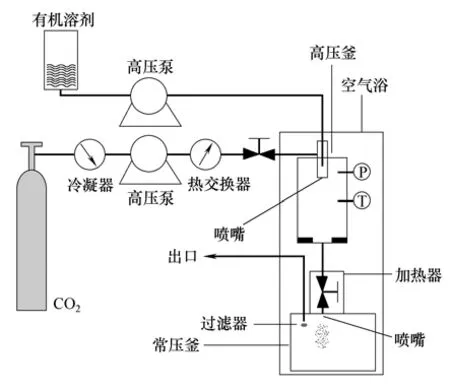
图9 连续式RESS 装置示意图
在实验室研究中,由于SAS 装置的设备投资大,单功能的SAS 装置得不到充分的利用,因此基于SAS 原理的多功能造粒装置的设计和开发势在必行。若对连续式RESS 装置[54]进行改进(如管道和预膨胀容器的添加),可使整套装置既可单独进行RESS和SAS 过程,又可进行连续式的RESS 过程,就可以使整套装置适用于制备各类聚合物载体。类似地,在组织工程方面,静电纺丝和SAS 都已得到广泛应用,Shen等[62-63]利用静电纺丝和SAS 各自的优势,将二者结合起来,用于制备中空或开孔的纤维。除了制备纤维外,本文作者课题组正致力于将其用于制备DDS,理论上能得到粒径分布窄且分散性好的微粒。同时,SAS 造粒装置还有诸多需要改进的地方,如喷嘴的防堵塞、密封的简化、高压釜的可视化等[64],其中高压釜的可视化有助于高压釜内部颗粒形成过程的观察[65],有助于进一步发展SAS 理论。
2.4.2 产品收集
SAS 造粒中,如何实现产品收集的方便快捷是一个问题。针对该问题,孙传经等[66]设置多个产品收集器,实现多个收集器之间的切换,一定程度上省去了单个收集器清洗和干燥的时间;任雅宁[67]在高压釜内放置可提取式的料框,方便产品收集和仪器的清洗。高压釜内膜面积小、结晶慢、收率低、易阻塞滤膜、产品取出为人工操作及收集不彻底等问题影响着SAS 造粒的结果,对此,徐艳吉[68]分别采用了膜通量大的全滤膜收集器和二次旋风收集器。全滤膜收集器的多孔性,使纳米化粉体与溶剂分离的面积增加,大大减少粉体干燥的时间。同时超临界流体流经膜面积增加,速度相应减小,明显降低了截流效应,从而防止了收集器中干冰的产生。旋风收集器的结构使得进入的气流与内壁相切,做到最小的冲击收集器壁的作用力,且其全身采用高抛光不锈钢材料,摩擦力小,产品不容易附着,使得收集更彻底。对于整个SAS 过程而言,高压釜的放气是一个较为漫长的过程,若将高压釜设计成船闸式结构,有望进一步方便产品的快速收集和CO2的节省。
3 结语
超临界抗溶剂技术在制备药物纳米粒和复合微粒上,具有不可替代的优势,所制得的颗粒无溶剂残留、粒径分布较均匀、无明显的分子结构变化且形态良好。目前,在实验装置上的创新和改进,使得以SAS 法为原理的造粒技术的应用范围越来越宽广。尽管如此,众多SAS 装置制得的颗粒仍存在一些不足,如粒径分布不均匀、团聚、可控性不高等。颗粒的粒径和形貌不仅受到造粒过程中成核和晶体生长机理的影响,还受到材料和药物的性质、操作条件(压力、温度、溶液浓度、溶液流速、放气速度等)以及SAS 具体装置的调控,因此需充分利用颗粒形成机理和优化操作条件。此外,从对SAS 造粒装置进行改进的研究中可以看出,目前的改进大多基于文字性的理论依据和解释,而缺乏系统的理论基础以及具体数学模型的指导,所以难以解决现行SAS 装置中存在的所有问题。不过,随着现有的SAS 基础理论和其装置改进的相互促进和发展,SAS 技术的数学模型和基础理论将建立起来和不断完善,其装置的设计和研制也必将取得突破性进展。任何一种技术的发展都离不开生活的某种需求,技术发展的最终端就是大规模生产,应用于实际生活中。未来,以超临界抗溶剂法为原理的造粒技术发展的重点是如何实现规模化。在实现规模化的道路上,可从以下三方面对现有规模的超临界抗溶剂装置进行改进:①二氧化碳的循环利用;②喷嘴和高压釜结构的改造,有利于特定结构产品的制备和方便产品的快速收集;③管道的设计,实现造粒装置的多功能化,根据生产的需要,通过多个容器和高压釜间的切换来选择特定的装置流程。超临界抗溶剂造粒技术的进一步发展会使其迸发出更多的优势,从而更加广泛地应用于各个领域中,创造更大的经济利益。
[1]Kompella U B,Koushik K.Preparation of drug delivery systems using supercritical fluid technology[J].Critical Reviews in Therapeutic Drug Carrier Systems,2001,18(2):173-199.
[2]常彦忠,袁其朋,钱忠明.转铁蛋白-转铁蛋白受体系统在药物运输和定向给药中的应用[J].科学通报,2003(3):213-218.
[3]Severino P,Santana M H A,Malmonge S M,et al.Polymers for drug delivery systems formulations[J].Polimeros-Ciencia E Tecnologia,2011,21(5):361-368.
[4]Yang W W,Pierstorff E.Reservoir-based polymer drug delivery systems[J].Jala,2012,17(1):50-58.
[5]Martin A,Cocero M J.Micronization processes with supercritical fluids:Fundamentals and mechanisms[J].Advanced Drug Delivery Reviews,2008,60(3):339-350.
[6]Fages J,Lochard H,Letourneau J J,et al.Particle generation for pharmaceutical applications using supercritical fluid technology[J].Powder Technology,2004,141(3):219-226.
[7]Yeo S,Kiran E.Formation of polymer particles with supercritical fluids:A review[J].The Journal of Supercritical Fluids,2005,34(3):287-308.
[8]Yesil-Celiktas O,Senyay D.The breadth and intensity of supercritical particle formation research with an emphasis on publication and patent disclosures[J].Industrial&Engineering Chemistry Research,2010,49(15):7017-7026.
[9]Gallagher P M,Coffey M P,Krukonis V J,et al.Gas antisolvent recrystallization:New process to recrystallize compounds insoluble in supercritical fluids[J].Supercritical Fluid Science and Technology,1989,406:334-354.
[10]Lesoin L,Crampon C,Boutin O,et al.Development of a continuous dense gas process for the production of liposomes[J].The Journal of Supercritical Fluids,2011,60:51-62.
[11]Jung J,Perrut M.Particle design using supercritical fluids:Literature and patent survey[J].The Journal of Supercritical Fluids,2001,20(3):179-219.
[12]Bleich J,Müller B W,Waßmus W.Aerosol solvent extraction system —A new microparticle production technique[J].International Journal of Pharmaceutics,1993,97(1-3):111-117.
[13]Bleich J,Muller B W.Production of drug loaded microparticles by the use of supercritical gases with the aerosol solvent extraction system(ASES)process[J].Journal of Microencapsulation,1996,13(2):131-139.
[14]Kunastitchai S,Pichert L,Sarisuta N,et al.Application of aerosol solvent extraction system(ASES)process for preparation of liposomes in a dry and reconstitutable form[J].International Journal of Pharmaceutics,2006,316(1):93-101.
[15]Kim M S,Lee S,Park J S,et al.Micronization of cilostazol using supercritical antisolvent(SAS) process :Effect of process parameters[J].Powder Technology,2007,177(2):64-70.
[16]Reverchon E,De Marco I.Supercritical antisolvent precipitation of cephalosporins[J].Powder Technology,2006,164(3):139-146.
[17]Reverchon E,De Marco I,Della Porta G.Rifampicin microparticles production by supercritical antisolvent precipitation[J].International Journal of Pharmaceutics,2002,243(1-2):83-91.
[18]Kim M S,Jin S J,Kim J S,et al.Preparation,characterization andin vivoevaluation of amorphous atorvastatin calcium nanoparticles using supercritical antisolvent(SAS) process[J].European Journal of Pharmaceutics and Biopharmaceutics,2008,69(2):454-465.
[19]Miguel F,Martin A,Gamse T,et al.Supercritical anti solvent precipitation of lycopene:Effect of the operating parameters[J].The Journal of Supercritical Fluids,2006,36(3):225-235.
[20]Tu L S,Dehghani F,Foster N.Micronisation and microencapsulation of pharmaceuticals using a carbon dioxide antisolvent[J].Powder Technology,2002,126(2):134-149.
[21]陈爱政,王士斌,李翼,等.非溶剂法改进超临界抗溶剂过程制备药物超细微粒的方法:中国,201010529743.X[P].2010.
[22]Chen A Z,Li Y,Chau F T,et al.Application of organic nonsolvent in the process of solution-enhanced dispersion by supercritical CO2to prepare puerarin fine particles[J].The Journal of Supercritical Fluids,2009,49(3):394-402.
[23]Chen A Z,Pu X M,Kang Y Q,et al.Preparation of 5-fluorouracil-poly(L-lactide) microparticles using solution-enhanced dispersion by supercritical CO2[J].Macromolecular Rapid Communications,2006,27(15):1254-1259.
[24]Montes A,Gordillo M,Pereyra C,et al.Co-precipitation of amoxicillin and ethyl cellulose microparticles by supercritical antisolvent process[J].The Journal of Supercritical Fluids,2011,60:75-80.
[25]Wang Y L,Dave R N,Pfeffer R.Polymer coating/encapsulation of nanoparticles using a supercritical anti-solvent process[J].The Journal of Supercritical Fluids,2004,28(1):85-99.
[26]Wang Y,Pfeffer R,Dave R,et al.Polymer encapsulation of fine particles by a supercritical antisolvent process[J].AIChE Journal,2005,51(2):440-455.
[27]Aymonier C,Elissalde C,Reveron H,et al.Supercritical fluid technology of nanoparticle coating for new ceramic materials[J].Journal of Nanoscience and Nanotechnology,2005,5(6):980-983.
[28]Wang Y L,Wang Y P,Yang J,et al.The application of a supercritical antisolvent process for sustained drug delivery[J].Powder Technology,2006,164(2):94-102.
[29]陈爱政,王士斌,李翼.超临界流体技术制备核壳型复合微球的方法:中国,201010529764.1[P].2010.
[30]Chen A Z,Li Y,Chen D,et al.Development of core-shell microcapsules by a novel supercritical CO2process[J].Journal of Materials Science:Materials in Medicine,2009,20(3):751-758.
[31]Chen A Z,Li Y,Chau F T,et al.Microencapsulation of puerarin nanoparticles by poly(L-lactide) in a supercritical CO2process[J].Acta Biomaterialia,2009,5(8):2913-2919.
[32]Chen A Z,Wang G Y,Wang S B,et al.Formation of methotrexate-PLLA-PEG-PLLA composite microspheres by microencapsulation through a process of suspension-enhanced dispersion by supercritical CO2[J].International Journal ofNanomedicine,2012,7:3013-3022.
[33]Chen A Z,Li L,Wang S B,et al.Study of Fe3O4-PLLA-PEG-PLLA magnetic microspheres based on supercritical CO2:Preparation,physicochemical characterization,and drug loading investigation[J].The Journal of Supercritical Fluids,2012,67:139-148.
[34]Toropainen T,Velaga S,Heikkila T,et al.Preparation of budesonide/γ-cyclodextrin complexes in supercritical fluids with a novel SEDS method[J].Journal of Pharmaceutical Sciences,2006,95(10):2235-2245.
[35]Hanna M,York P,Rudd D,et al.A novel apparatus for controlled particle formation using supercritical fluids[J].Pharmaceutical Research,1995,12(9):S141.
[36]Chattopadhyay P,Gupta R B.Production of griseofulvin nanoparticles using supercritical CO2antisolvent with enhanced mass transfer[J].International Journal of Pharmaceutics,2001,228(1-2):19-31.
[37]Yeo S D,Kiran E.Formation of polymer particles with supercritical fluids:A review[J].The Journal of Supercritical Fluids,2005,34(3):287-308.
[38]Reverchon E,Adami R,Cardea S,et al.Supercritical fluids processing of polymers for pharmaceutical and medical applications[J].The Journal of Supercritical Fluids,2009,47(3):484-492.
[39]He W Z,Suo Q L,Jiang Z H,et al.Precipitation of ephedrine by SEDS process using a specially designed prefilming atomizer[J].The Journal of Supercritical Fluids,2004,31(1):101-110.
[40]He W,Suo Q,Hong H,et al.Production of natural carotene-dispersed polymer microparticles by SEDS-PA co-precipitation[J].Journal of Materials Science,2007,42(10):3495-3501.
[41]尹光福,张严之,廖晓明.一种采用超临界CO2流体技术制备水溶性药物缓释微粒的方法:中国,201110293184.1[P].2012.
[42]Zhang Y Z,Liao X M,Yin G F,et al.Preparation of water soluble drugs-loaded microparticles using modified solution enhanced dispersion by supercritical CO2[J].Powder Technology,2012,221:343-350.
[43]李志义,刘学武,张晓冬.用超临界反溶剂过程制备超细粉体的结晶釜:中国,200310104825.X[P].2004.
[44]刘燕,张明,王威强,等.一种超临界流体纳微米材料制备用组合喷嘴:中国,201010516612.8[P].2010.
[45]Chen H B,Khemtong C,Yang X L,et al.Nanonization strategies for poorly water-soluble drugs[J].Drug Discovery Today,2011,16(7-8):354-360.
[46]Kawashima Y.Preface nanoparticulate systems for improved drug delivery[J].Advanced Drug Delivery Reviews,2001,47(1):1-2.
[47]Chattopadhyay P,Gupta R B.Production of antibiotic nanoparticles using supercritical CO2as antisolvent with enhanced mass transfer[J].Industrial &Engineering Chemistry Research,2001,40(16):3530-3539.
[48]Chattopadhyay P,Gupta R B.Protein nanoparticles formation by supercritical antisolvent with enhanced mass transfer[J].AIChE Journal,2002,48(2):235-244.
[49]Jin H Y,Hemingway M,Xia F,et al.Production ofβ-carotene nanoparticles by the solution enhanced dispersion with enhanced mass transfer by ultrasound in supercritical CO2(SEDS-EM)[J].Industrial &Engineering Chemistry Research,2011,50(23):13475-13484.
[50]Calvignac B,Boutin O.The impinging jets technology:A contacting device using a SAS process type[J].Powder Technology,2009,191(1-2):200-205.
[51]Boutin O,Petit-Gas T,Badens E.Powder micronization using a CO2supercritical antisolvent type process :Comparison of different introduction devices[J].Industrial &Engineering Chemistry Research,2009,48(12):5671-5678.
[52]O'Neill M L,Cao Q,Fang M,et al.Solubility of homopolymers and copolymers in carbon dioxide[J].Industrial&Engineering Chemistry Research,1998,37(8):3067-3079.
[53]陈爱政,王士斌,赵政,等.一种连续式超临界流体快速膨胀技术制备聚合物或药物颗粒的方法:中国,201110269946.4[P].2011.
[54]Chen A Z,Zhao Z,Wang S B,et al.A continuous RESS process to prepare PLA-PEG-PLA microparticles[J].The Journal of Supercritical Fluids,2011,59:92-97.
[55]Tozuka Y,Miyazaki Y,Takeuchi H.A combinational supercritical CO2system for nanoparticle preparation of indomethacin[J].International Journal of Pharmaceutics,2010,386(1-2):243-248.
[56]Pathak P,Meziam M J,Desai T,et al.Formation and stabilization of ibuprofen nanoparticles in supercritical fluid processing[J].The Journal of Supercritical Fluids,2006,37(3):279-286.
[57]Elizondo E,Cordoba A,Sala S,et al.Preparation of biodegradable poly(methyl vinyl ether-co-maleic anhydride) nanostructured microparticles by precipitation with a compressed antisolvent[J].The Journal of Supercritical Fluids,2010,53(1-3):108-114.
[58]Chattopadhyay P,Huff R,Shekunov B Y.Drug encapsulation using supercritical fluid extraction of emulsions[J].Journal of Pharmaceutical Sciences,2006,95(3):667-679.
[59]Mayo A S,Ambati B K,Kompella U B.Gene delivery nanoparticles fabricated by supercritical fluid extraction of emulsions[J].International Journal of Pharmaceutics,2010,387(1-2):278-285.
[60]Della Porta G,Castaldo F,Scognamiglio M,et al.Bacteria microencapsulation in PLGA microdevices by supercritical emulsion extraction[J].The Journal of Supercritical Fluids,2012,63:1-7.
[61]赵趁,陈爱政,王士斌,等.超临界二氧化碳流体技术制备多孔微球研究进展[J].科学通报,2012,57(36):3459-3466.
[62]Shen Z H,Thompson B E,McHugh M A.Electrospinning in near-critical CO2[J].Macromolecules,2006,39(25):8553-8555.
[63]Liu J,Shen Z H,Lee S H,et al.Electrospinning in compressed carbon dioxide:Hollow or open-cell fiber formation with a single nozzle configuration[J].The Journal of Supercritical Fluids,2010,53(1-3):142-150.
[64]巫先坤,王志祥,黄德春,等.超临界抗溶剂制粒装置的现状及其展望[J].化工进展,2012,31(3):489-494,501.
[65]Reverchon E,Torino E,Dowy S,et al.Interactions of phase equilibria,jet fluid dynamics and mass transfer during supercritical antisolvent micronization[J].Chemical Engineering Journal,2010,156(2):446-458.
[66]孙传经,孙云鹏.制造纳米材料的超临界CO2抗溶剂装置:中国,01201289.0[P].2002.
[67]任雅宁.超临界反溶剂过程工艺研究[D].大连:大连理工大学,2007.
[68]徐艳吉.喜树碱纳米化粉体的超临界反溶剂制备工艺与设备研究[D].哈尔滨:东北林业大学,2008.

