不同处理方法对菊花‘神马’脱除病毒的影响1)
赵霜李青时颂
(北京林业大学,北京,100083)
菊花‘神马’(Chrysanthemum morifolium‘Shenma’)是由日本引进的切花菊品种,其花色纯白、花型优美、品质优良,是近年来应用较多的切花品种。我国种植的神马菊主要出口日本。感染黄瓜花叶病毒的神马菊,叶片表现出黄色的花叶症状,严重影响其观赏价值。同时由于国内和国际市场对切花菊的大量需求,病毒的侵染也给菊花的生产和销售带来了巨大的经济损失。传统的扦插繁殖无法阻止病毒的传播与扩散,长期的无性繁殖会造成病毒积累、产生种性退化、产量降低、品质变劣等后果。所以需要采取组织培养等手段脱除菊花体内的病毒,以促进商业化生产,扩大经济效益。课题围绕茎尖培养法展开,结合热处理和病毒唑处理等手段,探讨其对神马菊脱毒效果的影响,从而找寻适合神马菊脱毒的有效方法。
1 材料与方法
1.1 试验材料
选用经酶联免疫吸附测定法(ELISA)检验呈阳性的母株为供试材料,采取其顶芽及带芽茎段为外植体。
1.2 试验方法
菊花组织培养:将外植体清洗干净,在流水下冲洗20 min,放入超净台。先用75%的酒精消毒1 min,无菌水涮洗3遍,每次3 min,再用0.1%的升汞灭菌8 min,最后用无菌水涮洗5遍,每次3 min。之后转入到培养基 MS+6-BA1.0 mg/L+NAA0.1 mg/L中进行初代培养。每28 d继代一次,继代培养基为MS+6-BA0.50 mg/L+NAA0.05 mg/L。
茎尖处理:初代培养30 d后,切取试管苗的顶芽和侧芽。在4~8倍的解剖镜下剥取茎尖长度分别为0.2 ~0.3、0.4 ~0.5、0.6 ~0.8、0.9 ~1.0 mm 4个水平的茎尖,接种于培养基MS+6-BA0.40 mg/L+NAA0.04 mg/L,每水平接种30个茎尖,每28 d更新一次培养基。每7 d进行一次观察,28 d后统计成活率,49 d后统计脱毒率。
病毒唑+茎尖培养:采用双因子完全随机区组的试验方法,病毒唑质量浓度及茎尖长度的处理组合如表1所示,共9个处理,每处理接种10个茎尖,重复3次。将不同长度的茎尖接种于添加了不同质量浓度病毒唑的培养基 MS+6-BA0.40 mg/L+NAA0.04 mg/L上,35 d后转入正常培养基。每28 d更新一次培养基,以保证病毒唑的药效以及茎尖生长对养分和水分的需求。每7 d进行一次观察,35 d后统计成活率,49 d后统计脱毒率。

表1 病毒唑质量浓度与茎尖长度的处理组合

表2 病毒唑处理茎尖的随机区组设计
热处理+茎尖培养:热处理主要采用昼夜变温并逐步升温的方式,将经壮苗后的试管苗置于人工气候箱,白天起始温度为28℃,每天升2℃升到38℃为止,夜间起始温度为26℃,每天升2℃升至32℃为止。完成阶段升温后继续处理30、45、60 d,光照时间设为14 h,光照强度设为80%,湿度设为60%,每个时间处理各60株试管苗。为保证试管苗对水分的需求,热处理期间每15 d更新一次培养基。热处理后对成活的试管苗剥取长度为0.4~0.5mm的茎尖接种于MS+6-BA0.40mg/L+NAA 0.04 mg/L培养基上,置于培养室进行培养,28 d后统计成活率,49 d后统计脱毒率。
培养条件:培养室条件,温度(24±1)℃,光照时间14 h/d,光照强度1 500~2 000 lx。成活率=(接种成活的外植体数/接种外植体总数)×100%;脱毒率=(脱除病毒的外植体数/成活的外植体数)×100%。
1.3 检测方法
采用症状观察法和酶联免疫吸附测定法(ELISA)对脱毒处理的试管苗进行检测。对于表现花叶症状的试管苗无需再进行其他检测,而对未表现症状的试管苗采用ELISA中的直接法对其进行检测(ELISA试剂盒购置于Agida公司)。
2 结果与分析
2.1 茎尖培养处理后茎尖长度与茎尖成活率、脱毒率的相关性
菊花茎尖在接入培养基后,7 d左右部分茎尖就出现膨大的现象(图1),特别是0.6 ~0.8、0.9 ~1.0 mm长的茎尖,14 d左右部分茎尖开始分化成芽(图2),同时有些茎尖褐化死亡,4周之后可统计成活率,茎尖生长49 d后成活的茎尖均可发育成完整的植株,可以进行病毒检测统计脱毒率。

图1 一周左右的茎尖

图2 二周左右的茎尖
由表3可以看出,随着茎尖长度的增加,其成活率上升,但脱毒率却下降,二者呈负相关。在综合考虑成活率和脱毒率的情况下采用剥取0.4~0.5 mm的茎尖进行脱毒培养,以减少工作量。
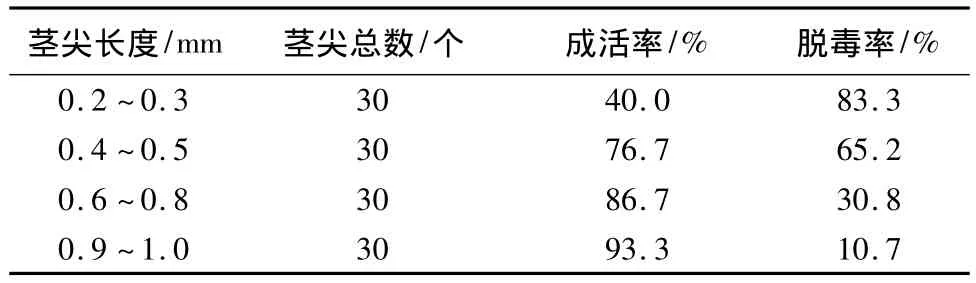
表3 不同长度茎尖的成活率和脱毒率
2.2 病毒唑结合茎尖培养脱毒处理后茎尖的成活率和脱毒率
2.2.1 病毒唑质量浓度与茎尖长度及其成活率的相关性
由表4可见,随着病毒唑质量浓度的增加,同一长度茎尖的成活率下降,同时经病毒唑处理的茎尖成活率低于直接剥取的茎尖,如当茎尖长度为0.4~0.5 mm、病毒唑质量浓度为15 mg/L时,其成活率仅为30%,远远低于直接剥取0.4~0.5 mm茎尖76.7%的成活率。但是只添加5 mg/L病毒唑的茎尖成活率与未添加病毒唑的茎尖相差不多,如当茎尖长度为0.4~0.5 mm时,添加病毒唑的茎尖成活率只比未添加的低3.4%。因此,高质量浓度的病毒唑会影响茎尖的生长,降低茎尖的成活率,并造成茎尖的死亡。
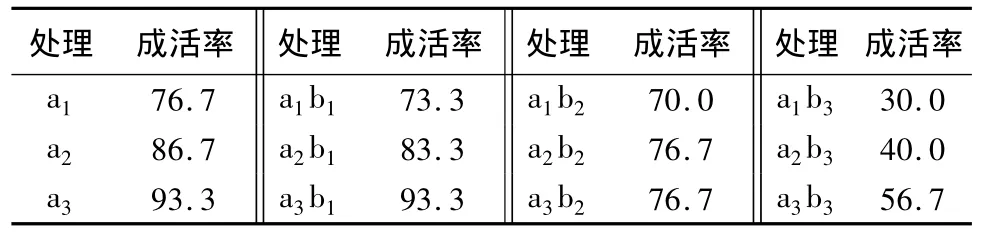
表4 病毒唑处理茎尖与直接剥茎尖成活率的差异 %
2.2.2 病毒唑结合茎尖培养处理后茎尖的脱毒率
表5是病毒唑处理茎尖后,茎尖脱毒个数的统计(每处理茎尖总数为10个),其中A因子为茎尖长度,B因子为病毒唑质量浓度。由此结果进行方差分析,所得数据如表6所示。由F值比较可知,不同茎尖长度、不同病毒唑质量浓度及它们之间的不同组合的脱毒效果差异均极显著,区组之间差异不显著。由于试管苗置于室内培养,各处理所处条件均相同,所以区组之间无明显差异。
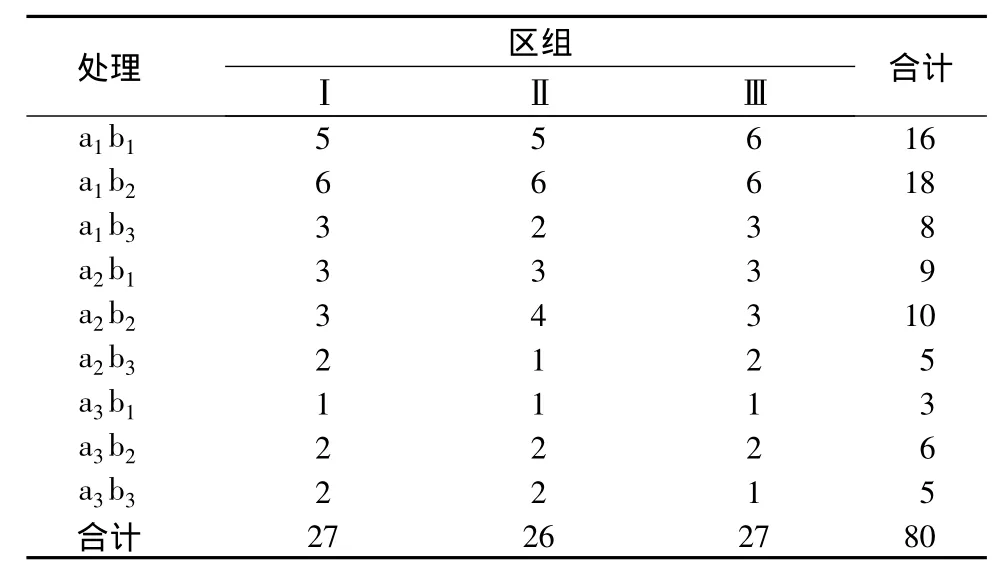
表5 病毒唑处理茎尖的脱毒结果统计 个
为了进一步找出脱除病毒的最佳组合,对差异极显著的3个因子进行差异的多重比较。q检验结果(表7、8、9)表明,单独比较茎尖长度对脱毒效果的差异时,0.4~0.5 mm的茎尖脱毒效果最好;单独比较病毒唑质量浓度时,添加10 mg/L的病毒唑的茎尖脱毒效果最好;比较A×B处理组合的差异时,发现0.4~0.5 mm的茎尖和添加了10 mg/L病毒唑的组合脱毒效果最好,这与单独比较的结果相吻合,但0.4~0.5 mm的茎尖和添加了5 mg/L病毒唑的组合与最佳组合的差异不明显,在生产上可以考虑使用。
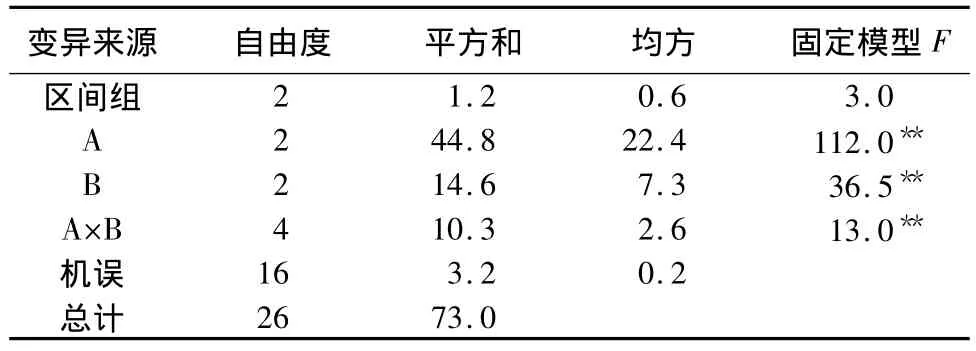
表6 病毒唑处理茎尖的脱毒结果的方差分析

表7 A因子的多重比较

表8 B因子的多重比较

表9 A×B处理组合的多重比较
病毒唑处理茎尖(0.4~0.5 mm 茎尖,10 mg/L病毒唑)与直接剥茎尖(0.4~0.5 mm茎尖)成活率和脱毒率分别为 70.0%、76.7%,85.7%、65.2%。病毒唑处理茎尖的成活率较直接剥取茎尖低了6.7%,但脱毒率却提高了20.5%。由此可见,病毒唑结合茎尖培养比单独剥取茎尖的脱毒效果要好。
2.3 热处理结合茎尖培养脱毒处理后茎尖的成活率及脱毒率
热处理可直接对外植体的母株进行处理,也可以对试管苗进行处理。黄瓜花叶病毒的致死温度可达到60~65℃[1],在此温度下菊花植株会死亡,所以单纯依靠热处理无法达到理想的脱毒效果。由于菊花的耐热性比较差,所以采取逐步升温的方式[2]以达到过渡的目的,同时采用昼夜变温的方式增加菊花植株的成活率。由表10可以看出,随着热处理时间的增加,植株的成活率逐渐降低,同时成活的植株剥取的茎尖成活率也降低,但茎尖脱毒率却上升,如热处理60 d后茎尖成活率较未经热处理的茎尖低了45.1%,热处理60 d后剥取的茎尖其脱毒率可达到100%,与未经热处理的茎尖相比提高了34.8%。由于热处理后剥取的茎尖长度相同,因此热处理对茎尖的成活率有影响。但考虑到成活率的关系,建议热处理45 d后剥取0.4~0.5 mm的茎尖,这样既能够提高成活率又能够节省时间,避免资源的浪费。

表10 热处理结合茎尖脱毒后茎尖的成活率及脱毒率
3 结论与讨论
茎尖培养法是最常用的植物脱毒方法,其操作简便,适用于多种植物材料,其脱毒原理是在茎尖分生区内不存在维管束,病毒扩散的速度没有细胞分裂的速度快,病毒的复制受到旺盛代谢活动的限制,所以分生区病毒含量低[3]。但严格地讲,茎尖分生组织仅限于顶端圆锥区内长度不超过0.1 mm范围内[4],而这种长度的茎尖成活率极低,菊花‘神马’0.2~0.3 mm茎尖成活率仅有40%,这个比率虽然与很多其他植物相比高了很多,但考虑到剥取时操作的复杂性,建议菊花‘神马’剥取0.4~0.5 mm长的茎尖用于脱除CMV最为适宜,这样既能保证脱毒率,又能保证成活率。
常用的脱毒手段是温度处理和化学药剂处理,其中温度处理分冷处理和热处理,可根据病毒种类选择恰当的方法。在菊花感染的病毒中,菊花矮化病毒(CSV)和菊花褪绿斑驳病毒(CCMV)可经5℃的冷处理后进行茎尖脱毒培养[5],而番茄不孕病毒(TAV)、烟草花叶病毒(TMV)、黄瓜花叶病毒(CMV)等病毒的热致死温度较高,除热处理外还要辅助茎尖培养进行脱毒。CMV的致死温度达到60~65℃,而菊花‘神马’的耐热性不好,无法单纯依靠热处理达到脱毒的效果,所以选择热处理结合茎尖培养的方法进行脱毒培养。由于前期试验中0.4~0.5 mm的茎尖成活率和脱毒率都很高,所以热处理后选择剥取0.4~0.5 mm的茎尖进行脱毒培养。菊花‘神马’热处理30 d后剥取的茎尖脱毒率有84%,处理60 d后可达到100%。但热处理时间不宜过长,否则不仅植株本身会死亡,热处理后剥取的茎尖成活率也会大幅下降,热处理60 d后剥取的茎尖成活率仅为31.6%。这个比例是采用昼夜变温及逐步升温的结果,在前期恒温热处理的预试验中成活率更低。在综合考虑成活率和脱毒率的前提下,在热处理45 d后,剥取菊花‘神马’的茎尖进行培养比较适宜。化学药剂处理是比较方便的一种脱毒手段,常用的抗病毒化学药物有三氮唑核苷(病毒唑)、5-二氢尿嘧啶(DHT)、环已酰胺、放线菌素-D等,其中病毒唑是应用最为广泛的一种试剂。虽然它对多种植物病毒都有较好的脱除作用,但是实际应用中还是存在一些问题,如对植物会有不同程度的药害[6],所以要避免长期使用。因此本研究选择病毒唑的处理时间为35 d,以避免产生药害。病毒唑质量浓度越高脱毒的效果越好,经研究在添加了病毒唑的培养基中,不同长度茎尖的脱毒率较未经病毒唑处理的茎尖均有所提高。但由于病毒唑存在抑制植物生长、造成褐化等副作用,经病毒唑处理过的茎尖较未经病毒唑处理的茎尖生长缓慢,且成活率有所下降,如0.4~0.5 mm的茎尖在经15 mg/L的病毒唑处理35 d后,其成活率为30%,比未经病毒唑处理的茎尖低了46.7%。所以菊花‘神马’可剥取0.4~0.5 mm长的茎尖,接种于添加了10 mg/L病毒唑的培养基,培养35 d来脱除CMV,这样既可保证脱毒率又能使茎尖正常的生长。本研究对病毒唑的质量浓度及茎尖的长度进行了筛选,但是具体的处理时间还有待进一步探讨。
植物组织培养脱毒方法中还有很多其他的方式,如愈伤组织培养、花药和花粉培养、珠心培养等[7],这些方法在其他感染病毒的植物身上也取得了很好的脱毒效果,但是专门针对菊花脱毒的研究还没有。此外原生质体培养[8]也是可以进行脱毒培养的方法,这种方法在烟草等植物上取得了很好的效果。因此脱毒的方法有很多,菊花脱毒的研究还可以从这些方面开展,从而找寻最佳的脱毒方式。
[1] 吴元华,韦石来,刘忠智,等.美人蕉黄瓜花叶病毒和菜豆黄花叶病毒研究[J].沈阳农业大学学报,1995,26(4):359-362.
[2] 王仁睿,李明福,李桂芬,等.菊花品种“日本红”的脱毒和组织培养[J].植物生理学通讯,2009,45(8):797-798.
[3] 杨鹏辉,王仁睿,刘军,等.菊花脱毒无害化技术研究进展[J].陕西农业科学,2011(1):89-92,108.
[4] 栾运芳,王建林.脱毒与未脱毒马铃薯叶片光合特性的比较研究[J].中国农业科学,2002,35(2):222-224.
[5] 蔡汉权,李粉玲,林珊珊.花卉脱毒快繁技术研究进展[J].江西科技,2006,24(2):124-127.
[6] 江山.病毒唑在植物保护中的应用[J].植物保护,1991,17(6):35-36.
[7] 王金刚,张兴.园林植物组织培养技术[M].北京:中国农业科学技术出版社,2008.
[8] 陈泽雄.园艺植物病毒脱毒技术研究进展[J].北方园艺,2007(5):58-60.

