高山被孢霉Δ5去饱和酶基因的克隆及异源表达研究
刘建民,栗茂腾
(1.华中科技大学生命科学与技术学院,湖北 武汉 430074;2.河南理工大学资源环境学院,河南 焦作 454000)
生物体内的脂肪酸分为饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸。多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)是对人体有重要生理活性的物质,广泛应用于保健品和医药等行业。花生四烯酸(20:4Δ5,8,11,14,arachidonic acid,AA)是研究、应用较多的多不饱和脂肪酸之一,其广泛分布于动物的中性脂肪中[1]。在脑和神经组织中,AA的含量通常占总PUFAs的40%~50%,在神经末梢中更是高达70%,它在促进大脑和神经发育方面有着重要的影响[2]。前人的研究结果表明,AA在细胞内具有第二信使的作用,参与调控细胞的生命活动[3];同时,在改善记忆力和视力、神经功能调节和炎症反应中都有重要的作用[4]。
AA有重要的生理功能,但人体不能自身合成,必须从外界摄取获得。被孢霉(Mortierella)的发酵生产是目前AA最主要的来源,但通过被孢霉发酵获得的AA有较浓的产生菌气味。在PUFAs的合成过程中,以双高γ-亚麻酸(20:3Δ8,11,14,dihomo-γ-linolenic acid,DHGLA)为底物,Δ5去饱和酶催化脂肪酸链第5、6位碳原子间脱氢形成AA。Δ5去饱和酶是AA合成途径中的关键酶,因此,克隆Δ5去饱和酶基因并对其功能进行验证,可以对AA的发酵生产提供理论支持。
本研究以实验室筛选的高山被孢霉W15为材料,通过RT-PCR的方法克隆到Δ5去饱和酶基因,将该基因转化毕赤酵母GS115菌株后,得到了表达产物,这为AA新来源的拓展提供参考。
1 材料与方法
1.1 菌株、试剂与培养基
菌株 高山被孢霉W15为实验室筛选和保种的菌株。
连接酶、限制性内切酶 加拿大Fermentas公司;双高γ-亚麻酸 美国Sigma公司;pMD18-T Simple Vector、Escherichia coli DH5α 宝生物(大连)有限公司;pPIC3.5K载体、Pichia pastoris GS115 美国Invitrogen公司;G418(遗传霉素) Genveiw公司;A反应液 北京天根生化科技有限公司;其他试剂为进口试剂或国产分析纯。
MD培养基:酵母氮碱基13.4g、生物素4×10-4g、葡萄糖10g,用蒸馏水定容至1L;YPD培养基:每升含有酵母提取物10g、蛋白胨20g、葡萄糖20g;BMGY培养基:酵母提取物10g、蛋白胨20g、1mol/L磷酸钾缓冲液100mL、酵母氮碱基13.4g、甘油10mL,定容至1L;BMMY:酵母提取物10g、蛋白胨20g、1mol/L磷酸钾缓冲液100mL、酵母氮碱基13.4g、甲醇10mL,定容至1L。
1.2 方法
1.2.1 高山被孢霉Δ5去饱和酶基因的克隆
将高山被孢霉接种到土豆培养基中,25℃振荡培养5d,真空抽虑收集菌体,按照Invitrogen公司的Trizol RNA提取试剂盒的说明提取高山被孢霉的总RNA,用First Strand cDNA Synthesis Kit (Fermentas)合成第一链cDNA。
Δ5去饱和酶基因引物参考GenBank已提交序列(AF054824),根据Michaelson等[5]进行设计,在上游引物引入Kozak序列[6],引物扩增的片段为Δ5去饱和酶基因的完整序列,引物两端中引入EcoR Ⅰ酶切位点。Δ5L1:5’-GCGA ATTCGCCACCATGGGTACGGACCAAGGAAA-3’;Δ5R1:5’-CGGAATTCCTACTCTTCCTTGGGACGGAG-3’。
以合成的第一链cDNA为模板,用ToYoBo公司的KOD plus高保真酶进行扩增,反应体系为50μL。根据引物设计软件Oligo 6.0推荐的退火温度,PCR反应程序为:95℃预变性2min,然后进行30个循环的扩增反应,每个循环包括94℃变性20s,57℃退火30s,68℃延伸1min 30s。
PCR产物用0.8%的琼脂糖凝胶进行电泳分离,回收纯化PCR产物。由于用高保真酶扩增的PCR产物为平末端,因此,需对回收的PCR产物进行加A反应,便于与T载体的连接,取15μL回收PCR产物,加入4μL 5×加A反应液和1μL 2.5U/μL Taq DNA聚合酶,混匀后,用PCR仪72℃保温40min完成加A反应。加A反应的产物与pMD18-T Simple Vector进行连接和转化大肠杆菌DH5α感受态细胞,用菌液PCR的方法筛选阳性克隆,送北京三博生物技术有限公司测序。
1.2.2 毕赤酵母表达载体的构建
用EcoR I酶切重组的T载体,得到Δ5去饱和酶基因片段,将该片段连接到经EcoR I消化和CIAP去磷酸化的pPIC3.5K载体上,转化E. coli DH5α并用50mg/mL的卡那霉素进行筛选。为了鉴定基因在酵母表达载体上的插入方向,合成一条酵母表达载体通用引物,该引物序列位于pPIC3.5K的5’AOX1启动子的下游,序列如下:
5’AOX1:5’-GACTGGTTCCAATTGACAAGC-3’。
PCR扩增时,用5’AOX1引物和扩增基因时使用的下游引物对目的基因进行PCR扩增;取1μL菌液做模板,预变性时间为6min,其他按照扩增基因的条件进行PCR反应。如扩增产物大小与目的片段相同,则可初步确定该克隆为阳性克隆且基因为正向连接,该重组质粒命名为pPIC3.5K-D5;否则是假的阳性克隆或者基因在载体中插入的方向相反。
1.2.3 重组酵母载体对毕赤酵母GS115的转化
StuⅠ线性化重组质粒pPIC3.5K-D5,回收后采用电击转化法转化感受态毕赤酵母GS115,MD选择性培养基平板进行初筛。对平板上长出的菌落分别涂布在G418质量浓度为0.5、0.75、1、2、3、4mg/mL的YPD平板进行复筛,选择耐受高质量浓度G418的转化菌株用于表达研究,同时,以转化空质粒pPIC3.5K的酵母作为空白对照。
1.2.4 酵母转化子的鉴定
取200μL转化酵母菌液,25℃、3000r/min离心2min。倒去上清,加入100μL 0.2% SDS,重新悬浮酵母菌体,把悬浮的菌液煮沸5min后,用离心机短暂离心10s。取处理后的上清1μL做模板,以Δ5L1/Δ5R1为引物,PCR鉴定阳性转化酵母。
1.2.5 重组毕赤酵母的诱导表达
重组酵母接种到装有10mL BMGY培养基的50mL三角瓶中,30℃、200r/min摇床培养16~18h。以1%接种量转接到装有50mL BMMY培养基的250mL三角瓶中,30℃、200r/min摇床培养。每24h向培养基中添加甲醇,使其终浓度为0.6%。持续培养5d,离心收集菌体,用去离子水洗涤3~4次。
1.2.6 酵母油脂的提取及脂肪酸成分分析
收获菌体于50℃烘干后,研碎,用3mL石油醚(30~60℃沸程)抽提2次,在旋转蒸发仪上快速蒸干溶剂;加入0.4mol/L KOH甲醇溶液1mL,80℃水浴中皂化3~5min,冷却后加入14%三氟化硼乙醚甲醇溶液2mL,于80℃水浴中振荡处理1min,待冷却至室温,加入正己烷1mL,加入饱和氯化钠溶液1mL,反复颠倒几次,静置3~5min,上清即为甲酯化的脂肪酸正己烷溶液。
甲酯化样品的分析在华中科技大学分析测试中心完成,使用Agilent 7890A-5975C气质联用仪,仪器设置参数和分析条件如下:进样口温度为250℃,50:1分流比,1μL进样;色谱柱用强极性柱HP-INNOWax(30m×0.25mm,0.25μm);载气为He,流速为1mL/min;升温程序为:80~200℃,25℃/min;200~230℃,3℃/min;230℃保留10min。
2 结果与分析
2.1 Δ5去饱和酶基因的克隆与序列分析
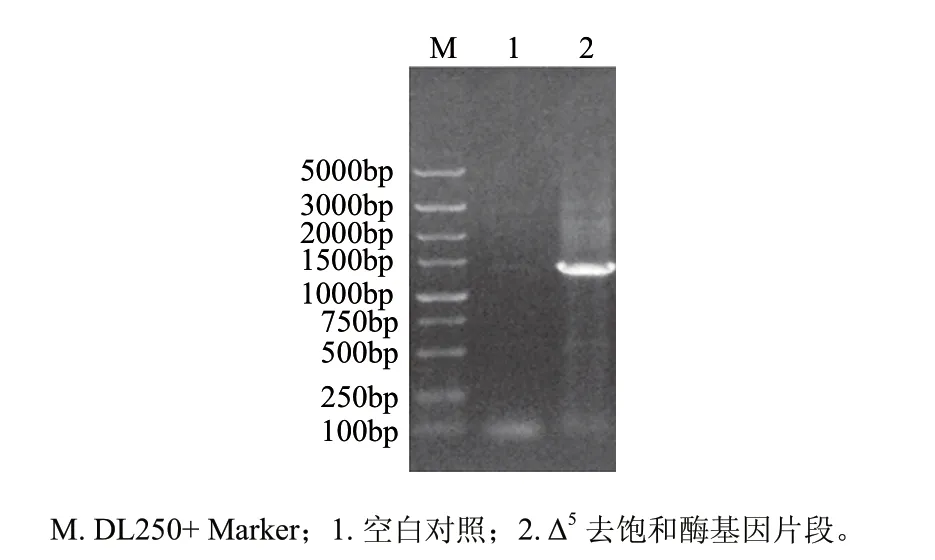
图 1 高山被孢霉Δ5去饱和酶基因RT-PCR产物的琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of the RT-PCR product of Mortierella alpina Δ5 desaturase gene

图 2 高山被孢霉Δ5去饱和酶基因推导氨基酸序列比对Fig.2 Alignment of a deduced amino acid sequence of the Δ5 desaturase gene from Mortierella alpina
提取高山被孢霉W15的总RNA,以合成的cDNA为模板,扩增得到约1400bp的片段(图1),与T载体连接后进行测序,结果表明,所克隆的Δ5去饱和酶基因全长1341bp(GenBank登录号:FJ625826),与参考Δ5去饱和酶基因核苷酸序列同源性为90%,但其推导氨基酸序列与参考基因编码氨基酸序列的同源性达到了95%,这说明Δ5去饱和酶基因在不同高山被孢霉菌株中的核苷酸序列变化较大,但它们编码的氨基酸序列相对较为保守。对推导的氨基酸序列进行分析显示,其N末端存在去饱和酶家族广泛存在的细胞色素b5结构域及保守的HPGG氨基酸序列,同时还存在3个保守的组氨酸富集区HDASH、HMLGHH和QAVHH(图2中虚线表示),这与前人的研究结果一致[5,7]。
2.2 pPIC3.5K-D5酵母表达载体的构建及对毕赤酵母的转化

图 3 重组质粒pPIC3.5K-D5酶切鉴定Fig.3 Identification of pPIC3.5K-D5 with EcoR Ⅰ digestion
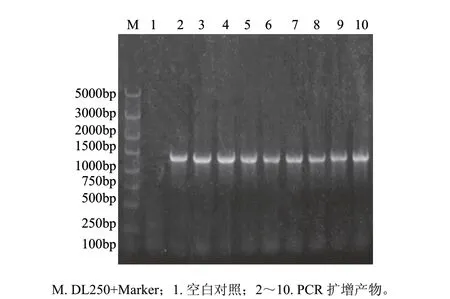
图 4 转化毕赤酵母菌液扩增Δ5去饱和酶基因Fig.4 Δ5 desaturase gene amplification of recombinant P. pastoris GS115
为了验证Δ5去饱和酶基因的功能,将连接在T载体上的Δ5去饱和酶基因用EcoR I切下,亚克隆到经EcoR I消化和CIAP处理的pPIC3.5K表达载体上,转化E. coli DH5α后,用AOX1引物和Δ5R1引物验证基因插入方向。提取基因正向插入的重组质粒,用EcoR I进行酶切验证,结果见图3。酶切后,在1400bp和9000bp处有预期条带出现,证明该基因已成功亚克隆到pPIC3.5K表达载体中。
用Stu I线性化重组质粒pPIC3.5K-D5,以电击法转化毕赤酵母GS115感受态细胞。通过MD平板和含不同质量浓度G418的YPD平板筛选,在4mg/mL G418的平板上得到较多的高抗性重组子。随机挑取9个单菌落,用Δ5L1和Δ5R1引物进行PCR鉴定,见图4,所挑取的菌落均能扩增出与目标条带大小一致的片段,这个结果表明Δ5去饱和酶基因已整合到酵母基因组中。
2.3 表达产物的GC-MS分析

图 5 转化Δ5去饱和酶基因酵母重组子脂肪酸GC-MS分析Fig.5 GC-MS analysis of fatty acid composition in total lipids from P. pastoris GS115 transformants
用甲醇诱导毕赤酵母转化子,以验证Δ5去饱和酶基因是否具有功能。在培养基中添加Δ5去饱和酶的作用底物双高γ-亚麻酸,培养结束后分离酵母细胞并提取细胞内中总脂肪酸,甲酯化后进行GC-MS分析,结果如图5B,添加外源双高γ-亚麻酸作为Δ5去饱和酶底物时,重组毕赤酵母能利用该底物产生AA。对重组毕赤酵母的脂肪酸进行分析表明,双高γ-亚麻酸占总脂肪酸的0.45%,AA占酵母总脂肪酸的2.85%,说明被酵母利用的双高γ-亚麻酸在Δ5去饱和酶的催化下,大部分转化为AA。朱敏等[7]把高山被孢霉M6的Δ5去饱和酶基因构建在毕赤酵母pPIC9K载体上,并在毕赤酵母中做了功能验证,发现该酶能催化合成占总脂肪酸5.8%的AA生成,AA的产量是本实验结果的2倍。出现这一结果可能存在如下两个原因:1)不同的表达载体对基因的表达量和酶活性有一定的影响,不同菌株来源的相同基因在同样的表达载体中表达具有更好的对比性;2)这两个基因均编码446个氨基酸,其比对结果中仅有11个氨基酸存在差异,这揭示了不同种属来源的相同基因,在进化过程中,基因序列的变化导致氨基酸序列的改变,最终使这些基因在外源宿主中的表达水平可能会有较大的差别。因此,比较不同来源的相同基因的DNA序列和编码的氨基酸序列,分析发生突变的氨基酸位点和影响酶活的关键位点,可为进一步定向改造基因的结构提供有力的帮助。由表1可知,重组毕赤酵母中的亚油酸(linoleic acid,LA)与含空载体酵母中LA相比,含量从9.61%提高到23.58%,说明在毕赤酵母培养过程中,添加一定量的外源双高γ-亚麻酸,可能会提高LA的产量。
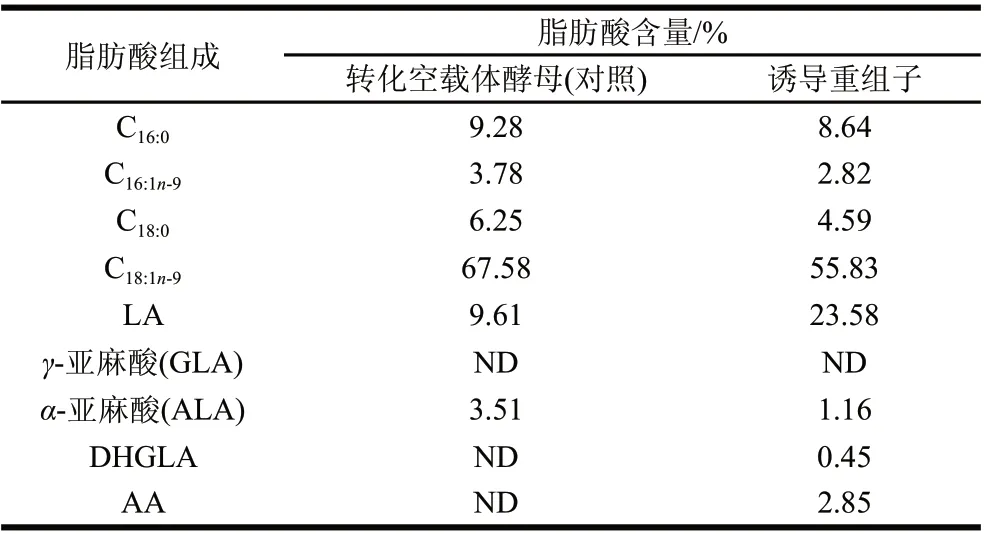
表 1 转化Δ5去饱和酶基因的酵母的脂肪酸成分分析(n=3)Table 1 Fatty acid composition of recombinant P. pastoris GS115 (n=3)
3 讨 论
花生四烯酸(AA)是一种人体必需的多不饱和脂肪酸,对婴儿的大脑发育尤其重要[8]。微生物发酵是生产AA最重要的方式,高产菌株的筛选和发酵工艺的改进可以提高微生物发酵生产AA的产量[9-10],利用构建工程菌株可以增加AA生产菌株的来源。本研究以实验室筛选的高山被孢霉W15菌株为出发材料,通过RT-PCR的方法克隆了与AA合成相关的Δ5去饱和酶基因,BLAST结果表明,该基因与参考序列的同源性为90%,与GenBank所有提交序列(AF067654)的同源性最高为91%,推导的氨基酸序列与报道的氨基酸序列的同源性达到了95%,说明同一物种在进化过程中,Δ5去饱和酶基因的核苷酸序列变化较大,但它们编码的氨基酸序列相对较为保守,这在一定程度上体现了物种的变异是一个长期的、缓慢的过程。对Δ5去饱和酶基因推导的氨基酸序列进行分析显示,其N末端存在去饱和酶家族广泛存在的细胞色素b5结构域及保守的HPGG氨基酸序列,同时还存在3个保守的组氨酸富集区,这一结果在其他的去饱和酶中也有发现[11-12]。
毕赤酵母表达系统是目前应用较多的一种有效的外源基因表达系统。根据载体的不同,可进行胞内表达或胞外分泌表达,其生长过程中合成多种饱和和不饱和的脂肪酸,因此,是进行研究多不饱和脂肪酸表达的系统之一[13-15]。本研究将克隆的Δ5去饱和酶基因连接到载体上后转入毕赤酵母,在添加特异性底物双高γ-亚麻酸的前提下,生成了占总脂肪酸2.85%的AA,证明该基因具有催化的活性。但AA的产量很低,根据对基因序列和推导的氨基酸序列的分析,通过改变基因中部分碱基,从而改变其氨基酸组成及酶分子的结构,可能会达到提高AA产量的目的。另外,构建产AA的基因工程菌,必须要考虑基因表达载体及工程菌产物对人、动物和环境的安全。一般认为,安全的微生物基因作为载体,修饰后不留下任何抗生素基因才是安全的[16]。本实验中所用到的毕赤酵母表达载体pPIC3.5K具有氨苄青霉素和卡那霉素两个抗性基因,在进行外源基因表达时还需要添加甲醇做诱导,因此,使用毕赤酵母表达系统生产供人类利用的产物时,需要对表达载体进行改造,消除抗生素基因,改变与甲醇诱导相关的基因序列和选择其他安全的诱导物,保证产物对人类的安全。
[1] 姚昕, 秦文, 齐春梅, 等. 花生四烯酸的生理活性及其应用[J]. 粮油加工与食品机械, 2004(5): 57-59.
[2] 丁兆坤, 刘亮, 许友卿. 二十碳四烯酸研究[J]. 水产科学, 2007,26(12): 684-688.
[3] PIOMELLI D, VOLTERRA A, DALE N, et al. Lipoxygenase metabolites of arachidonic acid as second messengers for presynaptic inhibition of aplysia sensory cells[J]. Nature, 1987, 328: 38-43.
[4] 林树新, 於峻. 花生四烯酸代谢物对呼吸道感受器的作用[J]. 生理学报, 2007, 59(2): 141-149.
[5] MICHAELSON L V, LAZARUS C M, GRIFFITHS G, et al. Isolation of a delta5-fatty acid desaturase gene from Mortierella alpina[J].Journal of Biological Chemistry, 1998, 273(30): 19055-19059.
[6] KOZAK M. Compilation and analysis of sequences upstream from the translational start site in eukaryotic mRNAs[J]. Nucleic Acids Research, 1984, 12(2): 857-872.
[7] 朱敏, 刘智, 余龙江, 等. 高山被孢霉Δ5去饱和酶基因的分离与验证[J]. 遗传学报, 2005, 32(9): 986-992.
[8] 詹现璞, 吕银德, 赵俊芳. 花生四烯酸在乳制品中的应用[J]. 中国食品添加剂, 2009(4): 155-159.
[9] 朱路英, 张学成, 宋晓金. n-3多不饱和脂肪酸DHA、EPA研究进展[J]. 海洋科学, 1997, 31(11): 78-85.
[10] 张燕鹏, 黄凤洪, 杨湄, 等. 发酵法生产多不饱和脂肪酸[J]. 中国生物工程杂志, 2007, 27(4): 139-145.
[11] SAKURADANI E, KOBAYASHI M, SHIMIZU S. Delta 6-fatty acid desaturase from an arachidonic acid-producing Mortierella fungus-gene cloning and its heterologous expression in a fungus,Aspergillus[J]. Gene. 1999, 238(2): 445-453.
[12] WAN Xia, ZHANG Yinbo, WANG Ping, et al. Production of gammalinolenic acid in Pichia pastoris by expression of a delta-6 desaturase gene from Cunninghamella echinulata[J]. Journal of Microbiology and Biotechnology, 2009, 19(10): 1098-1102.
[13] 李明春, 孙颖, 张琦, 等. 高山被孢霉Δ6脂肪酸脱氢酶基因在毕赤酵母中的胞内表达[J]. 生物工程学报, 2004, 20(1): 34-38.
[14] LIU Jianmin, LI Dianrong, YIN Yongtai, et al. Δ6desaturase from Mortierella alpina: cDNA cloning, expression, and phylogenetic analysis[J]. Biotechnology Letters, 2011, 33(10): 1985-1991.
[15] LI Yuntao, LI Maoteng, FU Chuhua, et al. Improvement of arachidonic acid and eicosapentaenoic acid production by increasing the copy number of the genes encoding fatty acid desaturase and elongase[J].Biotechnology Letters, 2009, 31(7): 1011-1017.
[16] 张光一, 李树立, 刘增然. 食品级乳酸工程菌的研究进展[J]. 食品与发酵工业, 2005, 31(6): 73-75.

