葡萄糖与赖氨酸美拉德反应产物的抗氧化性研究
赵 晶,张宏坤,马丹雅,* ,张 岚,徐 迪
(1.黑龙江东方学院,黑龙江哈尔滨150086;2.东北农业大学,黑龙江哈尔滨150030)
美拉德反应(Maillard Reaction)或非酶褐变反应(non-enzymatic browning reaction)是食品中的氨基化合物(胺,氨基酸,肽和蛋白质)和羰基化合物(糖类)在食品加工和贮藏过程中发生的反应,由法国著名科学家L.C.Maillard 于1912 年发现的,因反应最终生成棕色物质,故又称为“褐变”反应。这一反应普遍存在于食品加工和贮存过程中,是加工食品(如焙烤类食品)的色泽和浓郁芳香风味的主要来源,因此在食品加工生产上有着比较广泛的应用,尤其是合成食用香精,主要是利用美拉德反应制备[1]。美拉德反应产物除了能提供给食品特殊的气味外,还具有抗氧化、抗诱变、抗病毒等特性[2-3],尤其是抗氧化活性,具有取代传统合成抗氧化剂的潜力,这是因为美拉德反应产物是食品加工和贮藏过程中自身形成的一类物质,可以认为是天然的。本实验采用葡萄糖与赖氨酸在一定条件下进行美拉德反应,制备美拉德反应产物,以美拉德反应产物对DPPH 自由基的清除率和超氧阴离子O2-·清除率来判断美拉德反应产物的抗氧化能力,进而为新型抗氧化剂的研究与开发提供一定的理论参考。
1 材料与方法
1.1 材料与仪器
L-赖氨酸(分析纯) 郑州鸿祥化工有限公司;葡萄糖(分析纯) 山东西王生化有限公司;邻苯三酚(分析纯)、氢氧化钠(分析纯)、碳酸氢钠(分析纯)、三氯化铁(分析纯)、铁氰化钾(分析纯)、水杨酸(分析纯) 天津科密欧;DPPH 西安沃尔森生物技术有限公司。
S54 型紫外分光光度计 上海棱光技术有限公司;DKS-11 型电热恒温水浴锅 上海精密科学仪器有限公司;TDL-40B 台式离心机 上海安亭科技仪器厂;98-1-B 型电子调温电热套 天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 美拉德反应产物的制备
1.2.1.1 不同反应时间下制备MRPs 称取L-赖氨酸1.000g(L-赖氨酸中氨基的物质量为0.0137mol)于平底烧瓶中,并加入150mL 蒸馏水使之完全溶解,而后加入葡萄糖4.922g(即葡萄糖中羰基的物质量为0.0273mol),使L-赖氨酸的氨基与葡萄糖的羰基的物质量之比为1∶2,溶解后用0.2mol/L 的NaOH 调节pH8,在100℃下回流反应。并在0.5、1、2、4、6、8、10h 取样,得到不同反应时间下的MRPs,放入4℃冰箱内待测。
1.2.1.2 不同起始pH 下制备MRPs 使L-赖氨酸的氨基与葡萄糖的羰基的物质量之比为1 ∶2。用0.2mol/L 的NaOH 调节溶液的pH 分别6、7、8、9,在100℃下回流8h 取样。
1.2.1.3 不同反应温度下制备MRPs 使L-赖氨酸的氨基与葡萄糖的羰基的物质量之比为1 ∶2,调节pH9,在不同温度下(70、80、90、100℃)回流8h 取样。1.2.1.4 不同反应浓度下制备MRPs 称取L-赖氨酸1.000g 4 份(L - 赖氨酸中氨基的物质量为0.0137mol)于平底烧瓶中,并加入150mL 蒸馏水使之完全溶解,而后分别加入葡萄糖4.922、2.461、1.231、0.822g,即葡萄糖中羰基的物质量分别为0.0273、0.0137、0.0068、0.0046mol,使L-赖氨酸的氨基与葡萄糖的羰基的物质量之比为1 ∶2、1 ∶1、2 ∶1、3∶1。用0.2mol/L 的NaOH 调节反应溶液pH 分别为9,在温度100℃条件下回流反应8h 后取样。
1.2.2 对O2-·清除率的测定 将4.50mL 0.1mol/L Tris-HCl 缓冲液(pH8.2)、MRPs 样液1mL 和蒸馏水2.4mL 混匀,25℃下保温10min 后加入0.1mL 6mmol/L邻苯三酚,计时,摇匀,准确反应3min 后,加入10mol/HCl 溶液0.1mL,终止反应,以蒸馏水为参比,在325nm 下测定吸光值A。清除率越大抗氧化能力越强。
清除率(%)=(A0-Ai)/A0×100
式中:A0为用水代替样液时测得的吸光度;Ai为不同样液测得的吸光度。
1.2.3 对DPPH·清除率的测定 取MRPs 样液2.5mL及2 ×10-2mol/L 的DPPH 溶液2.5mL 加入同一具塞试管中摇匀,于室温下密闭静置30min,用无水乙醇与水混合液(体积比为1∶1)作参比,于517nm 波长处测定吸光度[4],清除率越大抗氧化能力越强。
清除率(%)=[1-(Ai-Aj)/A0]×100
式中:A0为未加MRPs 时DPPH 溶液的吸光度;Ai为加MRPs 后DPPH 溶液的吸光度;Aj为MRPs 的吸光度。
2 结果与分析
2.1 反应时间的影响
超氧阴离子有一定的毒副作用,由多种生物反应和光化学反应产生,它还能分解形成更强的活性氧化物质,如单线态氧和羟自由基,导致脂质过氧化。邻苯三酚在碱性条件下能迅速自氧化,释放超氧阴离子,生成有色的产物。当有自由基清除剂存在时,可清除超氧阴离子,阻止有色产物的积累[5]。
DPPH 在有机溶剂中是一种稳定的自由基,其结构中含有3 个苯环,氮原子上有1 个孤对电子,其乙醇溶液呈紫色,在517nm 附近有强吸收。当有自由基清除剂存在时,DPPH·的单电子由于被配对,DPPH·浓度减小而使其颜色变浅,在517nm 波长处的吸光度变小,这种颜色变浅的程度与配对电子数成化学计量关系,因而可用分光光度法进行定量分析[6]。
由图1 结果可知,随着反应时间的延长,MRPs对O2-·清除率在6h 前是显著增强的,从6h 以后MRPs 对O2-·清除率有个缓慢下降的趋势,MRPs 对O2-·清除率可能与其分子中的活性羟基和氨基有关[7]。在6h 前MRPs 分子中活性的羟基和氨基是逐渐增多的,通过6h 反应体系中的氨基与羰基进行大量缩合使体系中活性氨基明显减少,因此对O2-·清除率也就下降了。
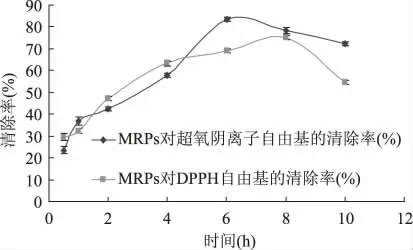
图1 反应时间对MRPs 清除O 2-·和DPPH·的影响Fig.1 Effect of reaction time on MRPs scavenging ratio O 2-·and DPPH·
同时从图1还可知,MRPs 对DPPH·的清除率是随着反应时间的延长而越来越强的,当反应时间达到8h 时,其反应产物的DPPH·清除率达到最高。因美拉德反应达到一定时间,美拉德反应中间产物与氨基化合物进行醛基-氨基反应最终生成类黑精,其短肽含有抗氧化活性的支链氨基酸,而且在产生类黑精的同时,有一系列的美拉德反应中间体-还原酮类物质及杂环类化合物生成,这些产物也具有抗氧化等活性[8]。
综合MRPs 对两种清除率反应时间的考虑,MRPs 对O2-·清除率在6h 达到最大,但在8h 稍微有所下降,而MRPs 对DPPH·的清除率在反应8h 已经达到最大,所以可以认为反应8h 为较佳条件。
2.2 反应pH 的影响
样品在反应开始时是无色的,一经加热后,均有从白色到浅黄色、黄色、橘色最后为褐色的不同程度的颜色渐变过程。样品色泽的变化速率随样品初始pH 的增加而增加。从图2 可知随着反应初始pH 的增大,MRPs 对O2-·及DPPH·的清除率是逐渐增大的,即抗氧化的能力也是逐渐增强的。在pH6~7 偏酸性的环境中,无论是O2-·还是DPPH·的清除率增加得都比较平缓。而当pH7~8 偏碱性时清除率曲线的斜率很大,说明清除率增加的幅度很快,主要原因是因为氨基在较低pH 环境中质子化,不能进行亲核进攻,只有不带电的氨基能够与羰基缩合。所以,酸性环境中羰氨缩合速率很低。羰氨缩合后,糖通过反醇醛、烯醇化和脱水反应进行降解,这些反应都是具有碱催化作用的[9],所以美拉德反应速率随介质pH 的升高而增大。本实验选择赖氨酸与葡萄糖为实验材料,赖氨酸本身就是一种碱性氨基酸是有利于美拉德反应的,从图2 也可以看出pH8~9 时MRPs对O2-·及DPPH·的清除率是平缓增加的,所以选择初始pH9 的反应条件是比较合理的。
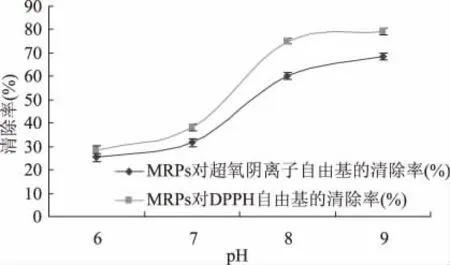
图2 pH 对MRPs 清除O 2-·和DPPH·的影响Fig.2 Effect of pH on MRPs scavenging ratio O 2-·and DPPH·
2.3 反应温度的影响
美拉德反应是十分复杂的化学过程,反应条件对MRPs 抗氧化能力的影响也越来越受到关注。美拉德反应中温度是一个非常重要的因素,随着反应温度的升高,美拉德反应的速度大为加快。且温度较高时,还可产生许多香味物质,这对MRPs 的抗氧化作用是很有帮助的。
由图3 可见,不同温度加热反应得到的MRPs 对O2-·和DPPH·的清除率也不同,清除率随温度的升高而增加,即抗氧化能力增强。70℃清除率低,100℃时清除率明显增加,说明低于100℃时,反应温度越高,反应越剧烈,颜色越深,MRPs 对O2-·和DPPH·清除率越大,抗氧化能力就越强。因为温度高有利于美拉德反应,温度越高在较短时间内就能生成类黑精,还原酮及一系列含N、S 的杂环化合物,这些物质都具有清除O2-·和DPPH·的能力。因而根据实验数据和相关理论,认为反应100℃时MRPs 对O2-·和DPPH·的清除能力较好。
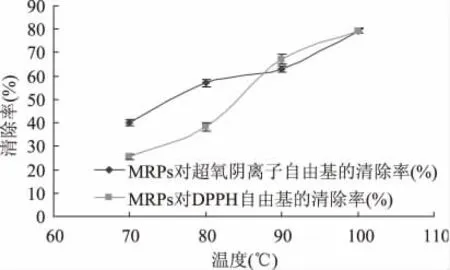
图3 温度对MRPs 清除O 2-·和DPPH·的影响Fig.3 Effect of reaction temperature on MRPs scavenging ratio O 2-·and DPPH·
2.4 反应物浓度的影响
葡萄糖和赖氨酸的不同浓度代表反应体系中羰基与氨基的比例不同。本实验设计的氨基与羰基比例分别是1∶2、1∶1、2∶1、3∶1,由图4 可知在氨基与羰基比例为1∶2 时,MRPs 对O2-·和DPPH·的清除能力较强,此时反应体系中氨基所占比例较小,原因可能是因为氨基的增多使分子内氨基和羧基会失水形成内酰胺而降低了参与美拉德反应的氨基的物质量,使褐变速率减缓,那么MRPs 对O2-·和DPPH·清除能力就变小了,所以在氨基与羰基比为1∶2 时,为制备具有抗氧化MRPs 较佳条件之一。
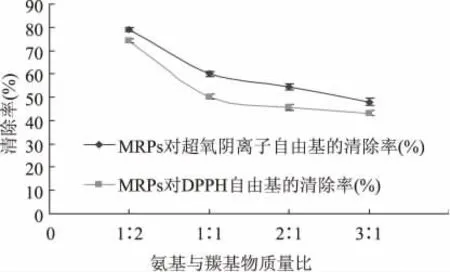
图4 反应物浓度对MRPs 清除O 2-·和DPPH·的影响Fig.4 Effect of reaction concentration on MRPs scavenging ratio O 2-·and DPPH·
3 结论
本实验以赖氨酸和葡萄糖三种不同比例发生美拉德反应制备了其MRPs,随反应的进行,测定在不同pH 和温度条件下的抗氧化能力。通过单因素实验结果分析,得出最佳反应条件是:温度100℃,时间8h,pH9,氨基与羰基比为1∶2 时,MPRs 对O-2·清除率和DPPH·清除率可分别达到82.35%和71.12%,此时MPRs 的抗氧化能力最强。
在美拉德反应体系中,产物的抗氧化能力同时受多种因素控制,选择适当的反应条件可以提高MRPs 的抗氧化能力。美拉德反应产物具有较强的抗氧化活性,并且是食品加工和储藏过程中自身产生的一类物质,可以认为是天然的,这给寻找和应用天然抗氧化剂提供了新的思路。但因为MRPs 的具体组成、结构和性质等依然尚未十分清楚,且对其抗氧化机理也有待于进一步研究,所以作为商业应用的MRPs 抗氧化剂的问题还有待进一步深入研究。
[1]马志玲,王延平,吴京洪.模式美拉德反应产物抗氧化性能的研究[J].中国油脂,2002,27(4) :68-71.
[2]Borrelli R C,Mennella C,Barba F,et al.Characterization of coloured compounds obtained by enzymatic extraction of bakery products[J].Food Chem Toxicology,2003,41:1367-1374.
[3]H wang I G,Kim H Y,Woo K S,et al.Biological activities of Maillard reaction products( MRPs) in a sugar-amino acid model system[J].Food Chem,2011,126:221-227.
[4]王惠英,孙涛,周冬香,等.L-敕氨酸与D-核糖的模式美拉德反应及其产物抗氧化性能研究[J].食品科技,2008,29(5) :112-115.
[5]姚倩,孙涛,徐轶霞.壳聚糖/壳寡糖衍生物的制备及其抗氧化性能研究[J].食品与生物技术学报,2009,28( 2) :188-191.
[6]Lu Y R YEAP FooL.Antioxidant activities of polyphenols from sage( Salvia oficinalis) [J].Food Chem,2001(2) :197-202.
[7]Xie Wenming,Xu Peixin,Liu Qing.Antioxidant activity of water- soluble chitosan derivatives[J]. Bioorganic Medicinal Chemistry Letters,2001,11(13) :1699-1701.
[8]Yen G C,Chau C F,Li D J.Isolation and characterization of most antimutagenic Maillard reaction products derived from glucose and lysine[J].Food Chemistry,1993,41:771-776.
[9]Shibamoto T,Bernhard R A. Investigation of pyrazine formation pathway in glucose- ammonia[J]. Agriculture and Biological Chemistry,1977,41:143-153.

