转MYB基因小麦耐旱性的初步分析
周淼平, 周小青, 姚金保, 张增艳, 张 鹏, 杨学明, 马鸿翔
(1.江苏省农业科学院生物技术研究所,省农业生物学重点实验室,江苏 南京 210014;2.中国农业科学院作物科学研究所,北京100081)
MYB蛋白是植物中数量最多且功能最多样化的转录因子家族,主要参与调控植物细胞周期、器官形态建成、次生代谢以及对逆境胁迫反应的应答,根据MYB结构域重复数的不同可将其划分为MYB1R、R2R3-MYB、R1R2R3MYB以及4RMYB 等4类[1]。目前MYB基因及其功能在拟南芥、水稻和棉花等作物中已进行了广泛研究[1-2]。小麦中MYB基因功能的研究相对滞后,目前发现的MYB基因多参与干旱和盐害等非生物逆境胁迫反应。Chen等[3]克隆了23个MYB基因片段,但仅有6个得到完整开放阅读框,用30%PEG处理后,6个MYB基因表达特性各不相同。Cai等[4]通过小麦EST序列电子克隆了36个R2R3-MYB型MYB基因。王转等[5]从小麦水分胁迫诱导表达的cDNA文库中检测到2个MYB基因。利用TaMyb2基因特异引物,贾东升等[6]克隆了3种类型TaMyb2的cDNA序列,转化拟南芥的结果表明,TaMYB2A基因可以抵御干旱、盐以及冷害的胁迫[7]。Rahaie等[8]分析了 10 个MYB基因对盐和干旱胁迫的应答,发现4个MYB基因在短期盐胁迫后小麦根部表达上调,3个MYB基因在长期盐胁迫后基因表达上调,其中TaMYBsdu1基因受长期干旱胁迫后在小麦的根和叶中显著上调,可能是小麦对盐和干旱胁迫应答的主要调节因子。Zhang等[9]克隆了60个小麦MYB基因并进行表达分析,发现过表达TaMYB32基因可提高转基因拟南芥的耐盐性。同样TaMYB73在转基因拟南芥中过表达也增加了对盐胁迫的抵御[10]。这些研究表明,MYB在植物的抗旱耐盐中具有重要作用。
中国农业科学院作物科学研究所根据拟南芥AtMYB108基因同源小麦EST序列克隆了小麦TaPIMP1基因,该基因具有典型的MYB基因特点。我们将该基因导入小麦扬麦158,发现转基因株系的纹枯病抗性有所提高[11]。由于AtMYB108基因不仅参与拟南芥抗病性的调节,同时也参与拟南芥的抗逆反应,所以转基因株系的抗旱耐盐性有没有提高值得关注。本研究拟采用转基因纯合株系,通过模拟干旱处理,对部分耐旱性状指标进行初步分析,以探讨该基因在小麦耐旱转基因种质培育方面的应用潜力。
1 材料与方法
1.1 转基因材料
纯合转TaPIMP1基因小麦株系B64和B208以及转基因受体对照扬麦158由本研究室保存。
1.2 模拟干旱对小麦TaPIMP1基因表达的影响
将扬麦158、B64和B208的1叶1心幼苗置于含20%(质量体积比)PEG6000的Hogland营养液中模拟干旱胁迫处理,分别于 0 h、2 h、4 h、8 h、24 h各取5株叶片样品,等量混合,液氮中磨碎,采用AxyPre RNA提取试剂盒(Promega公司)提取RNA,PrimeScript反转录试剂盒(TaKaRa公司)合成cDNA。qRT-PCR采用SYBR@GreenI(TaKaRa公司)在LightCycler2.0荧光定量PCR仪(Roche公司)上进行,内参照基因采用actin基因,基因的相对表达量采用2-△△Ct法计算。TaPIMP1基因扩增引物为5'-ACGGACAACGAGGTCAAGAAC-3'和5'-GAAATGGGCTCCGTGCG-3';actin基因扩增引物为5'-CACTGGAATGGTCAAGGCTG-3'和5'-CTCCATGTCATCCCAGTTG-3'。
1.3 模拟干旱对种子萌发和幼苗生长的影响
选取籽粒饱满、大小一致的扬麦158、B64和B208种子,分别于无菌水和无菌水配置的20%(质量体积比)PEG6000溶液中浸泡12 h后,转移至垫有滤纸的9 cm培养皿中,每皿50粒左右,置于25℃培养箱中黑暗萌发,3 d后计算发芽率。
选取在无菌水中萌发露白的扬麦158、B64和B208种子置于垫有滤纸的9 cm培养皿中,分别添加无菌水和20%(质量体积比)PEG6000溶液20 ml,于25℃、70%湿度的植物生长箱中培养7 d后,测量胚芽鞘长度、胚根长度,同时调查胚根数。
1.4 模拟干旱对相关生化指标的影响
取形态长势一致的5叶期对照植株和转基因株系植株,洗净根部后置于1/2MS营养液中培养2 d,再移入含0、5%、10%、15%和20%(质量体积比)PEG6000的营养液中进行不同强度模拟干旱处理,12 h后测定叶片相对含水量、可溶性糖含量、丙二醛(MDA)含量以及过氧化物酶(POD)活性。
1.4.1 小麦叶片相对含水量的测定 参照Siddigue等[12]方法进行,计算公式为:相对含水量=(鲜质量-干质量)/(饱和质量-干质量)×100%。
叶片鲜质量在取样后2 h内测定,将叶片于20℃蒸馏水中浸泡18 h后测定饱和质量,70℃烘箱中烘烤72 h后测定干质量。
1.4.2 叶片可溶性糖 按张志安等的方法[13]进行,取0.3 g叶片,置于10 ml蒸馏水中,沸水浴30 min,提取液过滤,并定容至25 ml。吸取0.5 ml提取液于试管中,依次加入蒸馏水1.5 ml、9%苯酚1.0 ml和浓硫酸5.0 ml,摇匀,室温下放置30 min显色,485 nm波长下测定光密度,计算可溶性糖含量。
1.4.3 叶片MDA含量 采用张志安等方法[13],取1 g叶片,采用石英砂于2 ml 5%TCA中研磨至匀浆,加入8 ml 5%TCA进一步研磨,匀浆以4 000 r/min离心10 min,吸取上清 2 ml,加入 2 ml 0.6%TBA溶液,混匀,沸水浴10 min,3 000 r/min离心15 min,上清测定532 nm、600 nm、450 nm 处的吸光度值。提取样品中 MDA浓度,由 C(μmol/L)=6.45(A532-A600)-0.56A450公式计算,根据样品稀释倍数换算成叶片中MDA含量。
1.4.4 叶片 POD活性 按张志安等方法[13]进行,取1 g叶片于研钵中,加适量磷酸缓冲液研成匀浆,4 000 r/min离心15 min,上清定容至100 ml;于比色杯中加入反应混合液3 ml和上述提取酶液1 ml,测量波长470 nm下的吸光度值,每隔1 min读数1次。POD活性以1 min内A470变化0.01为1个过氧化物酶活性单位(U)。根据一定反应时间内吸光度的变化、取样质量和提取液稀释倍数计算POD活性。
1.5 统计分析
试验获得的数据采用SAS软件进行显著性分析。
2 结果
2.1 模拟干旱胁迫对小麦TaPIMP1基因表达的影响
PEG6000模拟干旱处理前,对照扬麦158的TaPIMP1基因有一定的本底表达,2个转基因株系B208和B64的表达水平基本一致,明显比扬麦158的表达水平高,主要是因为导入的TaPIMP1基因由玉米ubiquitin组成型启动子驱动,在转基因植株内维持了一定量的表达(图1)。20%PEG6000处理时,对照和转基因株系的TaPIMP1基因均经历了明显的先下调再逐渐上调的过程,处理24 h,转基因株系B64的表达明显高于B208和对照扬麦158。先前的研究表明,TaPIMP1基因表达与小麦水分亏缺相关,干旱处理后,小麦TaPIMP1基因表达明显上调[14]。本研究模拟干旱处理采用的是1叶1心期的幼苗,是否由于生长时期的不同而导致TaPIMP1基因的表达方式产生一定的差异,有待进一步探讨。但干旱处理引起TaPIMP1基因表达的剧烈波动,表明该基因与小麦的耐旱性有关联。

图1 模拟干旱处理后转基因株系及其对照TaPIMP1基因的表达分析Fig.1 Expressions of TaPIMP1 gene in transgenic lines(B208 and B64)and control(Yangmai 158)after treatment of PEG6000 osmotic stress
2.2 模拟干旱胁迫对种子萌发和幼苗生长的影响
20%PEG6000胁迫处理后,对照扬麦158种子的萌发受到明显抑制,发芽率由100%下降到68.5%;胁迫处理对转基因株系的种子萌发影响较小,B64株系发芽率仍为100%,B208株系虽然由100%下降到83.3%,但仍然极显著高于扬麦158,表明转基因株系在种子萌发时期的耐旱能力比受体对照有所提高。
PEG6000胁迫处理对转基因株系和受体对照幼苗的胚根数影响不明显,但胚芽鞘和胚根的伸长受到严重抑制。2个转基因株系胚芽鞘和胚根的伸长明显好于对照扬麦158(表1),表明转基因株系幼苗对干旱的耐受能力优于扬麦158。

表1 PEG6000胁迫对转基因株系和受体对照种子萌发后生长形态指标的影响Table 1 Effects of PEG6000 osmotic stress on seedling growth of transgenic plant(B64 and B208)and control(Yangmai 158)
2.3 模拟干旱胁迫对叶片相对含水量的影响
采用不同浓度PEG6000模拟干旱胁迫处理12 h,发现转基因株系B64和B208与对照扬麦158的表现不尽相同。在0~15%浓度下,对照和转基因株系之间的表型变化差异不大,B64株系植株生长状况稍好,但在20%的浓度下,受体对照扬麦158植株的萎蔫程度明显比转基因株系严重。
取模拟干旱处理后的小麦叶片,测定叶片相对含水量,发现5%低浓度处理时,转基因株系与对照差异不明显,10% ~20%浓度下,对照扬麦158叶片相对含水量明显低于转基因株系(表2)。植物组织含水量对植物的生理活动有重要影响,干旱的直接作用就是引起植物组织失水,导致各种代谢活动的生长紊乱,相对含水量是评价干旱胁迫程度的稳定参数[15]。转基因株系叶片相对含水量明显高于扬麦158,表明转基因株系的耐旱性好于受体对照。
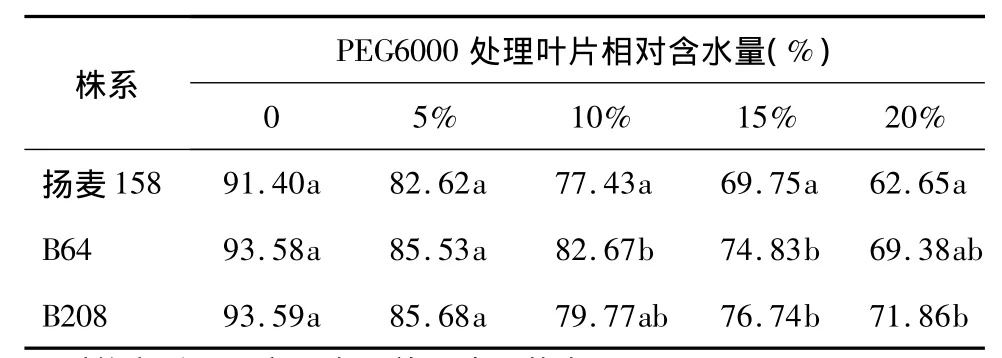
表2 转基因小麦株系和受体对照叶片相对含水量比较Table 2 Comparison of relative water content in the leaves of transgenic lines(B64 and B208)and control(Yangmai 158)
2.4 模拟干旱胁迫对叶片可溶性糖含量的影响
干旱胁迫下,植物体内的可溶性糖会大量积累,以缓解外界胁迫对植物造成的伤害[16-20]。由表3可以看出,当PEG6000浓度为5%时,转基因株系B64和B208与对照扬麦158的可溶性糖含量差异不大;随着PEG6000浓度的提高,转基因株系与对照的可溶性糖含量都有增加趋势;当浓度达到10%时,转基因株系与对照的可溶性糖含量差异达到显著水平;当浓度达到20%时,转基因B64株系和B208株系的可溶性糖含量比未干旱胁迫处理分别增加了1.43倍和1.29倍,对照植株增加1.04倍,转基因B64株系和B208株系的可溶性糖含量分别是对照扬麦158的1.47倍和1.29倍,显示转基因株系对干旱胁迫的缓解能力有所提升。
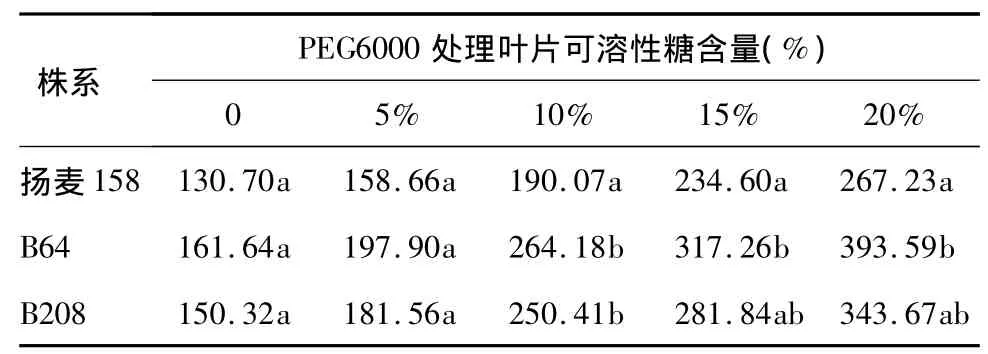
表3 转基因小麦株系和受体对照叶片可溶性糖含量比较Table 3 Comparison of soluble sugar in the leaves of transgenic lines(B64 and B208)and control(Yangmai 158)
2.5 模拟干旱胁迫对叶片MDA含量的影响
MDA是膜脂过氧化的最终产物,是膜系统受伤害的重要标志之一,其含量可以表示膜脂过氧化作用的程度。由表4可以看出,不同浓度PEG6000胁迫下,转基因株系B64和B208和对照扬麦158的叶片MDA含量均呈增加趋势,表明干旱胁迫对受试株系的膜系统造成了伤害,并且浓度愈高伤害愈重。5%PEG6000处理时,转基因株系与对照叶片的MDA含量就出现了显著差异。不同浓度PEG6000处理,转基因株系的MDA含量都没有超过对照;20%浓度处理时,受体对照植株扬麦158的MDA含量已经是未胁迫处理的2.8倍,而转基因株系B64和B608的MDA含量是未胁迫处理的1.8倍,表明转基因株系的膜脂受损程度比对照小,也从侧面说明转基因植株的耐旱能力优于受体对照。

表4 转基因小麦株系和受体对照叶片丙二醛含量比较Table 4 Comparison of MDA content in the leaves of transgenic lines(B64 and B208)and control(Yangmai 158)
2.6 模拟干旱胁迫对叶片POD活性的影响
正常情况下,植物细胞内自由基的产生与清除处于一种动态平衡,一旦这种平衡遭到破坏,自由基便产生积累,POD是植物体内担负清除H2O2的主要酶类之一,它能催化H2O2氧化其他底物后产生H2O。由表5可知,在不同浓度PEG6000胁迫下,转基因株系B64和B208和对照扬麦158叶片的POD活性呈现先下降再升高的趋势,不同处理转基因株系与对照的POD活性差异没有达到显著水平。
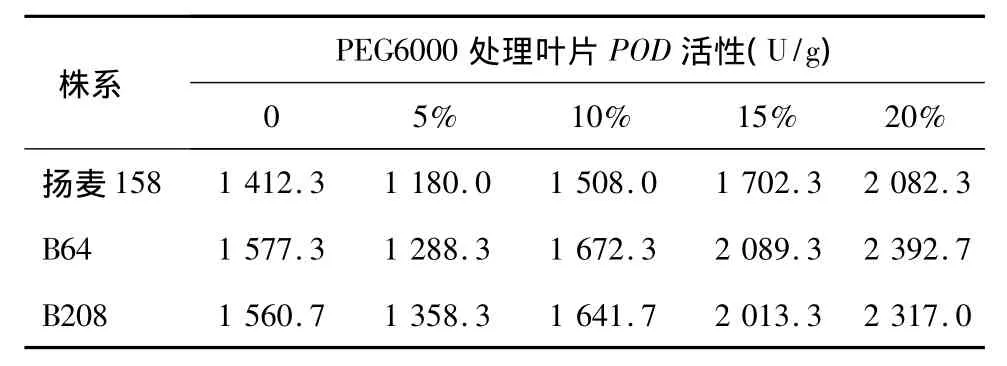
表5 转基因小麦株系和受体对照叶片POD活性比较Table 5 Comparison of POD activity in the leaves of transgenic lines(B64 and B208)and control(Yangmai 158)
3 讨论
MYB蛋白是植物的重要调控因子,部分MYB基因参与植物的抗旱调节。例如厚叶旋蒴苣苔中的BcMYB1可通过不依赖ABA的途径参与调控基因表达,从而对干旱产生应答,该基因同时也能对PEG、高盐、低温等胁迫产生一定程度的应答[21]。拟南芥的AtMYB2基因在干旱胁迫下,可作为ABA诱导的转录激活子发挥作用,在其他一些逆境诱导下AtMYB2表达增强的同时,干旱应答基因rd22和AtADH1的表达也得到加强[22]。AtMYB60参与植物的耐旱胁迫过程也被证实[23]。TaPIMP1基因是根据拟南芥AtMYB108小麦同源EST序列克隆而来,研究发现拟南芥AtMYB108除了可抑制番茄灰霉病菌(Botrytis cinerea)和黑斑病菌(Alternaria brassicicola)等病原真菌的生长,还受高盐、干旱、氧胁迫及外源ABA诱导[24]。本研究结果表明,TaPIMP1基因也参与了小麦对干旱胁迫的应答,TaPIMP1基因过表达的转基因株系在模拟干旱条件下,其种子的萌发、幼苗的生长以及成株期叶片的相对含水量、可溶性糖含量、MDA含量等指标均优于受体对照扬麦158,表明TaPIMP1基因的组成型表达提高了转基因株系的抗旱性。
中国水资源短缺,人均水资源只有世界平均的1/4。农业用水占中国用水总量的70%,但农业灌溉水平均利用率低,不及发达国家的一半。在中国北方,小麦用水已占农业用水的70%,因此,节水已成为中国北方小麦生产的重要研究课题[25]。小麦生产中除了采取节水栽培和管理措施外,耐旱小麦品种的培育和应用非常关键。优良小麦品种的培育需要特异种质材料的支撑,除了加强从小麦及其近缘的种质材料中筛选优异抗旱节水种质材料外,拓宽与抗旱节水相关优异基因的发掘范围也非常重要,转基因技术是实现这一目标的重要手段之一。高世庆等[26]将大豆GmDREB基因导入鲁麦22号中,转基因小麦能在10%PEG6000模拟干旱培养基上正常发芽生长;在18%PEG6000溶液处理后,转基因小麦的发芽率比对照明显提高。将大肠杆菌海藻糖-6-磷酸合成酶基因和海藻糖-6-磷酸磷酸酯酶基因的融合基因TPSP导入小麦,发现转基因小麦的海藻糖含量大幅提高;20%PEG6000溶液处理后,转基因株系的脯氨酸含量较对照明显提高,转基因植株表现出较强的抗旱能力[27-28]。将棉花GhDREB导入鲁麦23中也发现转基因株系比对照具有更强的抗旱节水性能[29]。转TaEBP基因小麦株系的抗旱节水性能也明显高于受体对照宁春9号[30]。我们将由玉米ubiquitin组成型启动子驱动的小麦MYB蛋白基因TaPIMP1导入扬麦158,也发现转基因株系的耐旱能力较受体对照有所提高。这些研究表明,转基因方法可以作为常规育种方法的补充和延伸,该方法能打破物种间的界限,将其他物种的有利基因引入到小麦中,提高小麦的耐旱性。
[1]DUBOS C,STRACKE R,GROTEWOLD E,et al.MYB transcription factors in Arabidopsis[J].Trends in Plant Science,2010,15:573-581.
[2]陈 清,汤浩茹,董晓莉,等.植物Myb转录因子的研究进展[J].基因组学与应用生物,2009,28(2):365-372.
[3]CHEN R,NI Z,NIE X,et al.Isolation and characterization of genes encoding Myb transcription factor in wheat(Triticum aestivem L.)[J].Plant Science,2005,169:1146-1154.
[4]CAI H,TIAN S,DONG H.Large scale in silico identification of MYB family genes from wheat expressed sequence Tags[J].Molecular Biotechnology,2012,52:184-192.
[5]王 转,臧庆伟,郭志爱,等.小麦幼苗期水分胁迫所诱导基因表达谱的初步分析[J].遗传学报,2004,31(8):842-849.
[6]贾东升,毛新国,景蕊莲,等.小麦转录因子TaMyb2s的克隆及表达[J].作物学报,2008,34(8):1323-1329.
[7]MAO X,JIA D,LI A,et al.Transgenic expression of TaMYB2A confer enhanced tolerance to multiple abiotic stresses in Arabidopsis[J].Functional & Integrative Genomics,2011,11(3):445-465.
[8]RAHAIE M,XUE G,NAGHAVI M,et al.A MYB gene from wheat(Triticum aestivum L.)is up-regulated during salt and drought stresses and differentially regulated between salt-tolerant and sensitive genotypes[J].Plant Cell Rep,2010,29:835-844.
[9]ZHANG L,ZHAO G,JIA J,et al.Molecular characterization of 60 isolated wheat MYB genes and analysis of their expression during abiotic stress[J].Journal of Experimental Botany,2012,63(1):203-214.
[10]HE Y,LI W,LV J,et al.Ectopic expression of a wheat MYB transcription factor gene,TaMYB73,improves salinity stress tolerance in Arabidopsis thaliana[J].Journal Experimental Botany,2012,63(3):1511-1522.
[11]周淼平,周小青,张增艳,等.TaPIMP1过量表达提高转基因小麦纹枯病抗性的研究[J].核农学报,2011,25(3):421-426.
[12]SIDDIGUE M R B,HAWID A,ISLAM M S.Drought stress effects on water relations of wheat[J].Botanical Bulletin of Academia Sinica,2000,41(1):35-39.
[13]张志安,陈展宇.植物生理学实验技术[M].长春:吉林大学出版社,2008.
[14]ZHANG Z,LIU X,WANG X,et al.An R2R3 MYB transcription factor in wheat,TaPIMP1,mediates host resistance to Bipolaris sorokiniana and drought stresses through regulation of defense-and stress-related genes[J].New Phytologist,2012,196:1155-1170.
[15]SINCLAIR T R,LUDLOW M M.Who taught plants thermodynamics?The unfulfilled potential of plant water potential[J].Aust J Plant Physiol,1985,33:213-217.
[16]吴 杨,贺 俐,贺根和.干旱胁迫下甘蔗幼苗消减文库的构建[J].江苏农业学报,2011,27(5):1148-1150.
[17]姚国才,马鸿翔,姚金保,等.迟播干旱胁迫下不同密度和施肥量对早熟小麦宁麦15产量及其构成因素的影响[J].江苏农业科学,2012,40(10):73-75.
[18]李 屹,黄高峰,孙雪梅.干旱胁迫对菊芋苗期生长的影响[J].江苏农业科学,2012,40(10):75-77.
[19]高小宽,高汝勇.干旱胁迫对野大豆种子萌发和幼苗生长的影响[J].江苏农业科学,2012,40(9):328-329.
[20]单长卷,周 岩.干旱胁迫对小麦济麦20扬花期叶片生理特性的影响[J].江苏农业科学,2012,40(4):95-96.
[21]CHEN B,WANG Y,HU Y,et al.Cloning and characterization of a drought-inducible MYB gene from Boea crassifolia[J].Plant Science,2005,168:493-500.
[22]HOEREN F U,DOLFERUS R,WU Y,et al.Evidence for a role for AtMYB2 in the induction of the Arabidopsis alcohol dehydrogenase gene(ADH1)by low oxygen[J].Genetics,1998,149(2):479-490.
[23]COMINELLI E,GALBIATI M,VAVASSEUR A,et al.Aguardcell-specific MYB transcription factor regulates stomatal movements and plant drought tolerance[J].Curr Biol,2005,15(13):1196-2000.
[24]MENGISTE T,CHEN X,SALMERON J,et al.The BOTRYTIS SUSCEPTIBLE1 gene encodes an R2R3MYB transcription factor protein that is required for biotic and abiotic stress responses in Arabidopsis[J].The Plant Cell,2003,15:2551-2565.
[25]王树安,兰林旺,周殿玺,等.冬小麦节水高产技术体系研究[J].中国农业大学学报,2007,12(6):44.
[26]高世庆,徐惠君,程宪国,等.转大豆GmDREB基因增强小麦的耐旱及耐盐性[J].科学通报,2005,50(23):2617-2625.
[27]李永春,王 潇,陈焕丽,等.转TPSP融合基因小麦植株的获得及抗旱性初步鉴定[J].麦类作物学报,2009,29(2):195-198.
[28]李金花,孙敏善,张春艳,等.转TPSP融合基因小麦的耐旱相关特性[J].植物生理学报,2012,48(1):81-84.
[29]赵洁岚,闵东红,张小红,等.转GhDREB小麦株系“G鲁麦23”抗旱性分析[J].西北植物学报,2011,31(7):1447-1452.
[30]杨 梅,马有志,闵东红,等.小麦转TaEBP基因株系抗旱特性分析[J].干旱地区农业研究,2012,30(2):62-67.

