枫杨幼苗对土壤水分“湿-干”交替变化光合及叶绿素荧光的响应
王振夏,魏 虹,吕 茜,李昌晓,周 珺,高 伟,陈 伟
(三峡库区生态环境教育部重点实验室重庆市三峡库区植物生态与资源重点实验室西南大学生命科学学院,重庆 400715)
三峡大坝的修建给三峡库区的生态环境带来了极大的影响[1]。夏季水位145 m,而冬季水位可高达175 m,形成了落差将近30 m面积达350 km2的水位季节性涨落的消落区[2]。大幅度的水位涨落所带来的不同时期水渍、干旱及“水淹-干旱”交替环境状况将进一步加剧消落区生境的破碎、植被的退化,严重影响三峡库区的安全、健康和可持续发展[3-5]。研究表明,筛选适生树种进行生态修复是一个行之有效的方式[6-7]。其中乡土树种在维持库区的生态环境,确保库岸生态系统生态功能的正常发挥等方面具有重要意义[8-9]。但是,部分乡土树种可能出现不适应新的水分逆境而消亡,因此研究消落区水分环境对三峡库区适生树种的生长及光合特性的影响具有重要的理论和实践意义,研究结果可以为三峡库区消落带的植被恢复提供相应的理论支撑。
枫杨(Pterocarya stenoptera C.DC.)是长江流域一种优良的乡土树种,因其分布广泛、适应能力强、生长速度快而被广泛用于护坡护堤的造林工程中。枫杨在三峡库区也广泛分布,经过长期的生长较能适应库区的气候和土壤环境,但是对于其能否忍受因大坝的修建而带来新的土壤水分干湿交替变化的状况还不清楚。目前对于枫杨的耐水湿研究主要有水淹对枫杨木材特性[10]、气体交换及叶绿素荧光[11]、保护性酶[12]等的影响,而关于土壤水分交替变化对枫杨的光合生理及叶绿素荧光特性的影响还未见报道。为了保证高水位时的航运安全,在三峡库区消落带植被恢复治理中,乔木将被种植在消落带上层(170 m以上区域),故本实验模拟了消落带上层的土壤水分状况,特别设置了水分交替变化组,以枫杨幼苗为实验材料进行了盆栽模拟研究。实验的研究目的为:(1)土壤水分交替变化对枫杨幼苗的影响与单一的水淹或干旱对其的光合及叶绿素荧光特性影响有何异同;(2)面对不同的水分胁迫,枫杨幼苗有何应对策略。
1 材料与方法
1.1 试验材料和地点
2009年6月中旬将生长基本一致的120株枫杨当年实生幼苗移栽入花盆,盆高18 cm,盆口直径23 cm,每盆1株。将土壤(紫色土,取自西南大学生态实验基地内)晒干去除杂质后装盆,每盆土重3.5 kg。将所有实验植株置于重庆市西南大学生态实验基地内(海拔249 m)进行相同条件培养,于8月1日将所有植株移入透明遮雨棚内(棚顶透明,四面通风)进行实验准备。
1.2 试验设计
将平均高度为23 cm的实验幼苗随机分成4组,每组30盆。试验处理分为CK、DR、FL、FD共4组,具体方式详见表1。整个实验分为前期(0—33 d)、中期(34—63 d)和后期(64—78 d)3个阶段。水分处理共分为正常供水、轻度干旱、水淹和复水4种方式。其中,正常供水方式保持田间持水量的70%—80%[13],水淹状态为土壤表面以上5 cm积水,轻度干旱处理为田间持水量的50%—55%(土壤水分含量采用称重法[14]测定),复水处理为恢复至常规供水。淹水处理时将枫杨幼苗置于直径68 cm、高28 cm的大塑料盆内,并向盆内注水至水面超过土壤表面5 cm,每周换水1次。由于实验处理时间为夏季,故FD组由水淹到干旱处理时,放置两天便可以达到轻度干旱状态。从2009年8月5日起分别在处理0 d、33 d、63 d、78 d对各项指标进行测定,每个指标测定4次,每个处理5次重复。

表1 各组水分处理方式Table 1 The ways of soil water treatments
1.3 测定指标及方法
1.3.1 光合参数的测定
于晴朗天气9:00—11:00,选取植株从上到下第3或第4片健康叶片进行一定程度的平铺固定,使用LI-6400便携式光合分析仪(Licor,USA.,2 cm×3 cm红蓝光源叶室)测定净光合速率(Pn),蒸腾速率(Tr),气孔导度(Gs),胞间CO2浓度(Ci)等气体交换参数,并通过计算得到水分利用效率(WUE)和气孔限制值(Ls):WUE=Pn/Tr[15],Ls=1-Ci/Ca[16](Ci为胞间 CO2浓度,Ca 为大气 CO2浓度)。测定前,先用饱和光对植物进行60 min的光诱导。测定时,叶室温度设为25℃,控制光合有效辐射(PAR)为1000 μmol·m-2·s-1,CO2浓度为400 μmol/mol,相对湿度60%—70%。
1.3.2 光合色素含量的测定
选取用于测定光合速率的叶片,称重并记录,采用浸提法[17]用岛津UV-2550型分光光度计分别测定叶绿素a、叶绿素b和类胡萝卜素的吸光值A663、A645和A470,并计算其含量,换算成单位鲜重的含量。总叶绿素含量=叶绿素a含量+叶绿素b含量,每个样本测定5次重复。
1.3.3 叶绿素荧光参数的测定
叶绿素荧光参数的测量与光合参数的测量同天进行,于0:00—4:00使用Li-6400便携式光合分析仪荧光叶室测定叶绿素荧光参数。测量前先将样品暗适应3 h,然后打开检测光(PFD<0.1 mol·m-2·s-1,频率为600 Hz)测定Fo,再打开一次饱和脉冲光(PFD为8000 μmol·m-2·s-1,频率20 KHz,0.8 s,1个脉冲),测定Fm及Fv/Fm。脉冲光结束后打开光化光(PFD为336 μmol·m-2·s-1),等荧光基本稳定时测定Fs,之后再打开一次饱和脉冲光测定Fm',关闭光化光暗适应3s,继以一次远红光(PFD约为5 mol·m-2·s-1,3 s)测定Fo'。光化学猝灭系数(qP)、非光化学猝灭系数(qN)、PSⅡ的实际量子产量(Yield)和电子传递速率(ETR)按下列公式计算:qP=(Fm'-Ft)/(Fm'-Fo),qN=1-(Fm'-Fo')/(Fm-Fo),Yield=(Fm'– Fs)/Fm',ETR=Yield×PFD×0.5×0.84(PFD=336 μmol·m-2·s-1)[18]。
1.4 数据处理
数据统计分析采用Microsoft Excel 2003和 SPSS16.0软件结合进行。使用单因素分析方法(one-way ANOVA)来揭示不同水分处理对枫杨幼苗生理生态特征的影响,并运用LSD检验法检验不同组的各个生理指标显著差异性(α=0.05)。
2 结果与分析
2.1 光合参数的变化
2.1.1 水分处理对枫杨幼苗净光合速率的影响
由图1A可以看出3个处理组的土壤水分条件均显著降低枫杨幼苗的净光合速率。实验前期(0—33 d),FL、FD两组幼苗Pn比同期对照显著下降了38.6%(P<0.05);实验中期(34—63 d),DR、FL、FD3个处理组幼苗的Pn进一步降低,与对照相比分别降低了40.2%、60.3%和76.9%;而实验后期恢复正常供水后,DR和FD两组的Pn恢复迅速,与进一步降低的FL组形成鲜明对比。由此可见,干旱和水淹均对枫杨幼苗的Pn影响较大,但在复水后DR组和FD组都能恢复到较高水平,且随着水淹时间的延长,FL组下降幅度减小,这在一定程度上暗示出枫杨幼苗的抗逆特性。

图1 不同水分条件下枫杨幼苗光合参数的变化Fig.1 Photosynthetic parameters of P.stenoptera seedlings in different water treatments
2.1.2 水分处理对枫杨幼苗气孔导度和蒸腾速率的影响
不同水分处理对枫杨幼苗的Gs和Tr的影响相对较小,且4个实验组的Gs变化趋势与其Tr的变化趋势基本一致(图1)。实验前期,3个处理组都未与对照呈现显著差异;实验中期,FD组的Gs和Tr均是4个实验组中的最低值,显著低于同期对照(P<0.05);实验后期,复水后DR和FD两组的Gs和Tr增加明显,显著高于对照组(P<0.05)。结果表明,“湿-干”交替胁迫对枫杨幼苗的影响要大于单一的干旱或水淹胁迫,面对不同的水分胁迫枫杨幼苗都出现Gs和Tr的降低,复水后DR及FD组的值显著高于对照可能是因为植物“补偿机制”的作用。
2.1.3 水分处理对枫杨幼苗胞间CO2浓度和气孔限制值的影响
3个处理组幼苗均表现出Ci的增加和Ls的降低,两者的变化趋势相反(图1)。实验前期,FL和FD两组的Ci显著高于对照,Ls则显著低于对照;实验中期,3个处理组的Ci都显著高于对照,Ls则均显著低于对照;实验后期,DR组经过复水与对照无显著差异,FL和FD两组仍与对照有显著差异,且整个实验期间FL组的Ci始终为4个实验组中的最大值,而其Ls则为4个实验组的最小值。从结果可以推测长期水淹对枫杨幼苗的Ci及Ls影响要大于短期干旱及干湿交替环境对其的影响。
2.2 水分处理对枫杨幼苗水分利用效率的影响
由图2可知,各处理组的WUE与对照相比都出现了显著的下降。实验前期,FL和FD两组的WUE下降了33.6%(P<0.05);实验中期和后期,3个处理组WUE都显著低于同期的对照,FL组WUE在实验结束时仅为对照的34.3%。由此可知,复水可明显促使枫杨幼苗WUE的恢复,持续水淹对WUE影响最大。
2.3 水分处理对枫杨幼苗光合色素含量的影响
FD组、FL组的总叶绿素含量和类胡萝卜素含量的变化趋势基本一致(图3)。实验前期,FL和FD组总叶绿素含量显著低于对照47%,类胡萝卜素含量低于对照38.7%;实验中后期,FL组保持继续降低的趋势,FD组则呈现上升的趋势,实验结束时两组的总叶绿素含量分别比对照低68.7%和18.9%,类胡萝卜素含量分别比对照低66.6%、34.9%(图3)。
各组叶绿素a与叶绿素b的含量之比在2.163—2.823之间波动(图3)。33d时,FD组与FL组的叶绿素a与叶绿素b的含量之比显著低于对照,但在实验结束时3个处理组都显著高于对照。总叶绿素与类胡萝卜素含量之比在4.798—6.729范围内波动,FL组始终与对照无显著差异,在实验中后期FD与DR组都高于同期对照,且可以看出复水对FD组的影响要大于DR组(图3)。
结果显示,3个处理对植物光合色素含量均有较大影响,其中以水淹为甚,这势必会在一定程度上影响植株的光合能力。
2.4 水分处理对枫杨幼苗叶绿素荧光特性的影响
2.4.1 水分处理对枫杨幼苗PSⅡ最大光化学效率的影响
叶绿素荧光参数Fv/Fm常用以度量叶片PSⅡ原初光能转换效率和PSⅡ的潜在活性[19]。持续水淹对枫杨的Fv/Fm产生的影响最为显著,FL组始终显著低于对照(P<0.05),实验前中后期分别比对照下降了6.77%、10.5%和8.02%,胁迫末期值为0.749。DR和FD两组在实验中后期与对照始终没有显著差异,保持相对稳定的状态(图4)。
2.4.2 水分处理对枫杨幼苗电子传递速率、实际光化学量子产量、光化学猝灭值和非光化学淬灭值的影响
各组的ETR和Yield变化趋势基本相同。实验前期,FL和FD两组的ETR和Yield显著下降,分别比对照降低了15.2%和14.7%。随着处理时间的延长,FL组的ETR和Yield出现回升,胁迫末期分别比对照低6.89%和6.50%,且末期Yield与对照无显著差异,而DR组的ETR和Yield在中期都相比对照显著下降,但复水后恢复到对照水平(图4)。
实验前期,FL和FD组的qP相比对照显著下降了6.56%(P<0.05);实验中后期,FL组的qP值恢复到对照水平并维持在稳定水平,FD组在实验结束时显著高于对照。DR组的qP值未与对照出现显著差异。实验前期,FL组的qN值相比对照升高了7.48%;实验中期,FL组的qN有所下降,FD组的qN值比对照略微升高;实验后期,FL组在实验末期与对照没有显著差异,FD组的qN值显著高于对照(P<0.05)。与qP相同,DR组的qN值始终与对照无显著差异(图4)。
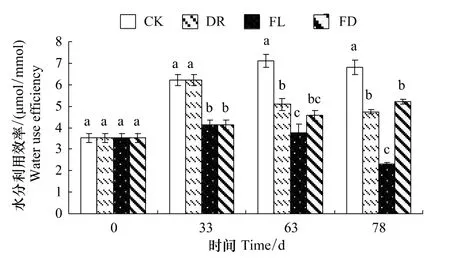
图2 不同水分处理下枫杨幼苗的水分利用效率的变化Fig.2 WUE of P. stenoptera seedlings in different water treatments
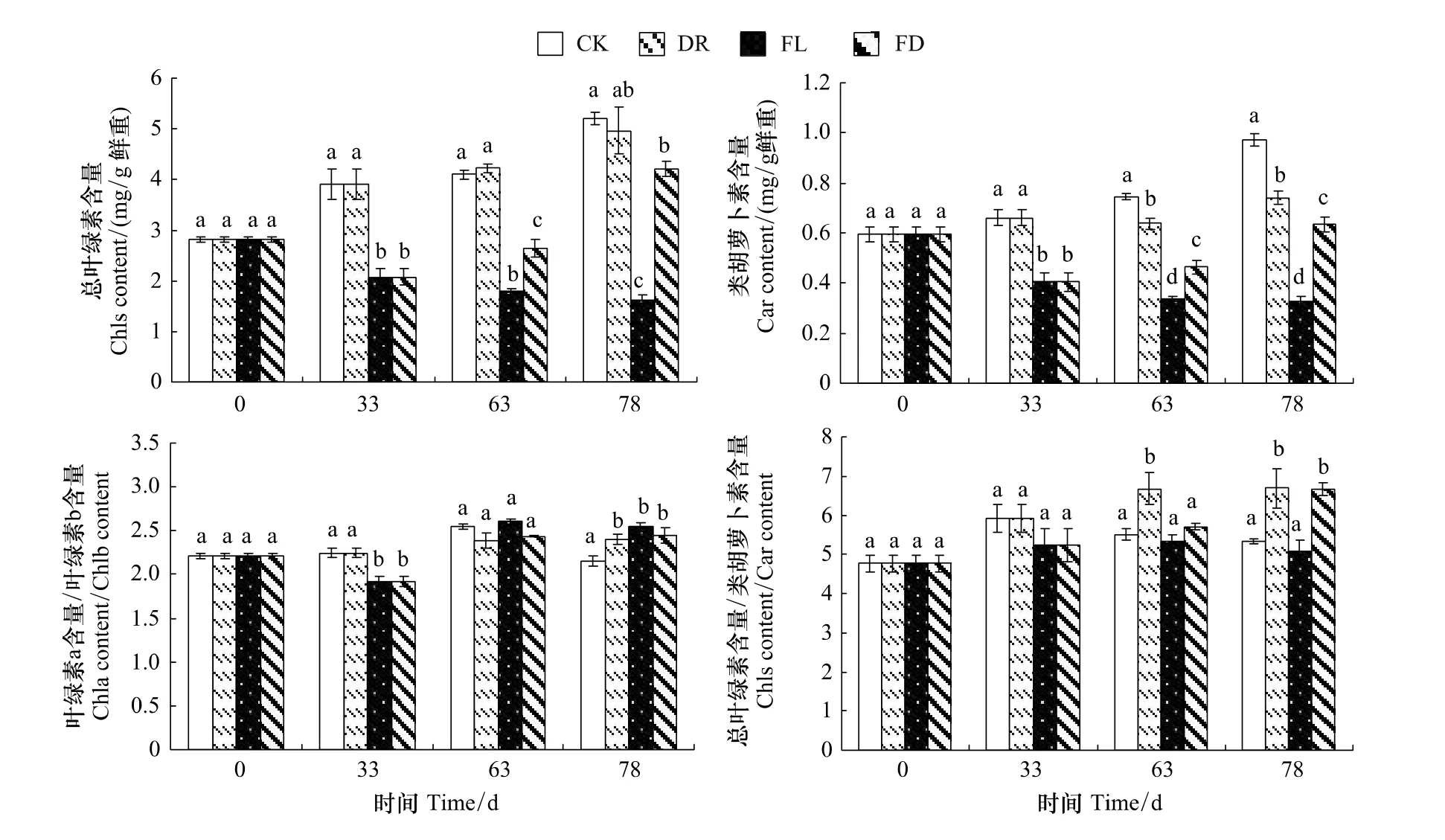
图3 不同水分处理下枫杨幼苗的光合色素含量变化Fig.3 The contents of photosynthetic pigment of P.stenoptera seedlings subjected to different water treatments
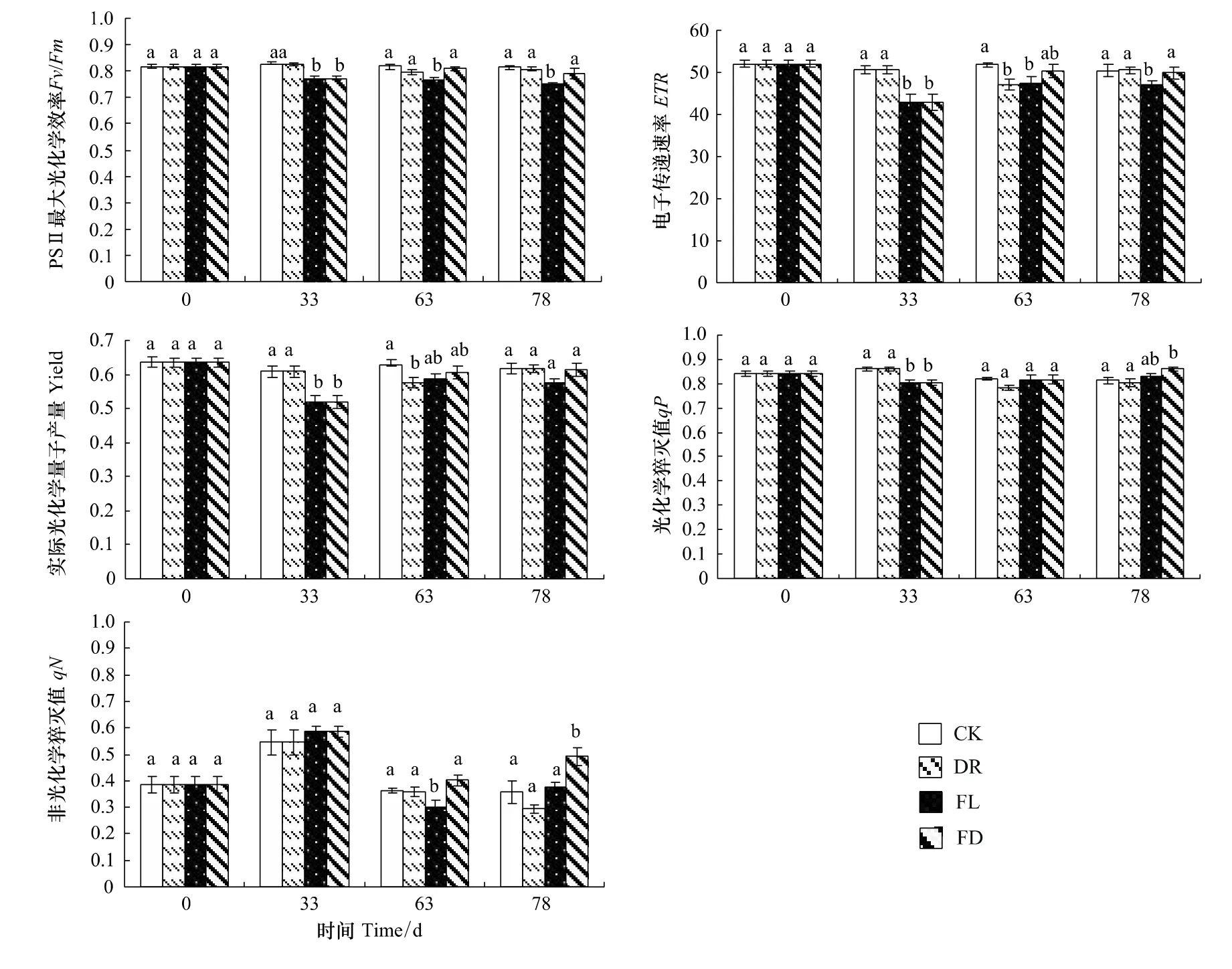
图4 不同水分处理下枫杨幼苗的ETR、Yield、qP和qN变化Fig.4 ETR,Yield,qP and qN of P.stenoptera seedlings subjected to different water treatments
3 讨论与结论
3.1 不同水分处理条件下枫杨幼苗的光合响应
通过本研究发现,土壤水分状况的差异显著影响枫杨幼苗的净光合速率、气孔导度和蒸腾速率等生理参数。水淹组FL组的净光合速率先显著下降,后下降幅度有所减小并保持稳定状态,符合耐淹植物的抗性表现特点[20-22]。研究表明对水淹没有耐受性的栓皮栎(Quercus variabilis)在水面高出土壤8 cm的水淹处理50 d后其净光合速率迅速下降为对照的9%[23],而枫杨幼苗在水淹63 d后其净光合速率为对照的39.7%,表现出对水淹胁迫的耐受力。FD组和DR组的净光合速率先大幅下降,复水后新叶生长迅速,使得其净光合速率能够基本恢复至对照水平,表现出较强的恢复生长能力,同时也说明即使是在先水淹后干旱的环境中枫杨幼苗也能维持其生长,为复水后的正常生长储备物质和能量。从DR和FD两组幼苗气孔导度的变化趋势可以看出,植物在受到干旱胁迫时降低气孔导度以减少水分的散失来抵抗水分亏缺的逆境[24-25],而在胁迫解除后,则通过开放气孔和增强水分的蒸腾速率使植株加强光合作用,提高净光合速率。
引起植物光合速率下降的因素既包括气孔限制也包括RuBP羧化限制、植物体内活性氧代谢失调而引发的生物膜结构的破坏等非气孔限制因素[26]。Farquhar和Sharkey认为,可用叶肉细胞CO2浓度(Ci)和气孔限制值(Ls)两个指标判断光合速率下降的原因是气孔或者非气孔限制因素[27]。本实验中,FL组幼苗Pn下降,Ci升高,Ls下降,可以认为其光合速率下降的决定因素是非气孔限制,说明水淹胁迫可能引起植物体内RuBP羧化酶效率降低或导致光合器官结构与功能受到破坏等[28],显著影响植物光合作用的进行。同理DR组净光合速率的下降也主要是由叶肉细胞同化能力降低等非气孔因素限制因素引起。而FD组可认为主要是由于气孔导度的降低引起了枫杨幼苗净光合速率的下降。由此可以看出,单纯的水淹或干旱主要是通过非气孔限制因素来影响枫杨的净光合速率,而经历水淹-干旱交替胁迫时则是因为气孔限制而导致的净光合速率的降低,出现这种现象的内在机制目前还不清楚。
3.2 不同水分处理条件下枫杨幼苗水分利用效率的响应
植物WUE是一个较为稳定的衡量碳固定与水分消耗比例的良好指标[29]。从研究结果可以看出,3种水分处理对枫杨水分利用效率的影响较大,长期水淹使得枫杨幼苗的生理活动因缺氧或者植株和土壤之间的水力导度下降而受到抑制,其WUE也受到显著影响,这与吕茜等[30]的研究一致。而水淹后干旱对枫杨幼苗的水分利用效率有一定的促进,WUE的提高对于其在干旱胁迫下维持生理活动起到了积极的作用。
3.3 不同水分处理条件下枫杨幼苗光合色素含量的响应
光合色素是光合作用中能量的捕获器,其含量高低直接影响到植物对光能的捕获,进而影响光合产物的积累,最终影响植株的生长[31]。本实验中在水淹胁迫下枫杨幼苗光合色素含量下降,一定程度上降低了叶片的光合能力,这也与水淹使得植物叶片膜受损电介质外渗导致叶片失绿、发黄和凋落的结论一致[32-33]。与FL组相比,FD组幼苗在土壤水分交替变化的环境中能够保持较高的总叶绿素和类胡萝卜素含量,对于维持植株的光合能力和抗胁迫能力是有利的。叶绿素a/b的升高表明植物体内的捕光色素蛋白复合物含量减少,由此带来的结果是叶片对光能的捕获量减少,降低了光合机构遭受光氧化破坏的可能性[34]。本实验中3个处理组在试验结束时其叶绿素a/b值都高于对照,是幼苗对不良环境的适应表现。
3.4 不同水分处理条件下枫杨幼苗叶绿素荧光的响应
叶绿素荧光技术被称为研究植物光合功能的快速、无损伤探针[35-36],因为其所检测到的植物体所发出的叶绿素荧光信号包含了十分丰富的光合作用信息,而这些特性与植物的营养和受胁迫程度密切相关[37]。该技术检测到的荧光信息主要来自叶绿体光系统Ⅱ(PSⅡ)的天线色素蛋白复合体中的叶绿素a分子,而淹水会导致叶绿素的降解、气孔关闭,加速叶片衰老凋落,植物的净光合速率、蒸腾速率、气孔导度都有大幅的降低,这势必会在很大程度上影响植株的叶绿素荧光特性[38-41]。Fv/Fm反映了PSⅡ反应中心内禀光能转换效率,表明PSⅡ利用光能的能力。实验表明,持续水淹显著降低了枫杨幼苗的Fv/Fm值,但轻度干旱对枫杨幼苗的Fv/Fm影响较小,与对照没有显著差异。由此说明,持续水淹使PSⅡ反应中心受损,抑制光合作用的原初反应,而“淹-干”的水分变化条件使得枫杨幼苗能够在此过程中基本恢复PSⅡ反应中心的光化学活性。短期水淹使枫杨幼苗的ETR和Yield先出现了较大幅度的下降后有所回升,可以认为这是枫杨幼苗叶绿素荧光对水淹的一种正响应。在持续水淹的环境中,枫杨幼苗通过一定程度上增大PSⅡ电子传递速率和实际光能转化效率来维持植株的光合作用。轻度干旱对于DR组幼苗的ETR和Yield的影响大于FD组,这表明短时间解除水淹胁迫可以使枫杨幼苗的PSⅡ反应中心的功能得到一定程度的恢复,暗示出水淹对枫杨幼苗PSⅡ造成的损害可通过解除胁迫而得到修复。
光化学淬灭系数(qP)的大小反映的是PSⅡ原初电子受体QA的氧化还原状态和PSⅡ开放中心的数目,其值越大,说明PSⅡ具有越高的电子传递活性[42]。短期水淹使枫杨幼苗的qP值显著下降,这表明在短期水淹胁迫下,枫杨幼苗体内电子由PSⅡ的氧化侧向PSⅡ反应中心的传递受阻,用于进行光合作用的电子减少,以热或其他形式耗散的光能增加[43]。而持续水淹下和复水后枫杨幼苗qP回升则表明枫杨的PSⅡ反应中心对于环境条件有正响应,在水淹后期增大PSⅡ反应中心的开放程度来维持植株较高的净光合速率。非光化学猝灭系数(qN)反映的是PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的光能部分[44],qN已经被证明为检测早期胁迫最敏感的参数[45],当植物处于胁迫条件时,qN值增大[46]。本实验中交替组的枫杨幼苗可在一定程度上以提高热耗散能力的方式对其自身形成保护。
从本实验研究结果来看,长期水淹对枫杨幼苗的影响要大于轻度干旱及“湿-干”交替胁迫,而面对不同的水分环境,枫杨幼苗也会呈现出不尽相同的适应策略。但总体来看,枫杨幼苗在水分代谢、光合生理以及叶绿素荧光等方面对水淹、轻度干旱以及“淹-干”的土壤水分含量交替变化条件都表现出较强的适应性和可塑性。此外,值得注意的是水淹组幼苗在实验中期时萌发出不定根,这更加强了植株的抗逆特性,可以考虑将枫杨用于三峡库区消落带植被的恢复重建。但是,三峡库区消落带生境复杂,对于其能否忍受复杂的环境条件和更长时间的交替胁迫有待进一步的研究。
[1]Chen G J.Situation and problems in the Three Gorges Reservoir area.Resources and Environment in the Yangtze Basin,2003,12(2):107-112.
[2]Luo F L,Zeng B,Chen T,Ye X Q,Liu D.Response to simulated flooding of photosynthesis and growth of riparian plant salix variegata in the Three Gorges Reservoir region of China.Journal of Plant Ecology,2007,31(5):910-918.
[3]Li C X,Zhong Z C.Influences of mimic soil water change on the contents of malic acid and shikimic acid and root-biomasses of Taxodium distichum seedlings in the hydro-fluctuation belt of the Three Gorges Reservoir region.Acta Ecologica Sinica,2007,27(11):4394-4402.
[4]Shi X H.Eutropication and phosphorus release of soil in drawdown area of Three Gorges Reservoir.Soils and Fertilizers,2004,(1):40-44.
[5]Jiang H T,Xu F F,Cai Y,Yang D Y.Weathering characteristics of sloping fields in the Three Gorges Reservoir area,China.Pedosphere,2006,16(1):50-55.
[6]Wang Y,Liu Y F,Liu S B,Huang H W.Vegetation reconstruction in the water-level-fluctuation zone of the Three Gorges Reservoir.Chinese Bulletin of Botany,2005,22(5):513-522.
[7]Li Y,Zeng B,Ye X Q,Qiao P,Wang H F,Luo F L.The effects of flooding on survival and recovery growth of the riparian plant(Salix variegata Franch.)in Three Gorges Reservoir region.Acta Ecologica Sinica,2005,28(5):1923-1930.
[8]Kozlowski T T.Physiological-ecological impacts of flooding on riparian forest ecosystems.Wetlands,2002,22(3):550-561.
[9]Kramer K,Vreugdenhil S J,Vanderwerf D C.Effects of flooding on the recruitment,damage and mortality of riparian tree species:a field and simulation study on the Rhine floodplain.Forest Ecology and Management,2008,255(11):3893-3903.
[10]Wang Y H,Li K Y,Yu Y B,Liu X E.Effects of flooding on the moisture content and ring width of Pterocarya stenoptera grown in the beaches.Journal of Anhui Agricultural University,2005,32(4):505-508.
[11]Yi Y H,Fan D Y,Xie Z Q,Chen F Q.Effects of waterlogging on the gas exchange,chlorophyll fluorescence and water potential of Quercus variabilis and Pterocarya stenoptera.Journal of Plant Ecology,2006,30(6):960-968.
[12]Li J Y.Variations of activities for protecting enzymes and superoxide of lipid membrane in Chinese Wingnut tree seedlings(Pterocarya stenoptera)after flooding treatment.Journal of Anhui Agricultural University,2006,33(4):450-453.
[13]Li C X,Zhong Z C,Liu Y.Effect of soil water change on photosynthetic characteristics of Taxodium distichum seedlings in the hydro-fluctuation belt of the Three Gorges Reservoir Area.Acta Ecologica Sinica,2005,25(8):1953-1959.
[14]Shi X L,Wang G D.Research advances in measuring method of soil water content.China Rural Water and Hydropower,2003,10:84-86.
[15]Nijs I,Ferris R,Blum H.Stomatal regulation in a changing climate:a field study using free air temperature increase(FATI)and free air CO2enrichment(FACE).Plant,Cell and Environment,1997,20(8):1041-1050.
[16]Berry J A,Downton W J S.Environmental Regulation of Photosynthesis//Govind J,ed.Photosynthesis(VolⅡ).New York:Academic Press,1982.
[17]Hao J J,Kang Z L,Yu Y.Experimental Technology of Plant Physiology.Beijing:Chemical Industry Press,2006:65-68.
[18]Demmig-Adams B,Adams William W.Xanthophyll cycle and light stress in nature:uniform response to excess direct sunlight among higher plant species.Planta,1996,198(3):460-470.
[19]Wang Y,Chen J W,Di X Y.Characterization of the responses of photosynthetic and chlorophyll fluorescence parameters to water stress in seedlings of six provenances of Chinese Pine(Pinus tabulaeformis Carr.).Acta Ecologica Sinica,2011,31(23):7031-7038.
[20]Sultan S E,Wilczek A M,Bell D L,Hand G.Physiological response to complex environments in annual Polygonum species of contrasting ecological breadth.Oecologia,1998,115(4):564-578.
[21]Glaz B,Morris D R,Daroub S H.Sugarcane photosynthesis,transpiration,and stomatal conductance due to flooding and water table.Crop Science,2004,44(5):1633-1672.
[22]Chen F Q,Guo C Y,Wang C H,Xu W N,Fan D Y,Xie Z Q.Effects of waterlogging on ecophysiological characteristics of Salix variegate seedlings.Chinese Journal of Applied Ecology,2008,19(6):1229-1233.
[23]Yi Y H,Fan D Y,Xie Z Q,Chen F Q.The effects of waterlogging on photosynthesis-related eco-physiological processes in the seedlings of Quercus variabilis and Taxodium ascendens.Acta Ecologica Sinica,2008,12(28):6025-6033.
[24]Bennett J M,Boote K J,Hammond L C.Relationships among water potential components,relative water content,and stomatal resistance of fieldgrown peanut leaves.Peanut Science,1984,11(1):31-35.
[25]Midgley G F,Moll E J.Gas exchange in arid-adapted shrubs:when is efficient water use a disadvantage?South African Journal of Botany,1993,59(5):491-495.
[26]Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis.Annual Review of Plant Physiology,1982,33(1):317-345.
[27]Guo H Y,Fan Z C.Effect of Soil Water Stress on Photosynthesis of Allium sativum L.Acta Horticulturae Sinica,1999,26(6):404-405.
[28]Büssis D,Heineke D.Acclimation of potato plants to polyethylene glycol-induced water deficitⅡ.Centents and subecellular distribution of organic solutes.Journal of Experimental Botany,1998,49(325):1349-1360.
[29]Zheng S X,ShangGuan Z P.Comparison of leaf gas exchange and chlorophyll fluorescence parameters in eight broad-leaved tree species.Acta Ecologica Sinica,2006,26(4):1080-1087.
[30]Lü Q,Wei H,Li C X.Effects of soil water condition on photosynthetic characteristics of Pterocarya stenoptera C.DC.seedlings.Journal of Southwest University:Natural Science Edition,2010,32(3):116-123.
[31]Wang Z.Plant Physiology.Beijing:China Agriculture Press,2002:128-131.
[32]Smethurst C F,Shabala S.Screening methods for waterlogging tolerance in lucerne:comparative analysis of waterlogging effects on chlorophyll fluorescence,photosynthesis,biomass and chlorophyll content.Functional Plant Biology,2003,30(3):335-343.
[33]Islam M A,Macdonald S E.Ecophysiological adaptations of black spruce(Picea mariana)and tamarack(Larix laricina)seedlings to flooding.Trees-Structure and Function,2004,18(1):35-42.
[34]Thornber J P.Chlorophyll-proteins:light-harvesting and reaction center components of plants.Annual Review of Plant Physiology,1975,26(1):127-158.
[35]Krause G H,Weis E.Chlorophyll fluorescence and photosynthesis:the basics.Annual Review of Plant Physiology and Plant Molecular Biology,1991,42(1):313-349.
[36]Zhang S R.A discussion on chlorophyll fluorescence kinetics parameters and their significance.Chinese Bulletin of Botany,1999,16(4):444-448.
[37]Li X,Feng W,Zeng X C.Advances in chlorophyll fluorescence analysis and its uses.Acta Botanica Boreali-Occidentalia Sinica,2006,26(10):2186-2196.
[38]Van Kooten O,Snel J F H.The use of chlorophyll fluorescence nomenclature in plant stress physiology.Photosynthesis Research,1990,25(3):147-150.
[39]Gu X,Li Z Q,Jiang C D,Shi L,Zhang H J,Xing Q.Effects of submergence and subsequent re-emergence on photosynthetic characteristics and photoinhibition in Echinodorus amazonicus seedlings.Acta Ecologica Sinica,2009,29(12):6466-6474.
[40]Feng D L,Liu Y,Zhong Z C,Yang J,Xie J.Photosynthesis and chlorophyⅡfluorescence parameters of the reed(Phragmites communis)grown in the hydro-fluctuation belt of Three Gorges Reservoir Are.Acta Ecologica Sinica,2008,28(5):2013-2021.
[41]Yuan L,Zhang L Q,Gu Z Q.Responses of chlorophyll fluorescence of an invasive plant Spartina alterniflora to continuous waterlogging.Acta Scientiae Circumstantiae,2010,30(4):882-889.
[42]Zhang S R.A discussion on chlorophyll fluorescence kinetics parameters and their significance.Chinese Bulletin of Botany,1999,16(4):444-448.
[43]Liang Y,Wang S,Feng L X,Tian C Y.Effects of heavy metal stress on the growth and chiorophyll fluorescence of chaetoceros gracilis.Periodical of Ocean University of China,2004,38(1):59-67.
[44]Chen X L,Li S Q,Ren X L.Effect of atmospheric NH3and hydroponic solution nitrogen levels on chlorophyll fluorescence of corn genotypes with different nitrogen use efficiencies.Acta Ecologica Sinica,2008,28(3):1026-1033.
[45]Qian Y Q,Zhou X X,Han L,Sun Z Y,Ju G S.Rapid light-response curves of PSⅡ chlorophyll fluorescence parameters in leaves of Salix leucopithecia subjected to cadmium-ion stress.Acta Ecologica Sinica,2011,31(20):6134-6142.
[46]Bader M R,von Caemmerer S,Ruuska S,Nakano H.Electron flow to oxygen in higher plants and algae:rates and control of direct photoreduction(Mehler reaction)and rabisco oxygenase.Biological Sciences,2000,355(1402):1433-1446.
参考文献:
[1]陈国阶.三峡库区发展态势与问题.长江流域资源与环境,2003,12(2):107-112.
[2]罗芳丽,陈婷,叶小齐,刘巅.三峡库区岸生植物秋华柳对水淹的光合和生长响应.植物生态学报,2007,31(5):910-918.
[3]李昌晓,钟章成.三峡库区消落带土壤水分变化对落羽杉(Taxodium distichum)幼苗根部次生代谢物质含量及根生物量的影响.生态学报,2007,27(11):4394-4402.
[4]石孝洪.三峡水库消落区土壤磷素释放与富营养化.土壤肥料,2004,(1):40-44.
[6]王勇,刘义飞,刘松柏,黄宏文.三峡库区消涨带植被重建.植物学通报,2005,22(5):513-522.
[7]李娅,曾波,叶小齐,乔普,王海峰,罗芳丽.水淹对三峡库区岸生植物秋华柳(Salix variegata Franch.)存活和恢复生长的影响.生态学报,2005,28(5):1923-1930.
[10]汪佑宏,李克禹,余应兵,刘杏娥.淹水程度对滩地枫杨木材含水率和年轮宽度的影响.安徽农业大学学报,2005,32(4):505-508.
[11]衣英华,樊大勇,谢宗强,陈芳清.模拟淹水对枫杨和栓皮栎气体交换、叶绿素荧光和水势的影响.植物生态学报,2006,30(6):960-968.
[12]李纪元.涝渍胁迫对枫杨幼苗保护酶活性及膜脂过氧化物的影响.安徽农业大学学报,2006,33(4):450-453.
[13]李昌晓,钟章成,刘芸.模拟三峡库区消落带土壤水分变化对落羽杉幼苗光合特性的影响.生态学报,2005,25(8):1953-1959.
[14]时新玲,王国栋.土壤含水量测定方法研究进展.中国农村水利水电,2003,10:84-86.
[17]郝建军,康宗利,于洋.植物生理学实验技术.北京:化学工业出版社,2006:65-68.
[19]王琰,陈建文,狄晓艳.不同油松种源光合和荧光参数对水分胁迫的响应特征.生态学报,2011,31(23):7031-7038.
[22]陈芳清,郭成圆,王传华,许文年,樊大勇,谢宗强.水淹对秋华柳幼苗生理生态特征的影响.应用生态学报,2008,19(6):1229-1233.
[23]衣英华,樊大勇,谢宗强,陈芳清.模拟淹水对池杉和栓皮栎光和生理生态过程的影响.生态学报,2008,12(28):6025-6033.
[27]郭洪芸,樊治成.土壤水分胁迫对大蒜光合特性的影响.园艺学报,1999,26(6):404-405.
[30]吕茜,魏虹,李昌晓.土壤水分条件对枫杨幼苗光合生理的影响.西南大学学报:自然科学版,2010,32(3):116-123.
[31]王忠.植物生理学.北京:中国农业出版社,2002:128-131.
[37]李晓,冯伟,曾晓春.叶绿素荧光分析技术及应用进展.西北植物学报,2006,26(10):2186-2196.
[39]谷昕,李志强,姜闯道,石雷,张会金,邢全.水淹导致皇冠草光合机构发生变化并加剧其出水后光抑制.生态学报,2009,29(12):6466-6474.
[40]冯大兰,刘芸,钟章成,杨娟,谢君.三峡库区消落带芦苇(Phragmites communis(reed))的光合生理响应和叶绿素荧光特性.生态学报,2008,28(5):2013-2021.
[41]袁琳,张利权,古志钦.入侵植物互花米草 (Spartina alterniflora)叶绿素荧光对淹水胁迫的响应.环境科学学报,2010,30(4):882-889.
[42]张守仁.叶绿素荧光动力学参数的意义及讨论.植物学通报,1999,16(4):444-448.
[43]梁英,王帅,冯力霞,田传远.重金属胁迫对纤细角毛藻生长及叶绿素荧光特性的影响.中国海洋大学学报,2004,38(1):59-67.
[44]陈小莉,李世清,任小龙.大气NH3和介质供氮水平对不同氮效率玉米基因型叶绿素荧光参数的影响.生态学报,2008,28(3):1026-1033.
[45]钱永强,周晓星,韩蕾,孙振元,巨关升.Cd2+胁迫对银芽柳PSⅡ叶绿素荧光光响应曲线的影响.生态学报,2011,31(20):6134-6142.

