IGF-1、PCNA和Caspase3在前列腺癌组织的表达及临床意义
曾翔,梁勇,付光庆
(自贡市第四人民医院泌尿外科,四川自贡643000)
·论著·
IGF-1、PCNA和Caspase3在前列腺癌组织的表达及临床意义
曾翔,梁勇,付光庆
(自贡市第四人民医院泌尿外科,四川自贡643000)
目的探讨前列腺癌组织中IGF-1、PCNA、Caspase3的表达及临床意义。方法采用免疫组织化学染色法(PV9000法)检测正常前列腺(10例)及前列腺癌组织(42例)中IGF-1、PCNA和Caspase3的阳性表达率。结果(1)正常前列腺组IGF-1及PCNA阳性表达率较前列腺癌组表达明显减弱(P<0.05);正常前列腺组Caspase3阳性表达率较前列腺癌组明显增加(P<0.05)。(2)PCNA和IGF-1的表达随着前列腺癌病理分级和临床分期增加而升高,Caspase3的表达随着前列腺癌病理分级和临床分期增加而减少。结论(1)前列腺癌IGF-1的表达异常增高与前列腺癌的发生发展密切相关,检测IGF-1、PCNA、Caspase3的表达可作为前列腺癌诊断和预后判断的一项参考指标。
前列腺癌;胰岛素样生长因子-1;增殖细胞核抗原;半胱氨酸天冬氨酸特异性蛋白酶-3
前列腺癌(Prostate carcinoma,Pca)是中老年男性常见的泌尿系肿瘤,近年来在我国发病率不断上升。前列腺癌生物学行为较为复杂,其发生发展与多种因素有关。研究发现胰岛素样生长因子(IGF-1)等细胞因子在Pca发生发展过程中可能起着重要的调控作用,了解正常前列腺及Pca组织中IGF-1、增殖与凋亡相关因子的表达,有助于揭示Pca的发生发展的机制。本研究采用免疫组化PV9000法探讨正常前列腺和前列腺癌组织中IGF-1、增殖细胞核抗原(PCNA)及半胱氨酸天冬氨酸特异性蛋白酶-3(Caspase3)的表达。
1 材料与方法
1.1 标本来源收集自贡市第四人民医院泌尿外科2008-2011年病理组织标本52例,其中正常前列腺组织(NP)10例,Pca组织42例。10例正常前列腺组织全部来源于尸体标本,其余42例手术切除的标本经病理诊断均为前列腺腺癌,按国际前列腺癌TNM,分期其中T17例,T217例,T312例,T46例。按Gleason分级,7分以下18例,8分15例,8~10分9例。7分以下为低危组,8分为中危组,9~10分为高危组。
1.2 主要试剂IGF-1单克隆抗体试剂购自北京博奥森生物技术有限公司,Caspase3、PCNA单克隆抗体试剂购自北京中杉金桥生物技术有限公司,PV9000检测试剂盒,二氨基联苯胺(DAB)显色试剂盒溶液,3-氨丙基三乙氧硅烷(APES)防脱片试剂均购自北京中杉金桥生物技术有限公司。
1.3 免疫组化方法将石蜡包埋蜡块行4 μm连续切片,PCNA免疫组化过程:切片常规脱蜡;抗原热修复;按免疫组化PV9000操作常规进行;DAB显色;常规梯度酒精脱水干燥、二甲苯透明,中性树胶封片。Caspase3免疫组化过程:一抗用磷酸盐缓冲液(PBS)稀释,比例为1:100,余同PCNA。IGF-1免疫组化过程:不需要热修复,用胰蛋白酶修复,胰蛋白酶稀释比例为1:3。IGF-1一抗的稀释比例为1:150,余同PCNA。
1.4 结果判断及图像分析
1.4.1 IGF-1、PCNA及Caspase3表达Caspase3在前列腺上皮细胞胞浆中表达,呈棕黄或棕褐色;IGF-1在上皮细胞和间质胞浆中表达,呈棕黄色细颗粒;PCNA在前列腺上皮细胞胞核表达,呈棕黄色颗粒。
1.4.2 免疫组化结果每张切片随机取4个视野同条件采图,用Image-pro plus 6.0做免疫组化图象分析,计算每张图片前列腺组织中阳性表达的平均光密度值,取4个视野的平均值作为切片该指标的阳性率。
1.5 统计学方法所有实验数据均通过Microsoft Excel 2007进行描述性统计。所有计量资料数据以均数±标准差(x-±s)表示,各组间均数的比较采用方差分析或非参数检验,用SPSS14.0软件进行统计分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 IGF-1在正常前列腺和前列腺癌不同临床分期组织的表达IGF-1在正常前列腺组织表达于腺体上皮、间质的细胞胞浆,正常前列腺以间质相对较多,大多数染色均匀一致,呈弥漫分布,少部分灶性分布;而前列腺癌主要表达于癌巢的细胞胞浆中,呈灶性分布。正常前列腺组织和前列腺癌组的IGF-1阳性率见表1,两组比较总差异有统计学意义(F= 85.65,P=0.000 26<0.01)(表1,图1~图2)。IGF-1前列腺癌不同分期组间的比较:前列腺癌分组各组随分期增高而呈增高趋势,前列腺癌T1与T2组比较(P=0.341),T1与T3组比较(P=0.140),T1与T4组比较(P=0.064),T2与T3组比较(P=0.453),T2与T4组比较(P=0.193),T3与T4组比较(P=0.497),差异均无统计学意义(P>0.05)。

图1 正常前列腺IGF(×200)

图2 前列腺癌组织IGF-1(×400)
2.2 PCNA在正常前列腺和前列腺癌不同临床分期组织的表达PCNA在正常前列腺和前列腺癌组织标本中均有阳性表达,表达于细胞的胞核,正常前列腺组织主要表达于腺体上皮细胞,而基底上皮细胞和间质细胞很少表达。前列腺癌组织中主要表达于癌细胞中,癌旁前列腺腺体上皮细胞也有部分表达,PCNA在正常前列腺和前列腺癌组织两组比较差异有统计学意义(F=107.78,P=0.000 17<0.01)。PCNA前列腺癌不同分期组间的比较:前列腺癌T4组较T1组明显增高(P=0.000 68<0.05),前列腺癌分组各组随分期增高而呈增高趋势,T1与T2组比较(P=0.227),T1与T3组比较(P=0.164),T2与T3组比较(P=0.121),T2与T4组比较(P=0.068),T3与T4组比较(P=0.057),各组随分期增加而呈升高趋势,但差异无统计学意义(P>0.05)(表1,图3-图4)。
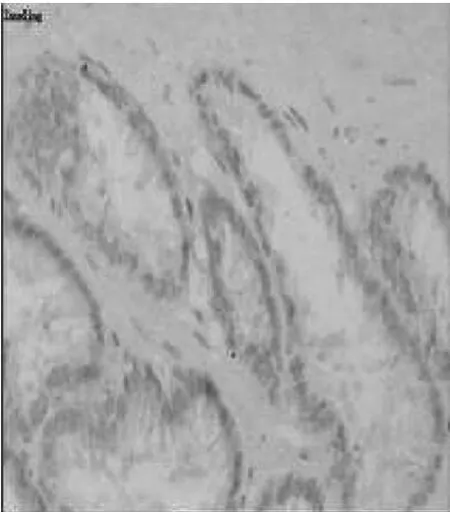
图3 正常前列腺PCNA(×200)
图4 前列腺癌组织PCNA(×200)
2.3 Caspase3在正常前列腺和前列腺癌不同临床分期组织的表达Caspase3在正常前列腺和前列腺癌组织标本中均有阳性表达,上皮细胞和间质均有表达,主要以腺体上皮胞浆表达为主。正常前列腺及前列腺癌两组阳性率比较差异有统计学意义(F=1 826.20,P<0.01)。Caspase3前列腺癌不同分期组间的比较:前列腺癌T4、T3、T2组较T1组明显减低(P<0.05),其余各组随分期增加而呈减少趋势,但差异有统计学意义(P>0.05),见表1,图5~图6。
表1 不同前列腺癌临床分期组织IGF-1、PCNA、Caspase3的阳性率

表1 不同前列腺癌临床分期组织IGF-1、PCNA、Caspase3的阳性率
项目正常前列腺前列腺癌T1前列腺癌T2前列腺癌T3前列腺癌T4例数10 7 17 12 6 IGF-1 0.073±0.01 0.124±0.02 0.132±0.03 0.135±0.02 0.138±0.05 PCNA 0.113±0.13 0.983±0.53 1.164±0.35 1.204±0.27 1.457±0.66aCaspase3 3.027±0.33 1.965±0.25b1.395±0.48b1.281±0.14b0.734±0.42b

图5 正常前列腺Caspase3(×100)

图6 前列腺癌组织Caspase3(×100)
2.4 IGF-1、PCNA和Caspase3在正常前列腺和前列腺癌不同病理分级组织的表达IGF-1、PCNA和Caspase3在正常前列腺和前列腺癌不同病理分级组织标本中均有阳性表达。PCNA主要表达于细胞的胞核。IGF-1前列腺癌不同病理分级组间的比较:前列腺癌各组随分期增高而呈增高趋势,低危组与中危组比较,F=30.332,P=0.121,低危组与高危组比较,F=46.561,P=0.070,中危组与高危组比较,F=39.187,P=0.630,但差异无统计学意义(P>0.05)。PCNA前列腺癌不同病理分级组间的比较:前列腺癌高危组较前列腺癌低危组有统计学意义(F=92.116,P=0.000 17<0.05),前列腺癌中危组较前列腺癌低危组差异有统计学意义(F=72.547,P=0.000 32<0.05),各组随病理分级增高而呈增高趋势,高危组与中危组比较(F= 46.480,P=0.080),但差异无统计学意义(P>0.05)。Caspase3前列腺癌不同病理分级组间的比较:Caspase3表达在前列腺癌高危组与中危组比较差异有统计学意义(F=122.380,P=0.000 21<0.05),与低危组比较差异有统计学意义(F=260.422,P=0.000 054<0.05),中危组与低危组比较差异有统计学意义(F=148.964,P=0.000 67<0.05),各组随病理分级增高而呈减低趋势,差异有统计学意义(见表2)。
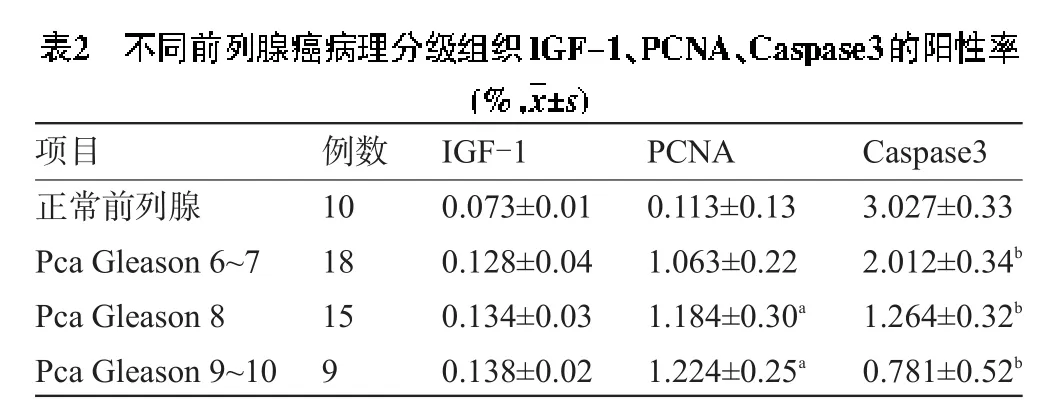
注:a前列腺癌PCNA高与低危组比较,F=92.116,P=0.000 17<0.05,前列腺癌中危组较前列腺癌低危组有统计学意义,F=72.547,P= 0.000 32<0.05;b前列腺癌Caspase3表达在高危组与中危组的比较,F=122.380,P=0.000 21<0.05,与低危组比较,F=260.422,P= 0.000 054<0.05,中危组与低危组比较,F=148.964,P=0.000 67<0.05。
3 讨论
前列腺癌是中老年男性常见的泌尿生殖肿瘤,目前前列腺癌的发生机制不十分清楚。前列腺中各种激素代谢水平的改变,各种生长因子和癌基因以及神经内分泌细胞等均参与了细胞增殖和凋亡的平衡[1]。前列腺细胞增殖和凋亡的平衡破坏在前列腺癌的发生发展中起着重要作用。
IGF-I是一种受生长激素调节的单链多肽,对细胞增殖从G1~S期具有促进作用,是重要的促细胞生长和分化因子,具有显著的促细胞分裂和抗细胞凋亡作用[2]。目前研究表明IGF-1可以在正常前列腺或前列腺增生组织中表达[3]。Furstenberger等[4]发现在人体许多肿瘤组织如乳腺癌、肝癌、结直肠癌、前列腺癌等中过量表达,与肿瘤的发生发展密切相关,并具有抗细胞凋亡作用。Ruan等[5]也发现,IGF-1可以由前列腺癌细胞产生,在体外前列腺癌细胞系可自己分泌IGF-1和表达自动磷酸化的IGF-1R。张超等[6]研究了IGF-1和IGF-1R在Pca组织中的表达,也证实了前列腺癌组织IGF-1的表达主要分布在前列腺腺体上皮细胞。本实验结果表明IGF-1在正常前列腺组织、前列腺癌上皮细胞和基质胞浆均有表达,与文献报道大致相同。罗玉华等[7]研究发现IGF-1在前列腺癌的表达明显高于前列腺增生,与前列腺癌Gleason评分呈正相关,与Whitmore-Jewett(ABCD)系统呈正相关。本实验比较了正常前列腺组织和前列腺癌组的IGF-1阳性率,两组比较差异有统计学意义(P<0.05),随病理分级和TNM临床分期增加有增加趋势,但各组之间差异无统计学意义,可能与各组的病例标本有关。
增殖细胞核抗原(PCNA)是DNA聚合酶的辅助蛋白,是DNA复制所必须的细胞周期调节蛋白。它在细胞增殖周期的G1期开始增加,S期达到高峰,是评价细胞增殖状态的客观指标[8],其合成水平反映了细胞增殖率及DNA合成率。本研究显示PCNA存在于细胞核内,在正常前列腺及前列腺癌组织均有表达,在前列腺癌组织表达明显,两组比较差异有统计学意义(P<0.01),PCNA临床分期组间比较T4组较T1组明显增加(P<0.05),前列腺癌高、中危组较前列腺癌低危组差异有统计学意义(P<0.05),余各组随病理分级增高而呈增高趋势,PCNA随前列腺临床分期及Gleason病理分级增加呈增加趋势,与前列腺癌的发生发展有关,这与Lai等[9]在研究PCNA在前列腺癌表达随临床分期增加有显著性报道相近。Zhong等[10]用RT-PCR法研究了Ki-67和PCNA在正常前列腺、BPH和前列腺癌的表达,同样发现PCNA在BPH和前列腺不同分化癌的表达呈逐渐升高的趋势。PCNA在前列腺癌切除术后标本的研究中,Taftachi等[11]提出了PCNA可以作为预防前列腺癌复发的独立预测指标的观点。PCNA不仅与前列腺癌发生有关,还与其恶性行为有关,PCNA的检测对判断前列腺癌的性质、转移和预后有重要的临床意义。
Caspase3是细胞凋亡的一类蛋白水解酶,即Caspase中的关键效应酶,是凋亡执行的重要效应分子,属于半胱氨酸基天冬氨酸基-特异性蛋白酶[12]。O'Nell等[13]研究了前列腺癌组织的Caspase3蛋白表达,发现前列腺癌的Caspase3表达主要在分泌上皮细胞,而在基底细胞仅有少量表达。本实验发现Caspase3主要表达在分泌上皮细胞胞浆,在临床不同分期和病理分级均有表达,前列腺癌T4、T3组较T1组明显减低(P<0.05),其余各组随分期增高而呈减低趋势,但差异无统计学意义(P>0.05),前列腺癌随病理分级越高表达越少,高危中危较低危组明显减少(P<0.05)。邓春华等[14]研究也发现Caspase3在前列腺癌不同病理分级均有表达,高分化组比低分化组表达更高,提示表达强弱可能与分级和预后有关。许学文等的研究也证实晚期前列腺癌存在Caspase3的表达失调,其在前列腺癌的发展中发挥作用[15]。因此我们认为前列腺癌的Caspase3表达随临床分期及病理分级增高而表达减少,有助于成为前列腺癌的预后判断参考指标之一。
目前研究认为前列腺癌是前列腺细胞增殖与凋亡平衡紊乱引起,本研究表明细胞因子IGF-1、PCNA和Caspase3与前列腺癌的发生发展密切相关。IGF-1及PCNA在前列腺癌组织均有表达,随临床分期及病理分级的升高而呈增加趋势,Caspase3的表达随着前列腺癌病理分级和临床分期增加而减少,对前列腺癌的早期诊断、临床疗效及预后判断具有重要意义。目前国内外研究的病例较少,仍需要大样本多中心病例对照研究,在分子生物学水平等更多领域探讨。
[1]Kyprianou N,Tu H,Jacobs SC,et al.Apoptotic versus proliferative activities in human benign prostatic hyperplasia[J].Human Pathology,1996,27(7):668-675.
[2]Chan JM,Stampfer MJ,Giovannucci E,et al.Plasma insulin-like growth factor-I and prostate cancer risk:a prospective study[J]. Science,1998,279(5350):563-566.
[3]曾翔,梁勇,杨镒魟,等.5α还原酶抑制剂对前列腺增生组织IGF-1的影响及与PCNA和Caspase3的相关性研究[J].中国男科学杂志,2012,26(12):3-7.
[4]Furstenberger C,Senn HJ.Insulin-like growth factors and cancer [J].Lancet Oncol,2002,3:298-302.
[5]Ruan W,Powell BL,Kopchick JJ,et al.Evidence that insulin-like growth factor-I and growth hormone are required for prostate grand development[J].Endocrinology,1999,140:1984-1989.
[6]张超,王东文,张利.IGF-1和其受体IGF-1R在前列腺癌和良性前列腺增生组织中的表达[J].中国当代医药,2009,16(10):7-8.
[7]罗玉华,翁志梁,蔡健,等.IGF-I、IGF-II及IGF-IR在前列腺癌中的表达和意义[J].中国男科学杂志,2009,13(1):23-27.
[8]MC comic,D Hall PA.The complexities of proliferating cell nuclear antigen[J].Histopathology,1992,21(6):591-594.
[9]Lai JS,Xia Q,Zhang XB,et al.Expression and significance of PCNA and p27 in benign prostate hypertrophy and prostate carcinoma [J].Zhonghua Zhong Liu Za Zhi,2004,26(8):476-478.
[10]Zhang W,Peng J,He H,et al.Ki-67 and PCNA expression in prostate cancer and benign prostatic hyperplasia[J].Clinical Investigative Medicine,2008,31(1):8-15.
[11]Taftachi R,Ayhan A,Ekici S,et al.Proliferating-cell nuclear antigen (PCNA)as an independent prognostic marker in patients after prostatectomy:a comparison of PCNA and Ki-67[J].BJU international, 2005,95(4):650-654.
[12]Karki P,Lee J,Shin SY,et al.Kinetic comparison of procaspase-3 and caspase-3[J].Arch Biochem Biophys,2005,442(1):125-132.
[13]O'Neill AJ,Baran SA,O'Keane C,et al.Caspase-3 expression in benign prostatic hyperplasia and prostatic carcinoma[J].Prostate, 2001,47(3):183.
[14]邓春华,邱少鹏,陈辉熔,等.Caspase3在前列腺癌组织中的表达和意义[J].中国男科学杂志,2003,17(4):224-228.
[15]许学文,由凯,卜仁戈,等.晚期前列腺癌组织中Caspase-3、survivin的表达变化及意义[J].山东医药,2011,51(46):36-37.
Expression and clinical significance of IGF-1,PCNA and Caspase3 in prostate carcinoma tissues.
ZENG Xiang, LIANG Yong,FU Guang-qing.Department of Urology,the Forth People's Hospital of Zigong,Zigong 643000,Sichuan, CHINA
ObjectiveTo investigate the expression and clinical significance of insulin-like growth factor-1 (IGF-1),proliferating cell nuclear antigen(PCNA)and Caspase3 in human prostatic carcinoma tissues.MethodsThe expression of PCNA,Caspase3,IGF-1 were observed by immunohistochemical PV9000 methods in normal prostate and prostatic carcinoma tissues.Results(1)The positive expression rates of IGF-1 and PCNA in normal prostate were significantly lower than those of prostate carcinoma(P<0.05),and the positive expression rates of Caspase3 in normal prostate significantly were significantly higher than that of prostate carcinoma(P<0.05).(2)The expression of IGF-1 and PCNA were increased as the increasing of clinical stage and pathological grade.On the contrary,the expression of Caspase3 was decreased as the increasing of clinical stage and pathological grade.ConclusionThe extremely high expression of IGF-1 may play a pivotal role in tumorigenesis and progression in prostate carcinoma.The expression of IGF-1,PCNAand Caspase3 may serves as an indicator for the diagnosis and prognosis of prostate carcinoma.
Prostate carcinoma;Insulin-like growth factor-1(IGF-1);Proliferating cell nuclear antigen (PCNA);Caspase3
R737.25
A
1003—6350(2013)19—2809—04
10.3969/j.issn.1003-6350.2013.19.1176
2013-03-25)
曾翔。E-mail:zengu@126.com

