腐殖土对废水中Cu2+的吸附
吴 敏,刘 振,朱 睿,戴晓虎
(1.同济大学 环境科学与工程学院,上海200092;2.上海市环境科学研究院,上海200233)
近年来我国的环境问题日益突出,其中重金属引起的环境污染越来越受关注.重金属在环境介质中不能被生物降解,而且可以通过食物链在生物体内富集,最终在人体内蓄积而危害人体健康[1-2].含Cu2+废水是常见的重金属污染物,虽然铜是人体健康不可或缺的微量元素,但是过量的铜摄入会导致中毒,因此废水中Cu2+的去除引起了广泛的关注.
吸附法是一种容易操作、经济可行的Cu2+废水处理方法,其中吸附剂的选择是该技术可行与否的关键[3].研究发现许多物质可以利用自身多孔隙结构和富含无机物质的特点来吸附去除Cu2+.Demirbas等[4]研究了利用活性炭吸附Cu2+的动力学及吸附等温线.Motsi等[5]研究了在不同条件下天然沸石对Cu2+的吸附特性.HeÂquet等[6]研究了粉煤灰吸附Cu2+的影响因素.这些吸附剂对Cu2+都具有良好的去除效果,但是吸附过程易受p H值、温度等外界因素的影响,并且Cu2+容易再次析出产生二次污染.
近年来研究发现腐殖质对Cu2+具有良好的吸附性能,并且在添加腐殖质后,一些传统吸附剂的吸附能力也得到提高.夏畅斌等[7]研究发现磺化褐煤对Cu2+的吸附机理为离子交换和表面络合反应.黄雅曦等[8]研究发现草炭对Cu2+的吸附能力要大于天然沸石.Pranav等[9]研究发现用腐殖酸改良的土壤对Cu2+的吸附能力明显提高.腐殖质含有醇羟基、酚羟基、羧基、磺酸基、甲氧基等含氧活性官能团,可以通过离子交换、键合、表面吸附、凝聚等作用去除 Cu2+[10-12].
腐殖土是森林中表土层树木的枯枝残叶经过长时期腐烂发酵后而形成.它既具有多孔、疏松结构,又含有大量腐殖质,因此腐殖土可利用自身的物理结构特点通过其所包含的化学基团来吸附去除Cu2+.
目前国内外关于腐殖土对Cu2+的吸附特性和机理研究的报道较少.因此,本文选用腐殖土作为吸附剂,考察吸附时间、Cu2+的初始浓度、腐殖土投加量、初始p H值和温度等因素对吸附过程的影响,并通过吸附动力学、吸附等温线和红外光谱(FTIR)等方法分析探讨其吸附机理.
1 材料与方法
1.1 试验材料
试验用腐殖土由日本 W.T.M公司生产,经研磨过60目(<250μm)筛得到腐殖土粉末,用EM430分析透射型电子显微镜观察发现腐殖土具有多孔疏松的“海绵体”结构,这种结构具有巨大的表面积和吸附容量.
腐殖土主要化学成分见表1.由表1可知,腐殖土主要化学成分是SiO2和有机质,并且富含Ca,Mg,Al,Fe[9,13].腐殖土中有机质的主要成分是腐殖质(HS),研究发现HS具有聚苯环结构,并且苯环上含有大量活性官能团[14].利用Nicolet5700智能傅里叶红外光谱仪对腐殖土进行红外光谱分析,其实验结果如图1所示.由图1可知,试验所用腐殖土含有羟基、羧基和芳香基等活性基团.
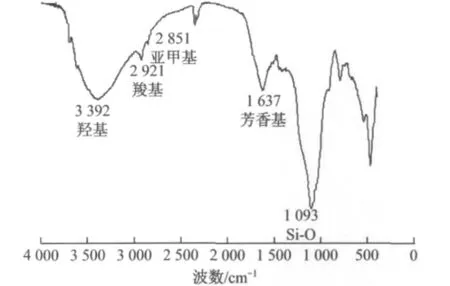
图1 腐殖土红外光谱图Fig.1 Infrared spectrogram of humus soil
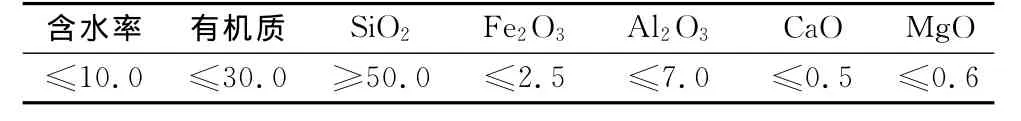
表1 腐殖土各化学成分的质量分数Tab.1 Chemical components of humus soil%
试验用Cu2+溶液是由分析纯五水硫酸铜(CuSO4·5H2O)和去离子水配制.
1.2 试验方法
配制一定浓度的Cu2+溶液,按一定固液比称取腐殖土粉末倒入溶液中.混合均匀后放入DKY-Ⅱ恒温调速回转式摇床(上海社科自动化设备有限公司)中振荡(150 r·min-1,一定温度),一段时间后取上清液过0.45μm膜.利用Optima 2100 DV型等离子体发射光谱仪(美国Perkin Elmer公司)测定溶液中Cu2+的浓度.试验中样品均做平行试验,取试验数据的平均值作为Cu2+的吸附平衡浓度,利用下式计算即得吸附平衡时腐殖土对Cu2+的单位吸附量:
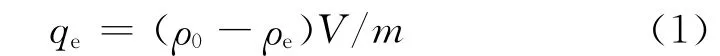
式中:ρ0为初始溶液Cu2+质量浓度,mg·L-1;ρe为吸附达到平衡时Cu2+质量浓度,mg·L-1;V为水溶液体积,m L;m为混合溶液中腐殖土的质量,g.
2 结果与分析
2.1 腐殖土对Cu2+的吸附作用
2.1.1 时间对吸附的影响
配制500 m L p H值为5、Cu2+质量浓度为60 mg·L-1的溶液,然后按1∶200的固液比(质量与体积的比,全文同)投加腐殖土粉末,立即混匀放入摇床中振荡(150 r·min-1,25℃±1℃),分别在10,20,30,120,180,300,360,480,1 440 min 时 取样,测定溶液中铜的浓度,其实验结果如图2所示.
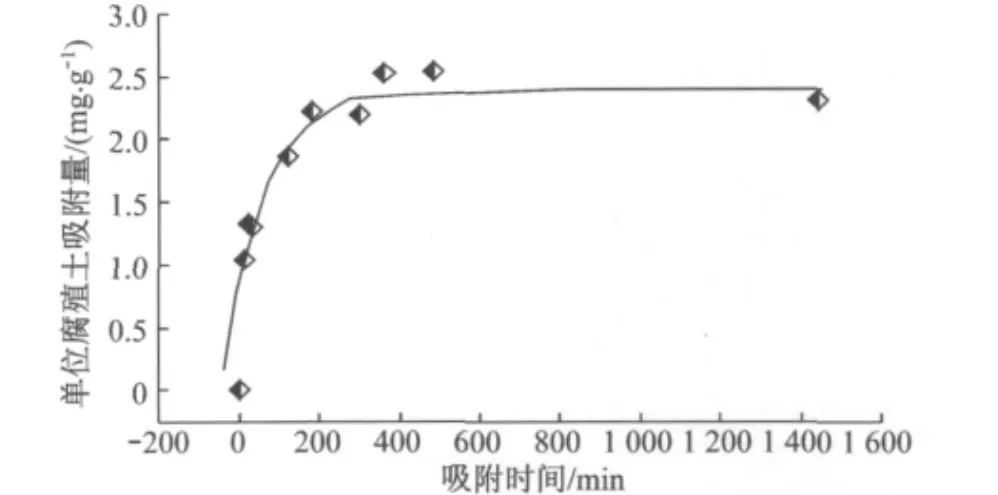
图2 吸附时间对腐殖土吸附Cu2+的影响Fig.2 Influence of adsorption time on the sorption of Cu2+to humus soil
由图2可知,随着吸附时间的延长,单位腐殖土吸附速度逐渐减小,而单位吸附量逐渐增大,直至吸附达到平衡.在0~30 min时间段内吸附速率很快,单位吸附量从0增长至1.29 mg·g-1;30~360 min时间段内吸附速率减慢,单位吸附量由1.29 mg·g-1增长到2.53 mg·g-1;480 min后单位吸附量基本不变,吸附达到平衡.
吸附开始时腐殖土具有较大的表面能,并且Cu2+浓度高,所以吸附速度较快.随着吸附的进行,腐殖土会析出诸如 Fe3+,Al3+,Mg2+和 Ca2+等离子,并且腐殖质水解电离出H+[15](平衡时p H值为3.2),这些阳离子会与Cu2+竞争吸附位点.因此随着腐殖土表面吸附位点的减少和Cu2+浓度下降,吸附速度逐渐下降,直至达到吸附饱和.由图2可知,大于10 h时吸附即可达到平衡,此时混合液中Cu2+的浓度基本稳定,因此后续试验均在24 h取样测定.
2.1.2 腐殖土投加量对吸附的影响
维持其他条件不变,分别按1∶10,1∶20,1∶50,1∶100,1∶200的固液比投加腐殖土粉末,振荡24 h后取样,测定溶液中铜的浓度,其实验结果如图3所示.由图3可知,随着固液比的降低,单位吸附量逐渐增大.固液比从1∶10下降到1∶200,单位吸附量从0.32 mg·g-1上升至2.31 mg·g-1.
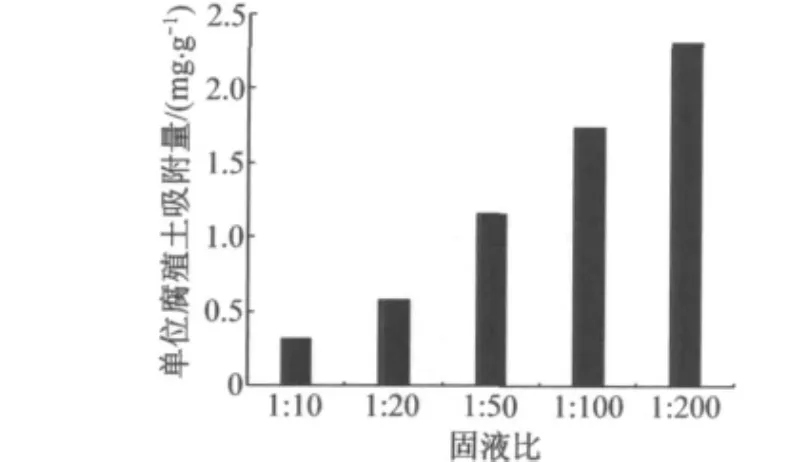
图3 腐殖土投加量对腐殖土吸附Cu2+的影响Fig.3 Influence of humus dosage on the sorption of Cu2+to humus soil
随着固液比的降低,即腐殖土投加量的减少,腐殖土颗粒表面与溶液中Cu2+接触和吸附的机会增加,因此单位腐殖土吸附量逐渐增大.此外,溶液中Mg2+,Ca2+,Fe3+和 Al3+的平衡浓度随着腐殖土投加量的增加显著增加,吸附平衡时的Fe3+和Al3+析出量分别从9.04 mg·L-1,15.40 mg·L-1增加至115.02 mg·L-1,333.90 mg·L-1;而p H 值随着投加量的增加而下降,吸附平衡时的p H值从3.3下降至2.6,较高浓度阳离子也会影响腐殖土对Cu2+的吸附.因此,随着腐殖土投加量的增大,虽然腐殖土吸附总量增加,但单位腐殖土吸附量减小.
2.1.3 Cu2+初始质量浓度对吸附的影响
在2.1.1基础上,维持其他条件不变,改变Cu2+的初始质量浓度,分别为5,10,20,30,40,60 mg·L-1,振荡24 h后取样,测定溶液中Cu2+的质量浓度,其实验结果如图4所示.由图4可知,随着初始质量浓度的增加,单位吸附量逐渐增大.当Cu2+溶液初始质量浓度从5 mg·L-1增加到60 mg·L-1时,单位吸附量从0.35 mg·g-1逐渐增长至2.31 mg·g-1.
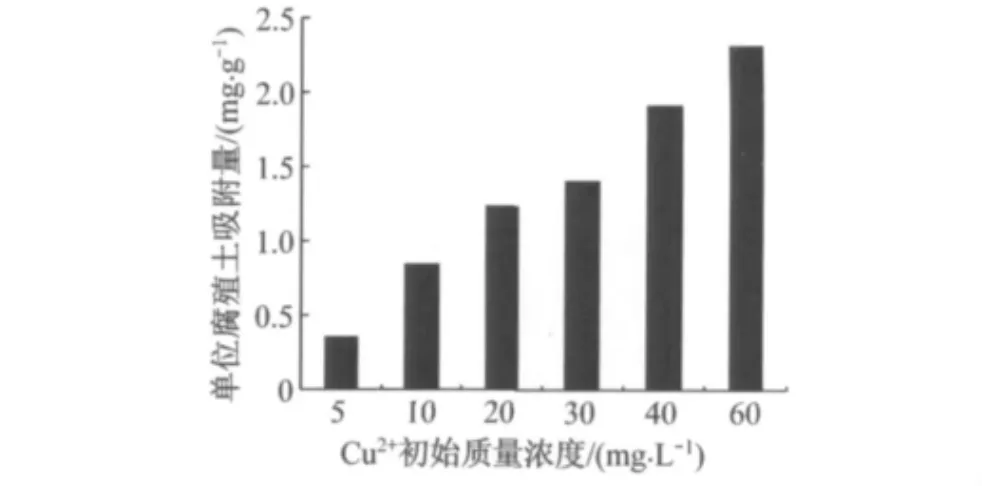
图4 Cu2+离子初始质量浓度对腐殖土吸附Cu2+的影响Fig.4 Influence of Cu2+ initial concentration on the sorption of Cu2+to humus soil
随着Cu2+质量浓度的增大,Cu2+与腐殖土表面碰撞和吸附的机率增大,因此单位吸附量也逐渐增加,直至吸附位点达到饱和[8].
2.1.4 初始p H值对吸附的影响
维持其他条件不变,用HCl和NaOH调节溶液初始p H值至2~12,振荡24 h后取样,测定溶液中Cu2+的质量浓度,其实验结果如图5所示.由图5可知,当初始p H值从2升至6时,单位吸附量从1.40 mg·g-1缓慢增长至2.25 mg·g-1;当初始p H 值从7升至11时,单位吸附量从3.51 mg·g-1增长至5.10 mg·g-1,当初始p H 值为12时,单位吸附量急剧上升至8.95 mg·g-1.
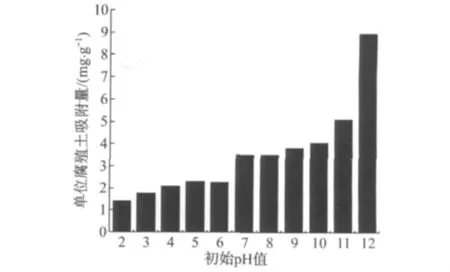
图5 Cu2+溶液初始p H值对腐殖土吸附Cu2+的影响Fig.5 Influence of initial p H on the sorption of Cu2+to humus soil
当p H值较低时,腐殖土表面质子化,腐殖质中的羧基、羟基等基团电离程度低,难以与Cu2+形成络合物[16-17],此时吸附作用主要表现为 Cu2+与 H+及其他阳离子的离子交换,因此吸附量小[18].随着p H值的升高,溶液中H+浓度降低,腐殖质中的活性基团电离程度增大,它们与Cu2+发生络合反应,因此吸附量逐渐增加[18-19].当初始p H 值为12时,吸附达到平衡时溶液显碱性,此时溶液中铜的主要形态是Cu(OH)+和Cu(OH)2,部分铜会以沉淀形式析出,因此吸附量迅速增加.
2.1.5 温度对吸附的影响
在2.1.3的基础上,分别进行摇床温度为15,35和45℃的吸附试验,其实验结果如图6所示.由图6可知,温度对Cu2+的吸附的影响并不显著.温度升高有利于腐殖土中的活性基团电离吸附Cu2+,但是这对以范德华力为主的物理吸附不利,因为温度升高会使分子运动加快,从而使解析的速度增加;此外,随着温度的升高吸附剂的空隙结构溶解性增大,这在一定程度上也影响到单位腐殖土吸附量的提高[20].因此,在多重因素的影响下,腐殖土对Cu2+单位吸附量基本不受温度的影响.

图6 温度对腐殖土吸附Cu2+的影响Fig.6 Influence of temperature on the sorption of Cu2+to humus soil
2.2 吸附动力学
常见的动力学模型有Lagergren准一级动力学模型和准二级动力学模型.前者基于假定吸附速率是由扩散步骤决定,而后者基于假定吸附速率是由化学吸附过程控制[21].
(1)准一级动力学方程
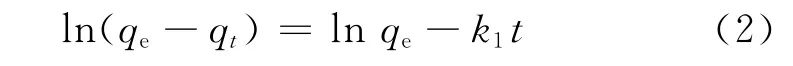
式中:qe为实际吸附量,mg·g-1;qt为时刻t的吸附量,mg·g-1;k1为准一级动力学吸附速率常数,min-1;t为吸附时间,min.
(2)准二级动力学方程
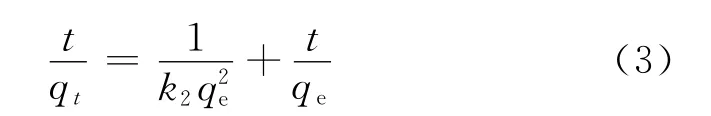
式中:k2为准二级动力学吸附速率常数,g·mg-1·min-1.
分别采用准一级和准二级动力学方程对腐殖土吸附Cu2+的过程进行动力学拟合,其结果如表2所示.由表2可见,腐殖土吸附Cu2+过程拟合准二级动力学相关系数R2=0.989 9,而且计算得出的平衡吸附量qe1与实验所得实际吸附量qe非常接近,这表明腐殖土对Cu2+的吸附行为符合准二级动力学方程,吸附过程以化学吸附为主.
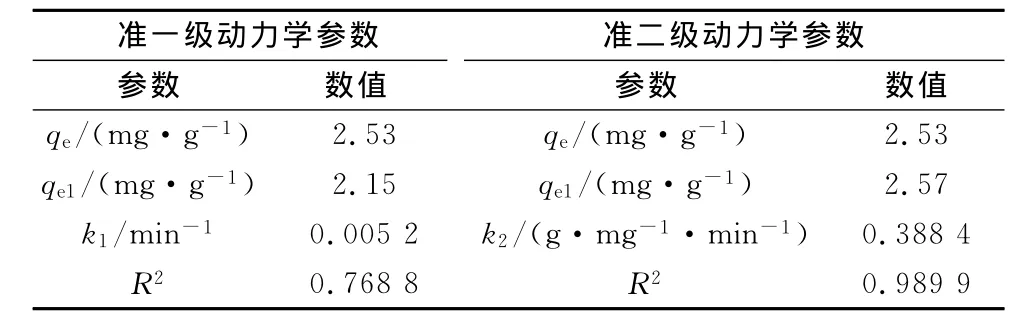
表2 腐殖土吸附Cu2+的动力学参数Tab.2 Dynamic parameters of Cu2+ sorption on humus soil
2.3 吸附等温曲线
吸附等温曲线是指在一定温度下溶质分子在两相界面上进行的吸附过程达到平衡时它们在两相中浓度之间的关系曲线.通常用来描述水溶液中吸附过程的吸附等温线有Langmuir方程、Freundlich方程和D-R方程.
(1)Langmuir吸附等温式
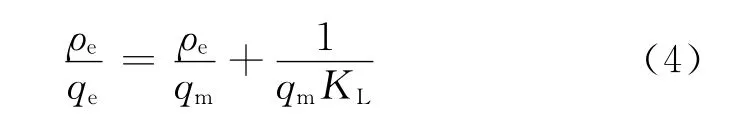
式中:qm为单位吸附剂表面盖满单分子层时的吸附量,即饱和吸附量,mg·g-1;KL为Langmuir吸附系数,L· mg-1.
(2)Freundlich吸附等温式
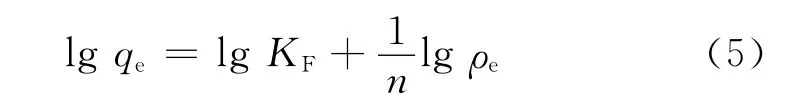
式中:KF为Freundlich吸附系数,mg1-n·Ln·g-1;n为常数,与吸附体系的性质有关.
(3)D-R吸附等温式

式(6)—(8)中:β为与吸附能量相关的活度系数,mol2·kJ-2;ε为Polanyi势;R 为理想气体常数,8.314 J·mol-1·K-1;T 为温度,K;E 为平均吸附自由能,kJ·mol-1.
Langmuir吸附等温模型假设吸附剂表面均一,吸附过程是单分子层吸附;而Freundlich吸附等温模型描述的吸附剂表面不均匀,吸附过程是多层分子层吸附[22-23].3种吸附等温模型拟合参数如表3所示,从相关系数知,Langmuir和Freundlich模型均可描述腐殖土对Cu2+的吸附,但Freundlich模型更为准确,因此可以认为该吸附过程是多层分子层吸附.Freundlich模型中参数KF几乎不随温度变化,表明腐殖土对Cu2+吸附受温度影响很小,这与2.1.5的结论相一致.一般认为,表征吸附强度的1/n决定了等温线的形状及吸附类型,若0<1/n<1.0则易于吸附[24].本次试验1/n均在此范围内,说明腐殖土对Cu2+具有较强的吸附能力.
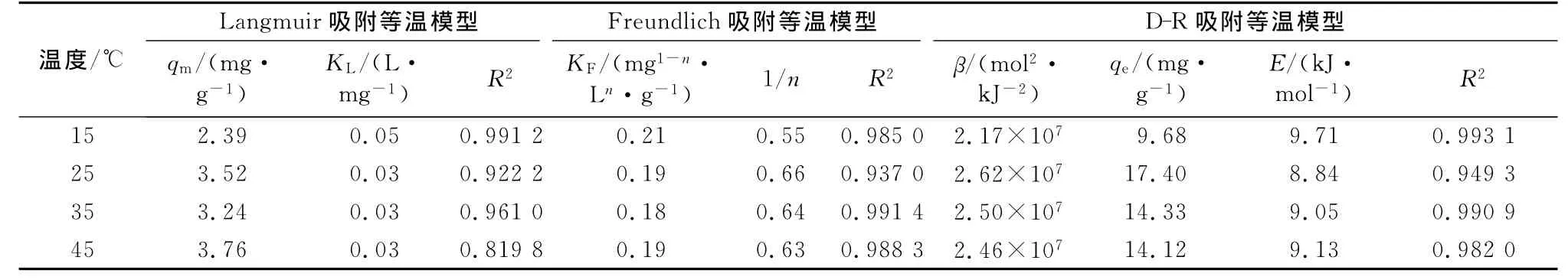
表3 Langmuir,Freundlich和D-R吸附等温模型拟合参数Tab.3 Langmuir,Freundlich and D-R isotherm parameters
D-R模型认为,当E<8 kJ·mol-1时,吸附过程为物理吸附;当8 kJ·mol-1<E<16 kJ·mol-1时,吸附过程为化学吸附;当E>16 kJ·mol-1时,吸附过程为颗粒扩散.本次试验拟合腐殖土对Cu2+吸附所得的吸附自由能分别为9.71,8.84,9.05,9.13 kJ·mol-1,说明腐殖土对Cu2+的吸附以化学吸附为主,该结论也与2.2结论一致.
2.4 红外光谱(FTIR)
为了进一步了解腐殖土对Cu2+的吸附机理,在初始p H值分别为5和11的试验条件下,对吸附后的腐殖土进行红外光谱分析,其实验结果如图7所示.图7中,a,b分别表示初始p H值为5时腐殖土本身和腐殖土吸附Cu2+后的红外光谱图,c,d分别表示初始p H值为11时腐殖土本身和腐殖土吸附Cu2+后的红外光谱图.
由图7可知,腐殖土吸附Cu2+后峰形基本不变,仅吸收峰强度发生变化.当初始p H值为5时,羟基的特征峰由3 429 cm-1移动到3 391 cm-1,芳香基的特征峰由1 633 cm-1移动到1 625 cm-1;当初始p H值为11时,芳香基的特征峰由1 625 cm-1移动到1 646 cm-1.这表明当初始p H值为5时,参与吸附的化学基团主要是羟基和芳香基;而当p H值为11时,参与吸附的化学基团主要是芳香基[25].
腐殖土中的腐殖质能与Cu2+键合形成稳定的络合物,并且可质子化的氢和其他阳离子可与Cu2+进行离子交换[26],这些特性都能使腐殖土吸附去除Cu2+.Golonka等人研究发现能与Cu2+发生络合作用的主要是含氧基团[27],由于化学性质不同,它们与Cu2+的键合能力存在差异,并且活性基团酸解常数的不同也影响吸附效果,因此不同p H条件下参与吸附的基团是不同的.此外,腐殖质与Cu2+键合形成的内界络合物带有较强的共价性[28],因此腐殖土吸附Cu2+后不易再次析出,从而避免二次污染.
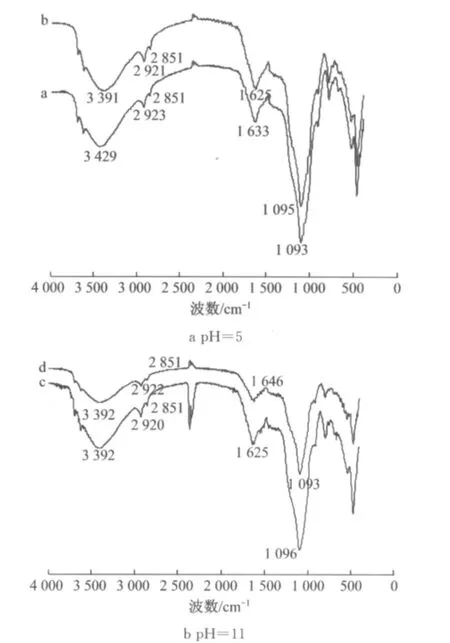
图7 腐殖土吸附Cu2+的红外光谱图Fig.6 Infrared spectrogram of the sorption of Cu2+to humus soil
3 结论
(1)腐殖土可以较好地吸附去除废水中的Cu2+,吸附过程受吸附时间、Cu2+初始质量浓度、腐殖土投加量和初始p H值等因素影响,而温度对吸附过程基本无影响.单位腐殖土对Cu2+的吸附量随着吸附时间的延长而增加,480 min时达到吸附平衡;随着腐殖土投加量的增加而减少,但是腐殖土吸附总量增加;随着初始浓度的增大而增加;随着初始p H值的上升而增加,当p H值为12时吸附量增幅较大.
(2)腐殖土吸附Cu2+的过程可用准二级吸附速率方程表示,整个过程以化学吸附为主.Langmuir和Freundlich等温吸附方程式都可以用来描述腐殖土吸附Cu2+的过程,但Freundlich等温吸附过程描述更为准确.
(3)在腐殖土吸附Cu2+的过程中,参与吸附的主要化学基团是羟基和芳香基,但是在不同p H条件下参与吸附的化学基团并不完全相同.
[1] Stumm W,Morgan J J.Aquatic chemistry:chemical equilibria and rates in natural waters [M]. New York:Wiley Interscience,1995.
[2] Wu L H,Luo Y M,Christie P,et al.Effects of EDTA and low molecular weight organic acids on soil solution properties of a heavy metal polluted soil[J].Chemosphere,2003,50:819.
[3] Patterson J W.Industrial wastes reduction[J].Environmental Science and Technology,1989,23(9):1032.
[4] Demirbas E,Dizge N,Sulak M T.Adsorption kinetics and equilibrium of copper from aqueous solutions using hazelnut shell activated carbon [J].Chemical Engineering Journal,2009,148:480.
[5] Motsi T,Rowson N A,Simmons M J H.Adsorption of heavy metals from acid mine drainage by natural zeolite [J].International Journal of Mineral Processing,2009,92:42.
[6] HeÂqueta V,Ricoua P,Lecuyer I,et al.Removal of Cu2+and Zn2+in aqueous solutions by sorption onto mixed fly ash[J].Environmental Science and Technology,2001,80:851.
[7] 夏畅斌,何湘柱.磺化褐煤对重金属离子的吸附作用研究[J].材料保护,2000,33(3):19.XIA Changbin,HE Xiangzhu.Study on adsorption of heavy metal on sulfonated lignite[J].Material Protection,2000,33(3):19.
[8] 黄雅曦,李季,李国学,等.钝化剂对重金属的吸附及其吸附机理的研究[J].东北农业大学学报,2008,39(8):53.HUANG Yaxi,LI Ji,LI Guoxue,et al.Adsorption mechanism of heavy metals in passivation[J].Journal of Northeast Agriculture University,2008,39(8):53.
[9] Pranav K C,Chandra S S.Sorption kinetics and leachability of heavy metal from the contaminated soil amended with immobilizing agent(humus soil and hydroxyapatite) [J].Chemosphere,2006,64:1109.
[10] 吴敏,朱睿,潘孝辉,等.腐殖土理化性质的研究[J].工业用水与废水,2009,40(1):61.WU Min,ZHU Rui,PAN Xiaohui,et al.Physicochemical characteristics of humus soil [J].Industrial Water and Wastewater,2009,40(1):61.
[11] Jansen B,Nierop K G,Verstraten J M.Mobility of Fe(II),Fe(III)and Al in acidic forest soils mediated by dissolved organic matter:influence of solution PH and metal/organic carbon ratios[J].Geoderma,2003,113(34):323.
[12] Milne C J,Kinniburgh D G,Riemsdijk V W H,et al.Generic NICA Donnan model parameters for metal ion binding by humus substances[J].Environmental Science and Technology,2003,37(2):958.
[13] 吴敏,朱睿,魏传银,等.腐殖土对活性污泥中重金属形态分布的影响[J].同济大学学报:自然科学版,2010,38(2):263.WU Min,ZHU Rui,WEI Chuanyin,et al.Effects of humus soil on chemical speciation of heavy metals in activated sludge[J].Journal of Tongji University:Natural Science,2010,38(2):263.
[14] 傅平青,刘丛强,吴丰昌.水环境中腐殖质 金属离子键合作用研究进展[J].生态学杂志,2004,23(6):143.FU Pingqing,LIU Congqiang,WU Fengchang.Binding of metal-ion with humic substances in aquatic environments[J].Chinese Journal of Ecology,2004,23(6):143.
[15] 曹亚锋,王平,罗文连,等.风化煤对水中重金属离子的吸附[J].环境科学管理,2010,35(7):85.CAO Yafeng,WANG Ping,LUO Wenlian,et al.Adsorption of heavy metal on danty [J].Environmental Science and Management,2010,35(7):85.
[16] NilIce C C,Rocha D A,Reinaldo C,et al.Cadmium uptake by hydroxyapatite synthesized in different conditions and submitted to thermal treatment[J].Environmental Science and Technology,2002,36(7):1630.
[17] Hui K S,Chao C Y H,Kot S C.Removal of mixed heavy metal ions in wastewater by zeolite and residual products from recycled coal fly ash [J].Journal of Hazardous Materials,2005,127(13):89.
[18] 郝艳玲,范福海.风化煤对水中重金属离子的吸附[J].洁净煤技术,2008,14(5):104.HAO Yanling,FAN Fuhai.Adsorption of heavy metal on danty[J].Clean Coal Technology,2008,14(5):104.
[19] 徐启杰,张果,崔元臣.腐植酸的吸附性能及其金属络合物的应用[J].天中学刊,2007,22(5):22.XU Qijie,ZHANG Guo,CUI Yuanchen.The adsorption of humic acid and the application of its metal complex[J].Journal of Tianzhong,2007,22(5):22.
[20] Fan Q H,Shao D D,Lu Y,et al.Effect of pH,ionic strength,temperature and humus substances on the sorption of Ni(II)to Na-attapulgite[J].Chemical Engineering Journal,2009,150:188.
[21] Pehlivan E,Altum T.Biosorption of chromium(VI)ion from aqueous solutions using walnuh,and almond shells[J].Journal of Hazardous Materials,2008,155:378.
[22] Bellot J C,Condoret J S.Modeling of liquid chromatography equilibria[J].Process Biochem,1993,28(2):365.
[23] Langmuir I.The constitution and fundamental properties of solids and liquids[J].Journal of the American Chemical Society,1916,38(11):2267.
[24] 王雯,谢丽,王帅,等.钢渣对阴离子染料刚果红的吸附特性和机理[J].同济大学学报:自然科学版,2010,38(8):1182.WANG Wen,XIE Li, WANG Shuai,et al.Adsorption properties and mechanism of anionic congo red dyeing wastewater by steel slag[J].Journal of Tongji University:Natural Science,2010,38(8):1182.
[25] Alvarez-Puebla R A,Valenzuela-Calahorro C,Garrido J J.Cu(II)retention on a humic substance[J].Journal of Colloid and Interface Science,2004,270:47.
[26] 吴景贵,席时权,姜岩.土壤腐殖质的分析化学研究进展[J].分析化学,1997,25(10):1221.WU Jinggui,XI Shiquan,JIANG Yan.The research progress of the chemical analysis of the humus soil[J].Chinese Journal of Analytical Chemistry,1997,25(10):1221.
[27] Golonka I,Czechowski F,Jezierski A.EPR characteristics of heat treated complexes of metals with demineralised humic brown coal in air and ammonia atmospheres[J].Geoderma,2005,127(34):237.
[28] 傅平青,刘丛强,万鹰昕,等.水环境中腐殖质对重金属吸附行为的影响[J].矿物岩石地球化学通报,2002,21(4):277.FU Pingqing,LIU Congqiang,WAN Yingxin,et al.The influence of heavy metal adsorption behavior of humus in aquatic environments[J].Bulletin of Mineralogy Petrology and Geochemistry,2002,21(4):277.

