冠心病候选基因β2肾上腺素能受体基因相关微小核糖核酸let-7i的实验研究
郭威早,李琳
β2肾上腺素能受体基因[人类基因组织(HUGO)命名委员会(HGNC)标准全名:“adrenergic,beta-2-,receptor,surface”,HGNC 标准基因代号:ADRB2],是冠心病的重要候选基因,与重型进行性冠心病,例如伴有急性心肌梗死的冠心病关系尤为密切[1]。该基因的蛋白产物属于G蛋白偶联受体家族,通过G蛋白作用介导儿茶酚胺诱导的腺苷酸环化酶活化。在结构方面,该基因非常特殊,同绝大多数结构基因不同,该基因没有内含子,因此该基因在表达调控方面可能具备区别于大多数基因的特点。此外,该基因的5’侧翼序列中含有糖皮质激素反应基序(glucocorticoid response element,GRE)[2],而糖皮质激素与应激及心功能关系极为密切[3]。因此该基因具有GRE的结构特点,有助于合理地解释冠心病与应激的密切关系[4]。微小核糖核酸(microRNA,简称miRNA)是生物体中内源性的,由基因表达产生的RNA分子,其最终的活性形式为短链RNA分子,长度为22核苷酸左右,通过与相关的信使RNA结合抑制其翻译或诱发其降解。miRNA通过基因调控,在细胞的生长、发育、分化以及对环境的适应中发挥着非常重要的作用[5]。探讨miRNA调控机制与ADRB2的基因功能的关系,可以更深入地认识ADRB2的基因调控机制,亦可以促进对冠心病的分子病理学的认识,为探索新的预防和治疗途径提供分子水平的新线索。
1 资料与方法
调节ADRB2基因候选miRNA的预测:miRNA机制是一类特殊的基因调控机制,miRNA和被调控基因之间没有特定的、严格的对应关系,具有“一对多、多对一”的特点,复杂的网络模式使直接的实验验证难度很高、成本巨大。因此,对调节特定基因的miRNA进行预测具有重要的实用意义。基于上述原因,学界对miRNA与靶位点之间的模糊匹配关系进行了大量深入的研究,建立了行之有效的预测模型。本研究所采用的预测方法就是依据既往研究所发现的一种组合策略[6],这一策略认为,如果以下二个条件满足,则相关miRNA和基因之间就具备调控和被调控关系:①从miRNA 5’端第一或第二碱基算起的7个连续碱基的“核”序列或“种子”序列与被调节基因3’端非转录区(UTR)部分序列构成完全Watson-Crick匹配(即符合碱基配对原则的匹配);②上述“核”序列和3’-UTR对应序列之间可以具有不匹配的碱基,只要二者结合的自由能不增加并且不含G∶U配对。此策略简称为“种子区”(seed-region)预测法,按种子区法,利用美国麻省理工学院(MIT)TargetScan数据库(2011-11第6版),对人ADRB2基因561bp(根据NCBI编号为NM_000024的参考序列)的3’-UTR进行了候选miRNA的预测。
心肌细胞株培养:实验研究于2011-09至2012-04之间进行。大鼠心肌细胞株H9c2(2-1)按照既往报道的方法[7]进行培养。基本步骤为,采用DMEM培养基加10%胎牛血清,在5%CO2,37℃条件下培养。一轮培养3天,然后按1∶4的比例分盘继续培养,细胞脱壁收集采用0.25%胰蛋白酶合并0.53 mM依地酸二钠(EDTA)溶液处理10 min。
miRNA的增强和抑制:Pre-miR miRNA前体(增强剂)和Anti-miR miRNA抑制剂及相应对照均从美国Ambion公司购买。根据相应miRNA序列的随机化紊乱(scramble)序列所合成的短链RNA作为阴性对照。采用美国Neuromics公司iFect转染试剂盒,将let-7i增强剂(n=6)、抑制剂(n=6)及miRNA阴性对照(n=6)分别导入培养的H9c2(2-1)大鼠心肌细胞,具体操作按照该试剂盒说明书进行。每种miRNA转染剂量在前期预实验的基础上,正式实验剂量选择为20 nmol/L。细胞在转染后状态继续培养48 h。
蛋白免疫印迹杂交:蛋白免疫印迹杂交(Western Blot)参照文献报道[7]方法进行,作了少许简化和适应性修改。具体步骤简述如下,将所收集的约106心肌细胞重悬于1ml冰冷的裂解缓冲液,匀浆后通过Virtis超声细胞粉碎仪进行超声剪切,继以14000g离心5 min去除不溶性沉渣。蛋白浓度测定采用Pierce公司BCA蛋白试剂盒进行。等量的蛋白加入到8% ~16%SDS-PAGE凝胶进行电泳分离,然后电转移至硝酸纤维素膜。硝酸纤维素膜上的非特异结合通过以下杂交液屏蔽。杂交液包括Tris缓冲盐水,0.1%吐温-20?,5%脱脂牛奶。兔抗人 ADRB2抗体购自美国Santa-Cruz生物技术公司,该抗体除可用于人源性ADRB2蛋白的检测,亦可以用于大鼠ADRB2蛋白的检测。实验中采用1∶200的比例稀释。β-肌动蛋白抗体(美国Cell Signaling公司)用作上样对照。次级抗体为辣根过氧化物酶耦联的抗兔抗体。免疫复合物用Amersham ECL加强型试剂盒探测。免疫印迹的定量分析采用Syngene凝胶建档及分析系统进行。
统计分析:一元ANOVA采用SPSS 11.5版进行。资料收集,一般统计计算(均值±标准差等)以及统计作图采用GraphPad Prism(第4版)进行。P<0.05为差异有统计学意义。
2 结果
miRNA let-7家族与ADRB2基因关系:根据预测结果,约有150个 miRNA具有不同程度的调节人ADRB2基因的可能性。表1列举了种子区完全配对的ADRB2基因候选miRNA。
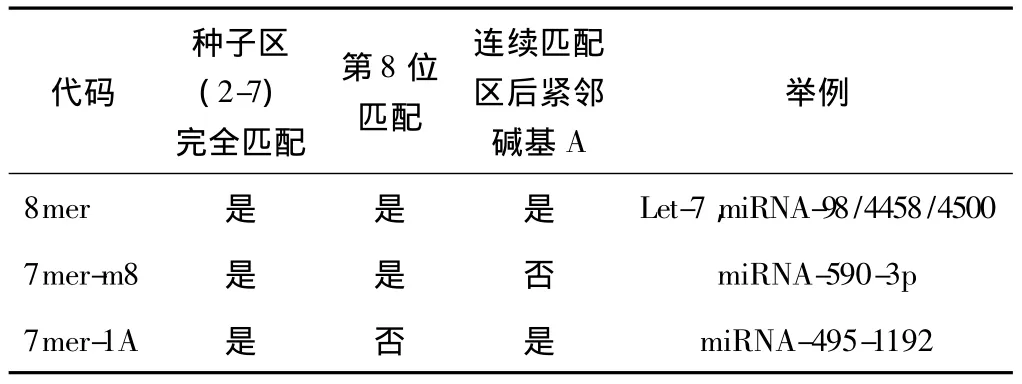
表1 种子区完全配对的β2肾上腺素能受体基因候选微小核糖核酸
其中4个miRNA家族具有种系稳定性(conservation)[8]:灵长类、啮齿类等动物之间具有高度一致的同源性。该4个miRNA家族中11个miRNA成员按照种子区原理与ADRB2具有很好的匹配性,无论从5’端的第一个或第二个碱基开始,均表现为其后7个碱基的完全Watson-Crick配对,也就是5’端开始的8个碱基的完全配对,符合种子区挑选法的最高要求。4个 miRNA 家族为 miRNA-98、miRNA-4458、miRNA-4500和let-7,其中let-7家族与 ADRB2关系特别明显,let-7家族的 8个成员,let-7a/b/c/d/e/f/g/i,都对ADRB2基因具有理论预测的调控作用。根据已知的研究资料,在let-7家族内部,let-7i和冠心病关系密切[9],因此,被挑选作为进一步实验验证对象。
let-7i功能水平与ADRB2基因蛋白表达水平:用let-7i的Pre-miRNA前体和let-7i的Anti-miRNA分别对培养的大鼠心肌细胞株H9c2(2-1)实施转染,然后处理48 h.let-7i的原序列为5’-UGAGGUAGUAGUUUGUGCUGU-3’,采用美国麻萨诸塞大学医学院的在线程序实施紊乱化处理,得到的序列为5’-GAUGGGGCUUAGUUUUGUGUA-3’,作为实验的 miRNA阴性对照。大鼠心肌细胞在增强和抑制处理后,组织形态学无明显变化,根据倒置显微镜观察计数,let-7i增强剂作用的细胞计数比miRNA阴性对照高8% ~11%,但无统计学意义(P>0.05,图1)。
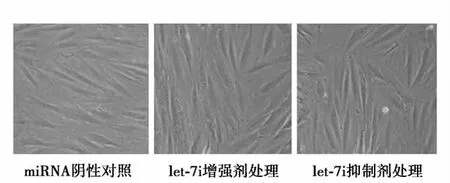
图1 经let-7i Pre-miRNA前体和let-7i Anti-miRNA抑制剂处理的大鼠心肌细胞
let-7i功能水平与ADRB2基因蛋白表达水平相关关系:使用 let-7i Pre-miRNA(增强剂)处理细胞48h后,ADRB2基因蛋白表达水平降低,以光密度(OD)所表示的蛋白水平由 miRNA阴性对照水平67.03±15.20下降至 25.59±10.53,下降了 61.83%(P=0.0012,95%可信区间:19.22~63.66);与 let-7i增强剂处理效果相反,当使用let-7i Anti-miRNA(抑制剂)处理细胞48 h后,ADRB2基因蛋白表达水平由miRNA阴性对照水平上升至99.53±25.23,升高了48.49%(P=0.0071,95% 可 信 区 间:-54.72~-10.28),let-7i功能水平与ADRB2基因蛋白表达水平呈负相关关系,见图2。
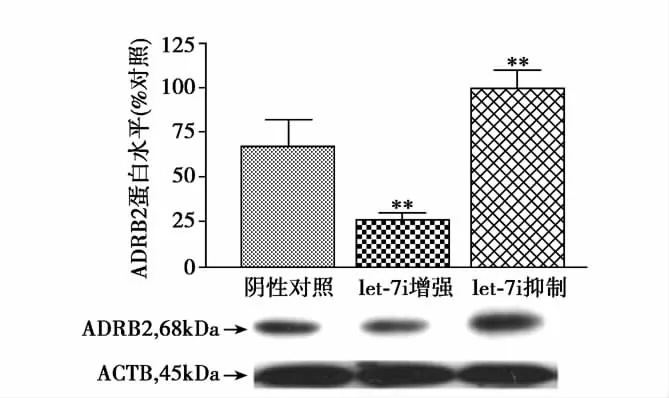
图2 let-7i增强剂和let-7i抑制剂对ADRB2蛋白质水平的影响。大鼠心肌细胞株H9c2(2-1)分别以let-7i增强剂和let-7i抑制剂转染处理48 h,ADRB2蛋白水平以免疫印迹杂交确定。图中蛋白水平为miRNA阴性对照水平的百分比(miRNA阴性对照水平设定为100%),β-肌动蛋白(ACTB)抗体作为电泳上样内参照。图示的数据为均值±标准差,每组6个样本(n=6),与miRNA阴性对照比较**P<0.01,统计检验采用方差分析
3 讨论
冠心病作为复杂性疾病,其发病机制尚无定论,但一般认为是遗传易感性和环境相互作用的结果[10]。在遗传易感性方面,研究主要聚焦于一些与冠心病发病密切相关的候选基因方面,例如ADRB2;在环境方面,应激因素历来是被关注的重点[11]。miRNA与上述二个方面都有极为密切的关系。首先,miRNA是近年来才发现的基因调控的重要机制,miRNA以特定的方式在转录后和翻译前调节众多基因的表达水平。此外,miRNA是机体应激反应中最重要的基因调控机制之一[12]。将上述二个方面联系起来,miRNA和冠心病之间存在联系具有极高的可能性。
本研究以冠心病一个重要候选基因ADRB2为基础,预测了可能调节该基因的miRNA。在调节ADRB2的多个miRNA家族中,let-7家族值得特别关注。首先,let-7家族具有广泛的种系稳定性或称为保守性,说明其在基因调控中具有基础级的重要作用。另外,本文作者自己和其他研究者的工作均提示,let-7家族与心血管病关系密切。第一点表现在间接关系方面。Let-7家族对细胞外信号调节激酶(ERK)的上游信号分子RAS通过多位点结合发挥重要的调节作用,此点已被研究证实[13]。另外,在let-7家族成员中非常值得关注的是,日本岩手医科大学佐藤卫等的研究提示[8],let-7i和冠心病具有直接的关联。用于冠心病预防和治疗的降脂药阿托伐他汀的一部分治疗作用就是通过调节let-7i实现的。因此,let-7i被挑选进行了实验验证。实验验证的结果和理论预计完全一致,let-7i的功能水平和ADRB2基因的蛋白表达呈明显的负相关。由此进一步证实了let-7家族对ADRB2基因存在调控作用的预测。此外,其它候选miRNA也值得关注,例如 miR-98与血管损伤有关[14],此外更值得关注的是,在血管加压素-Ⅱ所诱导的心肌肥厚中,miRNA-98和let-7的变化表现出联动性[15]。
目前的研究是基于心肌细胞的分子生物学研究,进一步采用实验动物的在体研究以及采用临床病例的应用研究是值得深入的研究方向。
[1]Piscione F,Iaccarino G,Galasso G,et al.Effects of Ile164 polymorphism of beta2-adrenergic receptor gene on coronary artery disease.J Am Coll Cardiol,2008,52(17):1381-1388.
[2]Cornett LE,HillerFC,JacobiSE,etal.Identification ofa glucocorticoid response element in the rat beta2-adrenergic receptor gene.Mol Pharmacol,1998,54(6):1016-1023.
[3]Van Acker SA,Fluttert MF,Sibug RM,et al.Intracerebroventricular administration of a glucocorticoid receptor antagonist enhances the cardiovascular responses to brief restraint stress.Eur J Pharmacol,2001,430(1):87-91.
[4]Alevizaki M,Cimponeriu A,Lekakis J,et al.High anticipatory stress plasma cortisol levels and sensitivity to glucocorticoids predict severity of coronary artery disease in subjects undergoing coronary angiography.Metabolism,2007,56(2):222-226.
[5]Hatfield SD,Shcherbata HR,Fischer KA,et al.Stem cell division is regulated by the microRNA pathway.Nature,2005,435(7044):974-978.
[6]Krek A,Grun D,PoyMN,et al.Combinatorial microRNA target predictions.Nat Genet,2005,37(5):495-500.
[7]郭威早,佟倩,曹立新等.微小RNA对心肌细胞C反应蛋白功能水平的调节.中国实验诊断学,2010,14(12):1900-1903.
[8]Friedman RC,Farh KK,Burge CB,et al.Most mammalian mRNAs are conserved targets of microRNAs.Genome Res,2009,19(1):92-105.
[9]Satoh M,Tabuchi T,Minami Y,et al.Expression of let-7i is associated with Toll-like receptor 4 signal in coronary artery disease:Effect of statins on let-7i and Toll-like receptor 4 signal.Immunobiology,2012,217(5):533-539.
[10]Madamanchi NR,Tchivilev I,Runge M.Genetic markers of oxidative stress and coronary atherosclerosis.Curr Atheroscler Rep,2006,8(3):177-183.
[11]Holmes SD,Krantz DS,Rogers H,et al.Mental stress and coronary artery disease:a multidisciplinary guide.Prog Cardiovasc Dis,2006,49(2):106-122.
[12]Leung AK,Sharp PA.microRNAs:a safeguard against turmoil?Cell,2007,130(4):581-585.
[13]Johnson SM,Grosshans H,Shingara J,et al.RAS is regulated by the let-7 microRNA family.Cell,2005,120(5):635-647.
[14]Xie S,Xie N,Li Y,et al.Upregulation of TRB2 induced by miR-98 in the early lesions of large artery of type-2 diabetic rat.Mol Cell Biochem,2012,361(1-2):305-314.
[15]Yang Y,Ago T,Zhai P,et al.Thioredoxin 1 negatively regulates angiotensin II-induced cardiac hypertrophy through upregulation of miR-98/let-7.Circ Res,2012,108(3):305-313.

